Содержание
- 2. Гидро́лиз ( от древне греческого «ὕδωρ»— вода и «λύσις» — разложение) — один из видов химических
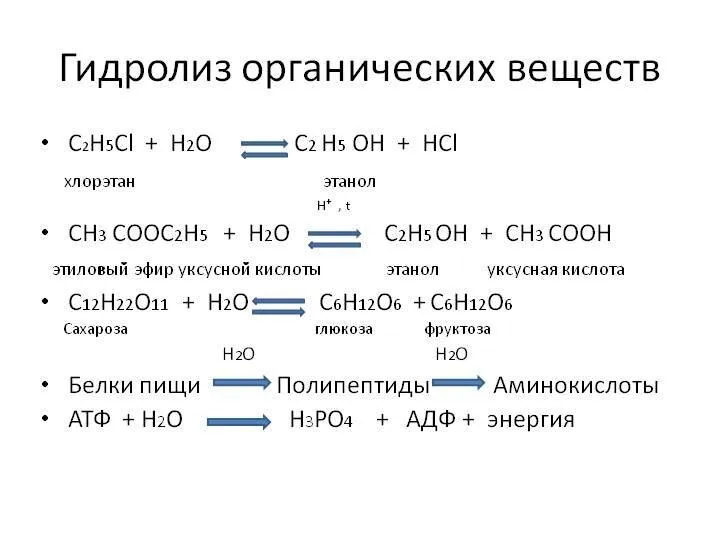
- 3. Гидролиз органических веществ Живые организмы осуществляют гидролиз различных органических веществ в ходе реакций при участии ФЕРМЕНТОВ.
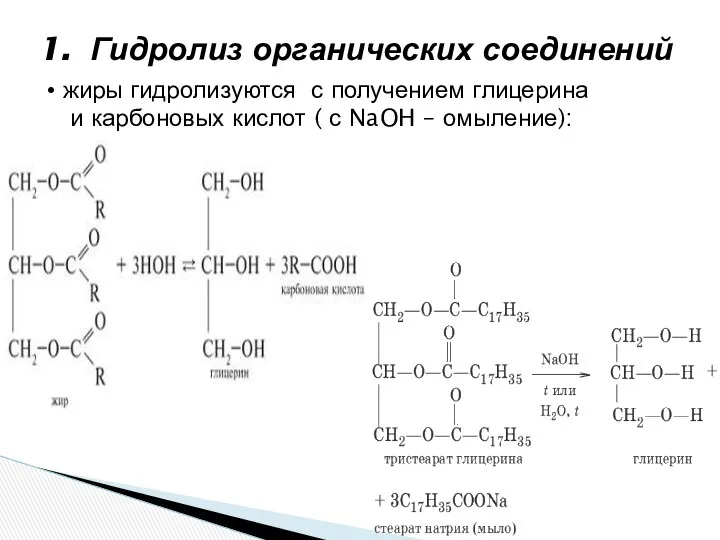
- 4. 1. Гидролиз органических соединений жиры гидролизуются с получением глицерина и карбоновых кислот ( с NaOH –
- 5. крахмал и целлюлоза гидролизуются до глюкозы:
- 7. 1. При гидролизе жиров образуются 1) спирты и минеральные кислоты 2) альдегиды и карбоновые кислоты 3)
- 8. 4. При гидролизе сложных эфиров образуются: 1) Спирты и альдегиды 2) Карбоновые кислоты и глюкоза 3)
- 9. 2. Обратимый и необратимый гидролиз Почти все рассмотренные реакции гидролиза органических веществ обратимы. Но есть и
- 10. Гидролиз солей — разновидность реакций гидролиза, обусловленного протеканием реакций ионного обмена в растворах (водных) растворимых солей-электролитов.
- 12. 1. Гидролиз соли слабой кислоты и сильного основания (гидролиз по аниону): (раствор имеет щелочную среду, реакция
- 13. 3. Гидролиз соли слабой кислоты и слабого основания: (равновесие смещено в сторону продуктов, гидролиз протекает практически
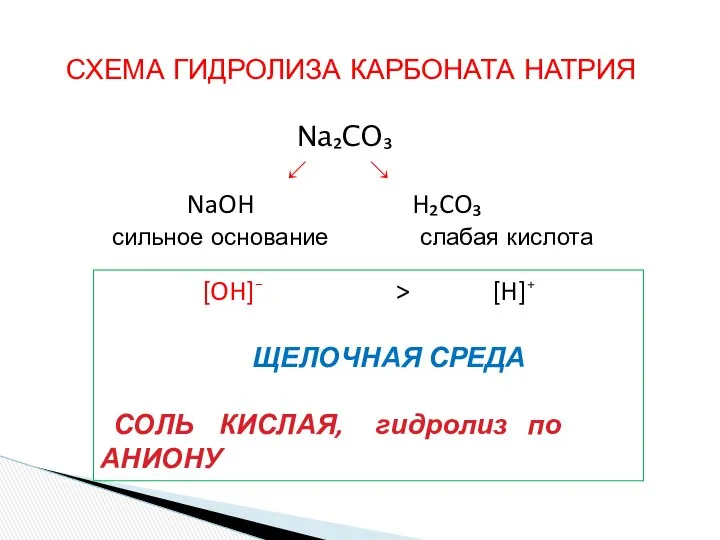
- 14. СХЕМА ГИДРОЛИЗА КАРБОНАТА НАТРИЯ Na₂CO₃ ↙ ↘ NaOH H₂CO₃ сильное основание слабая кислота [OH]⁻ > [H]⁺
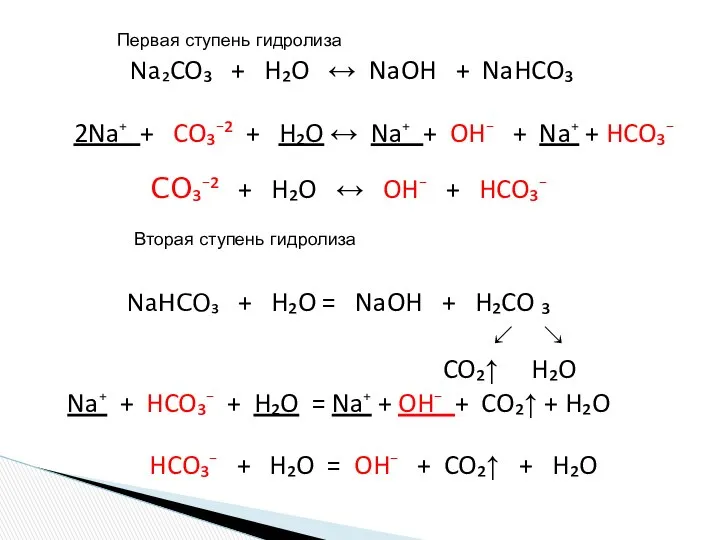
- 15. Na₂CO₃ + H₂O ↔ NaOH + NaHCO₃ 2Na⁺ + CO₃⁻² + H₂O ↔ Na⁺ + OH⁻
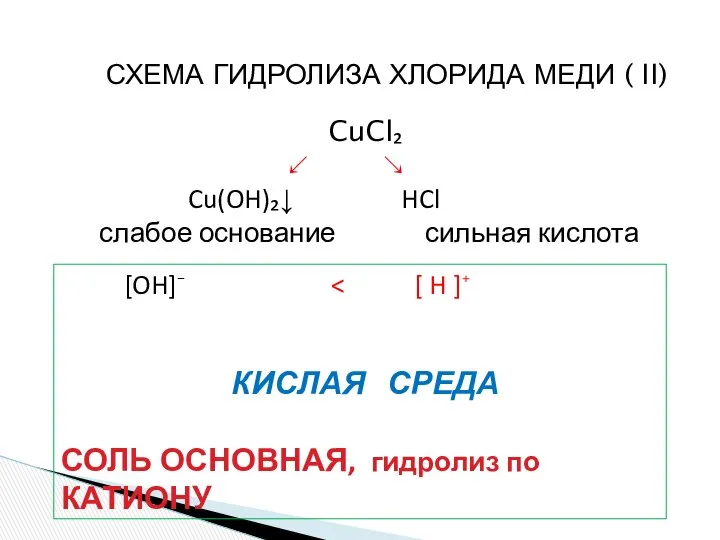
- 16. СХЕМА ГИДРОЛИЗА ХЛОРИДА МЕДИ ( II) CuCl₂ ↙ ↘ Cu(OH)₂↓ HCl слабое основание сильная кислота [OH]⁻
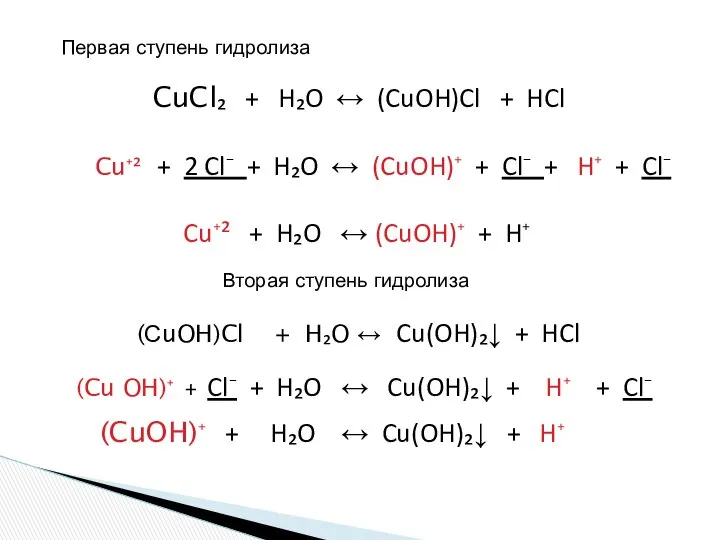
- 17. CuCl₂ + H₂O ↔ (CuOH)Cl + HCl Cu⁺² + 2 Cl⁻ + H₂O ↔ (CuOH)⁺ +
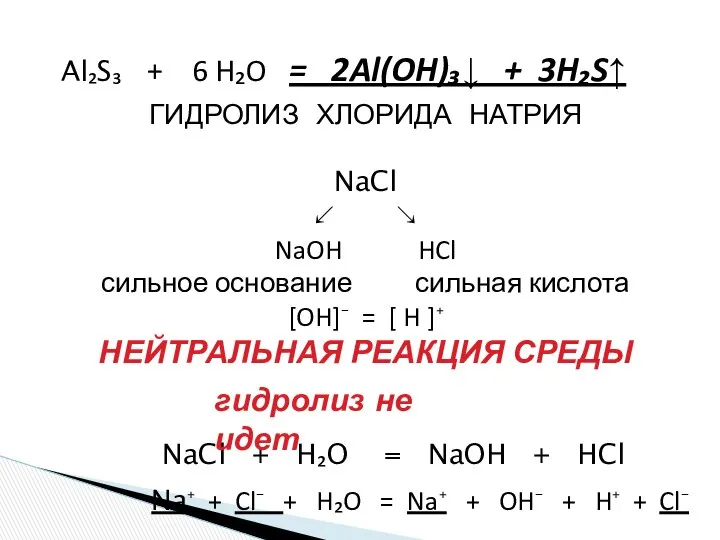
- 18. СХЕМА ГИДРОЛИЗА СУЛЬФИДА АЛЮМИНИЯ Al₂S₃ ↙ ↘ Al(OH)₃↓ H₂S↑ слабое основание слабая кислота [OH]⁻ = [H]⁺
- 19. Al₂S₃ + 6 H₂O = 2Al(OH)₃↓ + 3H₂S↑ NaCl + H₂O = NaOH + HCl ГИДРОЛИЗ
- 20. Преобразование земной коры Обеспечение слабощелочной среды морской воды РОЛЬ ГИДРОЛИЗА В ПРИРОДЕ РОЛЬ ГИДРОЛИЗА В ЖИЗНИ
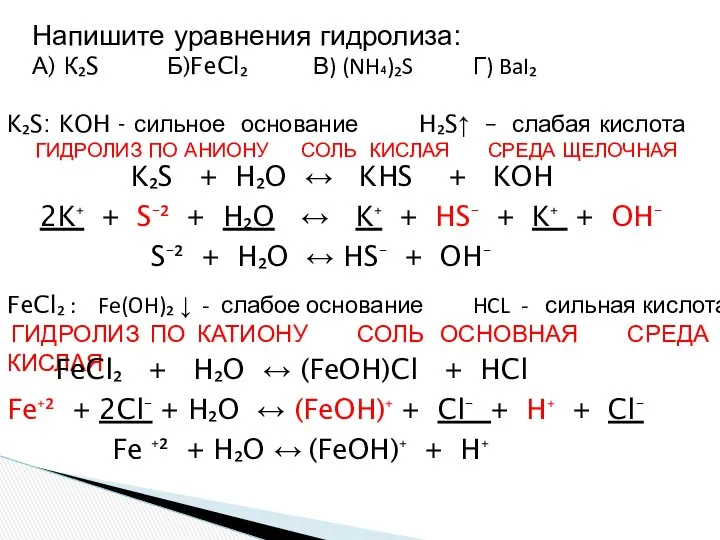
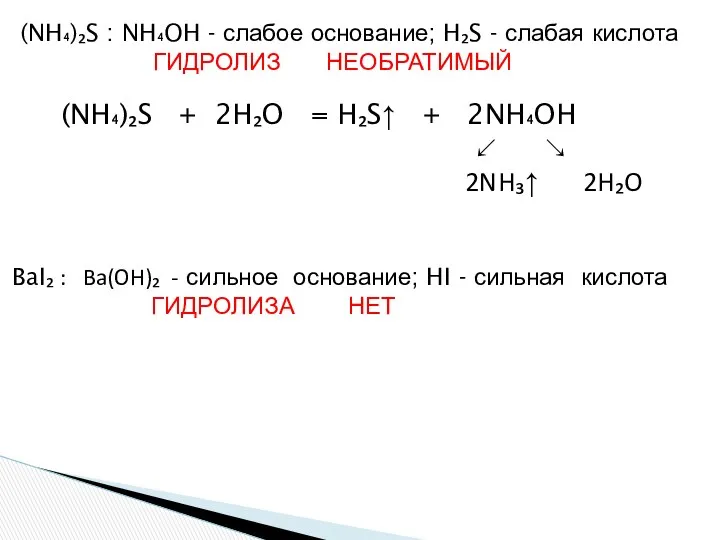
- 21. Напишите уравнения гидролиза: А) К₂S Б)FeCl₂ В) (NH₄)₂S Г) BaI₂ K₂S: KOH - сильное основание H₂S↑
- 22. (NH₄)₂S + 2H₂O = H₂S↑ + 2NH₄OH ↙ ↘ 2NH₃↑ 2H₂O (NH₄)₂S : NH₄OH - слабое
- 23. ОТВЕТ: 1 - Б 2 - Б
- 24. ОТВЕТ: 3 - А 4 - В 5 - Б 6 - Г
- 25. 7. Водный раствор какой из солей имеет нейтральную среду? а) Al(NO₃)₃ б) ZnCl₂ в) BaCl₂ г)
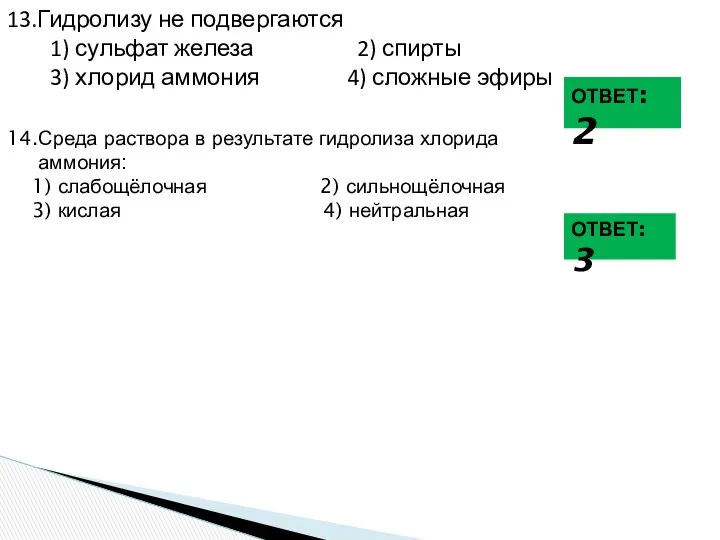
- 26. 9. Гидролизу не подвергаются 1) карбонат калия 2) этан 3) хлорид цинка 4) жир 10. При
- 27. 13.Гидролизу не подвергаются 1) сульфат железа 2) спирты 3) хлорид аммония 4) сложные эфиры ОТВЕТ: 2
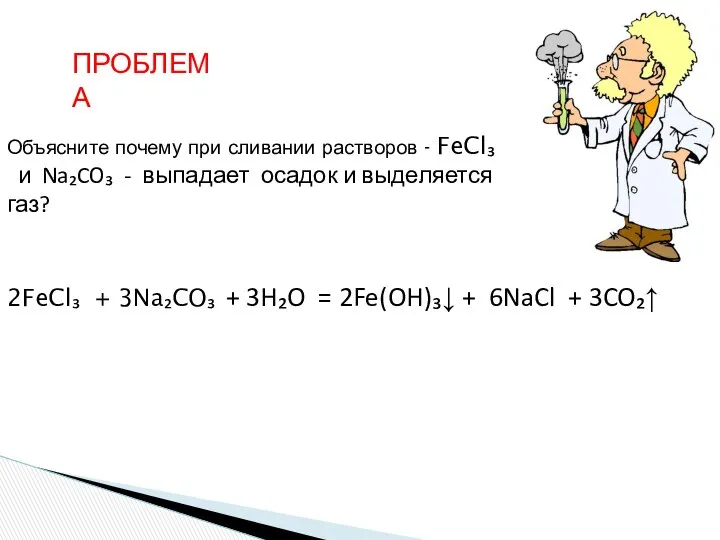
- 28. Объясните почему при сливании растворов - FeCl₃ и Na₂CO₃ - выпадает осадок и выделяется газ? ПРОБЛЕМА
- 30. Скачать презентацию
















 Реакции замещения и реакции обмена
Реакции замещения и реакции обмена Федотова Елена Анатольевна – учитель химии
Федотова Елена Анатольевна – учитель химии  Агрегирование ПАВ в воде и неполярных растворителях
Агрегирование ПАВ в воде и неполярных растворителях Карбонільні сполуки. Альдегіди і кетони
Карбонільні сполуки. Альдегіди і кетони Радиоактивные превращения . Закон радиоактивного распада.
Радиоактивные превращения . Закон радиоактивного распада. Материаловедение. Строение и основные свойства материалов
Материаловедение. Строение и основные свойства материалов Биохимия белковых гормонов
Биохимия белковых гормонов железо
железо Едкость Coca-Cola
Едкость Coca-Cola Классы неорганических веществ
Классы неорганических веществ Роль органической химии в жизни человека. Выполнила Чабан Выполнила ученица 10 «б» класса МОУ «СОШ р.п. Озинки» Чабан Мария
Роль органической химии в жизни человека. Выполнила Чабан Выполнила ученица 10 «б» класса МОУ «СОШ р.п. Озинки» Чабан Мария  Олимпиада по фармацевтической химии. Своя игра
Олимпиада по фармацевтической химии. Своя игра Периодический закон Д.И.Менделеева (1834-1907г.г.)
Периодический закон Д.И.Менделеева (1834-1907г.г.) Электрохимические методы анализа: потенциометрия. Потенциометрическое титрование
Электрохимические методы анализа: потенциометрия. Потенциометрическое титрование Тепловой эффект химических реакций 8 класс
Тепловой эффект химических реакций 8 класс Подгруппа азота
Подгруппа азота Энергетика химических реакций. Лекция 4
Энергетика химических реакций. Лекция 4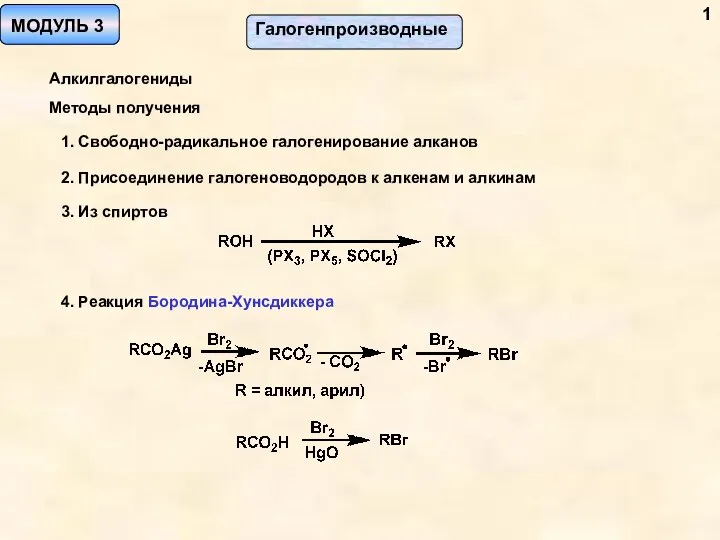 Галогенпроизводные. Алкилгалогениды. Методы получения. (Модуль 3)
Галогенпроизводные. Алкилгалогениды. Методы получения. (Модуль 3) Кристалічні та аморфні тіла. Рідкі кристали та їх властивості
Кристалічні та аморфні тіла. Рідкі кристали та їх властивості Требования к осадителю
Требования к осадителю Пищевые добавки Они повсюду…
Пищевые добавки Они повсюду…  Феромагнетики До феромагнетики (ferrum - залізо) належать речовини, магнітна сприйнятливість яких позитивна і досягає значень. Н
Феромагнетики До феромагнетики (ferrum - залізо) належать речовини, магнітна сприйнятливість яких позитивна і досягає значень. Н Занимательные опыты
Занимательные опыты Жизнь есть способ существования белковых тел
Жизнь есть способ существования белковых тел Каталитический крекинг
Каталитический крекинг Графен. Нобелевская премия 2016
Графен. Нобелевская премия 2016 Состав вещества
Состав вещества Металлическая связь. Агрегатные состояния вещества
Металлическая связь. Агрегатные состояния вещества