Содержание
- 2. Цель урока: Сформировать у учащихся понятие о степени окисления на основании знаний о видах химической связи.
- 3. Ход урока: Фронтальный опрос Выявление связи между понятиями «валентность» и «степень окисления»; Определение степени окисления элементов
- 4. Фронтальный опрос Что называется химической связью? Какие виды химических связей вы знаете? Какая связь называется ковалентной
- 5. Валентность Это способность атома образовывать определенное количество простых связей с другими атомами; Водород Н – 1s
- 6. Электроотрицательность Это способность атомов притягивать к себе валентные электроны соседних атомов H Cl ЭО(H)=2,20; ЭО(Cl)=3,16 H+-Cl-
- 7. Степень окисления Это условный заряд атома в молекуле или кристалле при условии, что все связи имеют
- 8. Виды степени окисления Положительная – равна числу отданных электронов данным атомом Отрицательная – равна числу принятых
- 9. Правила определения степени окисления атома В простом веществе степень окисления атома равна нулю Н20, СI20, F20,
- 10. Правила определения степени окисления атома Водород в большинстве соединений имеет степень окисления «+1», кроме соединений с
- 11. Правила определения степени окисления атома Кислород в большинстве случаев имеет степень окисления «-2» (исключением являются: H2+1O2-1,
- 12. Правила определения степени окисления атома Сумма степеней окисления всех элементов в молекуле с учетом индексов равна
- 13. Правила определения степени окисления атома Степень окисления F во всех соединениях равна «-1» Na+1 F-1, H+1
- 14. Правила определения степени окисления атома Степень окисления металлов главных подгрупп I, II, III групп во всех
- 15. 7. Неметаллы в соединениях имеют положительную и отрицательную степень окисления. Её максимальное значение равно номеру группы,
- 16. Алгоритм определения степени окисления Сначала расставляют известные степени окисления (правила 1,2,3,5,6) Затем по правилу х определяют
- 17. Определите степени окисления: Na2S Na3N NaBr MgCl2 MgS Mg3N2 Al2S3 Al2O3 NH3 SO3 SO2 H2S Fe2O3
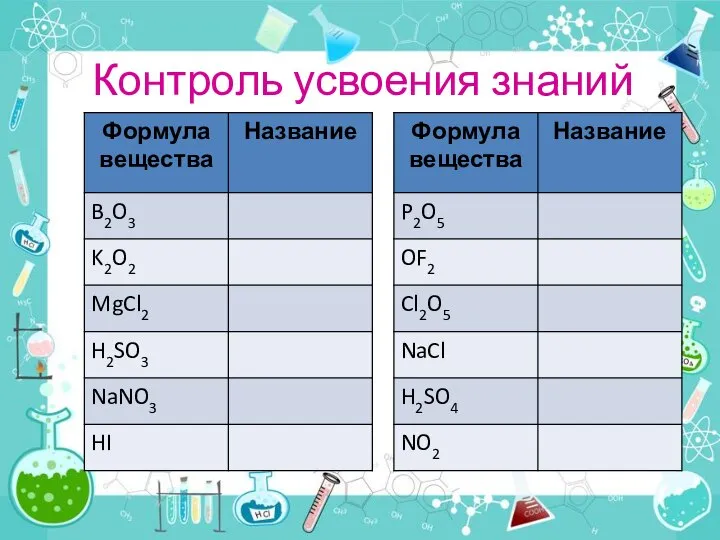
- 18. Контроль усвоения знаний
- 19. Контроль знаний
- 20. Поставьте себе отметку 0 ошибок – «5» 1 ошибка – «4» 2-3 ошибки – «3» 4-6
- 22. Скачать презентацию


















 Строение атома Подготовка к ЕГЭ
Строение атома Подготовка к ЕГЭ Презентация по Химии "Презентация Щелочные металлы" - скачать смотреть
Презентация по Химии "Презентация Щелочные металлы" - скачать смотреть  Фосфор – тіршілік пен ақыл – ой элементі
Фосфор – тіршілік пен ақыл – ой элементі Тема урока:„Строение атома” Учитель химии МБОУ СОШ №20 г.Королева Московской области Баранова Ирина Александровна
Тема урока:„Строение атома” Учитель химии МБОУ СОШ №20 г.Королева Московской области Баранова Ирина Александровна  Изготовление индикаторной бумаги
Изготовление индикаторной бумаги Тепло- и массообменные процессы при синтезе Фишера-Тропша
Тепло- и массообменные процессы при синтезе Фишера-Тропша Домашняя аптечка исследовательская работа Авторы: Полынникова Анастасия, Савина Мария учащиеся 9 «Б» класса Руководитель: Ма
Домашняя аптечка исследовательская работа Авторы: Полынникова Анастасия, Савина Мария учащиеся 9 «Б» класса Руководитель: Ма Атыраудағы химиялық өндіріс кәсіп орындары
Атыраудағы химиялық өндіріс кәсіп орындары Лужні метали Властивості, будова, застосування.
Лужні метали Властивості, будова, застосування.  Научные основы управления свойствами композиционных пленок для электролюминесцентных устройств
Научные основы управления свойствами композиционных пленок для электролюминесцентных устройств Карбоновые кислоты. Модели молекул
Карбоновые кислоты. Модели молекул Развитие учебной мотивации на уроках химии через систему урочной и внеурочной деятельности
Развитие учебной мотивации на уроках химии через систему урочной и внеурочной деятельности Фосге́н (дихлорангидрид угольной кислоты)
Фосге́н (дихлорангидрид угольной кислоты) Розв’язування розрахункових хімічних задач. Методичні рекомендації для вчителів хімії та школярів
Розв’язування розрахункових хімічних задач. Методичні рекомендації для вчителів хімії та школярів Аммиак. Образование молекулы аммиака
Аммиак. Образование молекулы аммиака Алканы
Алканы Урок-упражнение по веществам
Урок-упражнение по веществам Фенол 10 класс - Презентация по Химии
Фенол 10 класс - Презентация по Химии Все технико-экономические показатели производства определяются на основе материального баланса.
Все технико-экономические показатели производства определяются на основе материального баланса. Кристаллдық және аморфтық күй
Кристаллдық және аморфтық күй Резеңке. Каучук
Резеңке. Каучук Презентация по химии выполнили ученицы 8а класса Соболева Екатерина Кудаева Кристина Учитель Полянская И.В.
Презентация по химии выполнили ученицы 8а класса Соболева Екатерина Кудаева Кристина Учитель Полянская И.В.  Графен. Классические и квантовые низкоразмерные системы. Ковалентная химическая связь: σ- и π-электроны
Графен. Классические и квантовые низкоразмерные системы. Ковалентная химическая связь: σ- и π-электроны Приборы для измерения температуры
Приборы для измерения температуры Нуклеопротеиды. Структура и функция нуклеиновых кислот. (Лекция 4)
Нуклеопротеиды. Структура и функция нуклеиновых кислот. (Лекция 4) Электрохимические анализаторы медицинского назначения
Электрохимические анализаторы медицинского назначения Фосфорное сырье. Применение и обогащение фосфорного сырья
Фосфорное сырье. Применение и обогащение фосфорного сырья Особенности строения, реакционной способности и методы синтеза гидроксилсодержащих соединений
Особенности строения, реакционной способности и методы синтеза гидроксилсодержащих соединений