Содержание
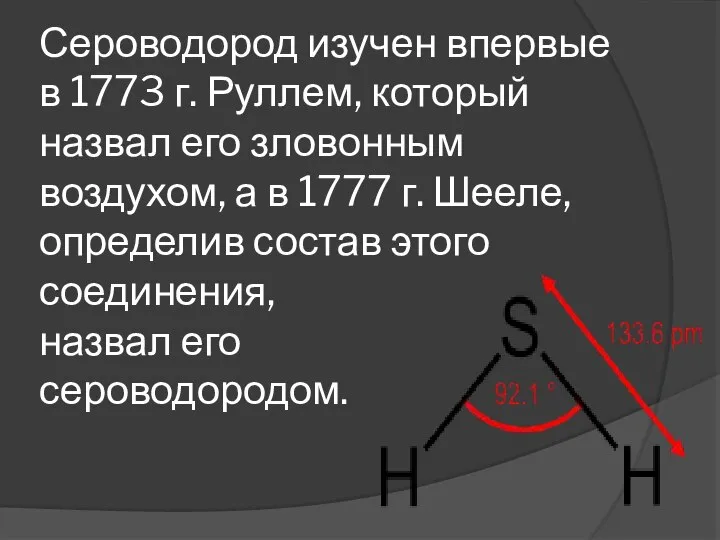
- 2. Сероводород изучен впервые в 1773 г. Руллем, который назвал его зловонным воздухом, а в 1777 г.
- 3. Нахождение в природе
- 4. ПОЛУЧЕНИЕ СЕРОВОДОРОДА СИНТЕТИЧЕСКИМ СПОСОБОМ S + Н2 = Н2S + Q
- 5. Получение сероводорода действием какой-либо кислоты на сульфид железа FeS +2НСl = Н2S +FeCl2
- 6. ПОЛУЧЕНИЕ СЕРОВОДОРОДА ГИДРОЛИЗОМ СУЛЬФИДОВ ИЛИ ДЕЙСТВИЕМ РАЗБАВЛЕННЫХ КИСЛОТ НА СУЛЬФИДЫ ЩЕЛОЧНЫХ И ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ Al2S3 +
- 7. Физические свойства В обычных условиях сероводород представляет собой бесцветный газ с характерным неприятным запахом тухлых яиц.
- 8. Сероводород — сильный восстановитель. S 2- - 2e --> S S 2- - 6e --> S
- 9. Горение сероводорода. 2H2S + O2= 2H2O + 2S 2H2S + 3O2=2Н2О+2SO2
- 10. Окисление сероводорода сернистым газом. SO2+2Н2S = 2Н2O + 3S
- 11. Восстановление сероводородом серной кислоты Н2SO4+Н2S = SO2 + 2Н2O + S
- 13. Скачать презентацию









 Многоатомные спирты
Многоатомные спирты Энергетика химических реакций
Энергетика химических реакций Резиновая краска
Резиновая краска Перемешивание в жидких средах
Перемешивание в жидких средах «Уксусная кислота»
«Уксусная кислота»  Інтенсивні технології вирощування дрібнокісточкових культур
Інтенсивні технології вирощування дрібнокісточкових культур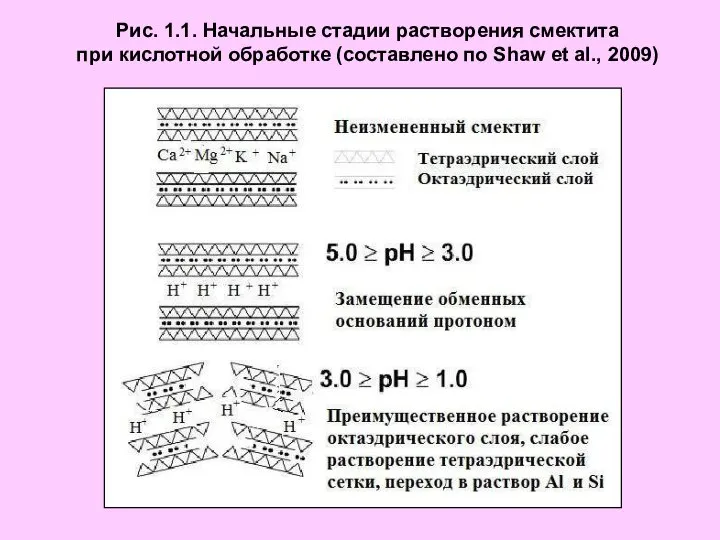 Начальные стадии растворения смектита при кислотной обработке
Начальные стадии растворения смектита при кислотной обработке Пифарнин (ribavirin)
Пифарнин (ribavirin) Динамический характер адсорбции. Лекция 2
Динамический характер адсорбции. Лекция 2 Физические и фазовые состояния полимеров
Физические и фазовые состояния полимеров Минеральные вещества
Минеральные вещества Вода: фізичні та хімічні властивості. Поширеність в природі
Вода: фізичні та хімічні властивості. Поширеність в природі Использование кислот природой и человеком
Использование кислот природой и человеком Электролиз. Задание № 20
Электролиз. Задание № 20 Магний. Электронное строение атома Mg
Магний. Электронное строение атома Mg Количество вещества
Количество вещества Газохимия. Абсорбционно-газофракционирующая установка. (Лекция 5.2)
Газохимия. Абсорбционно-газофракционирующая установка. (Лекция 5.2) Химическая кинетика. Лекция 2
Химическая кинетика. Лекция 2 Генетическая связь
Генетическая связь Группа рассеянных химических элементов
Группа рассеянных химических элементов Влияние условий хранения на качество лекарственных средств
Влияние условий хранения на качество лекарственных средств Презентация Биологическое действие радиации
Презентация Биологическое действие радиации  Органическая химия. Лекция. Стероиды
Органическая химия. Лекция. Стероиды Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Задача №9. Глицерин. Команда «Карбораны»
Задача №9. Глицерин. Команда «Карбораны» Нерівноважна термодинаміка та хімічна кінетика. Лекція 1
Нерівноважна термодинаміка та хімічна кінетика. Лекція 1 Физиология и биохимия бактерий. Дыхание и размножение микробов. Питание
Физиология и биохимия бактерий. Дыхание и размножение микробов. Питание Обзор основных методов исследования супрамолекулярных объектов
Обзор основных методов исследования супрамолекулярных объектов