Содержание
- 2. Химическая связь – это связь между химическими частицами (атомами, молекулами, ионами), объединяющая их в более сложные
- 3. Причины образования химической связи: Причины образования химической связи: 1. Неустойчивость атомов с незавершѐнным внешним уровнем и
- 4. 3. В свободном атоме электроны притягиваются только к ядру собственного атома. 4. Когда два атома приближаются
- 5. 5. Силы отталкивания уравновешиваются силами притяжения и атомы удерживаются вместе. Так возникает химическая связь.
- 6. Способность атомов данного элемента оттягивать на себя электроны от атомов других элементов в соединениях, называется электроотрицательностью
- 7. Различают четыре типа химических связей: Ионная связь. Ковалентная связь. Металлическая связь. Водородная связь.
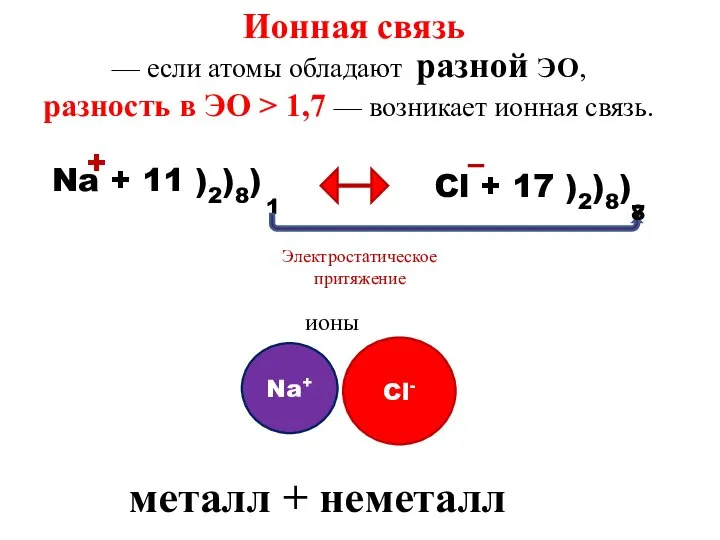
- 8. Ионная связь — если атомы обладают разной ЭО, разность в ЭО > 1,7 — возникает ионная
- 9. Ионная- это связь, которая образуется между ионами металла и неметалла за счет принятия и отдачи электронов.
- 10. Свойства ионной связи ненаправленная, так как электромагнитное поле распространяется во все стороны ненасыщаемая, притянется столько ионов,
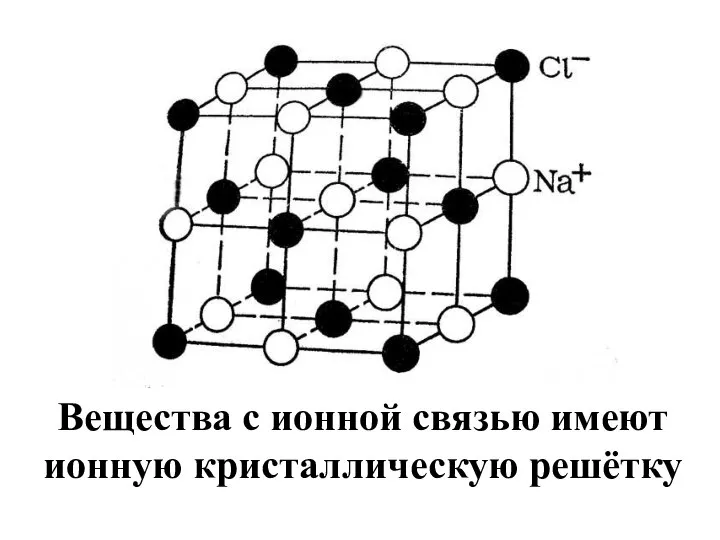
- 11. Вещества с ионной связью имеют ионную кристаллическую решётку
- 12. Свойства веществ с ионной связью Притяжение между ионами достаточно сильное, поэтому ионные вещества имеют высокие температуры
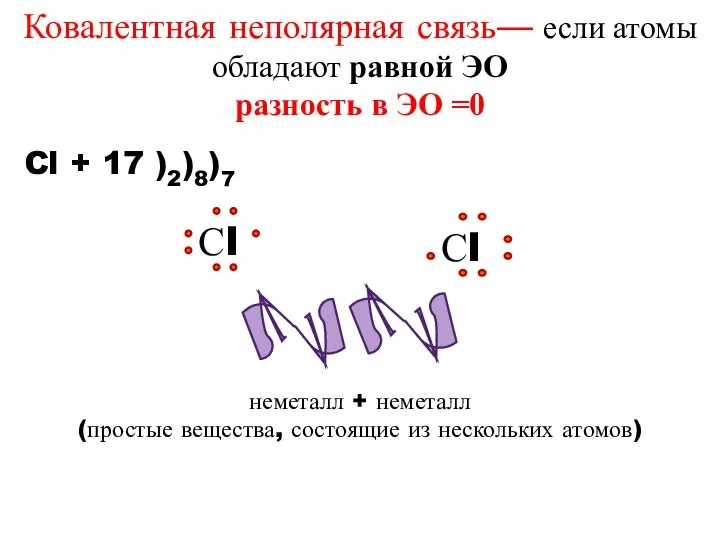
- 13. неметалл + неметалл (простые вещества, состоящие из нескольких атомов) Cl + 17 )2)8)7 Ковалентная неполярная связь—
- 14. N N Ковалентная связь может быть образована несколькими парами электронов Количество связей у атома равно количеству
- 15. Химическая связь, образованная посредством общих электронных пар, называется ковалентной.
- 16. В случае когда общая электронная пара в одинаковой степени притягивается к ядрам взаимодействующих атомов, ковалентную связь
- 17. неметалл + неметалл Cl + 17 )2)8)7 Ковалентная полярная связь— если атомы обладают разной ЭО, но
- 18. В случае когда общая электронная пара смещена в сторону одного из атомов, ковалентную связь называют полярной.
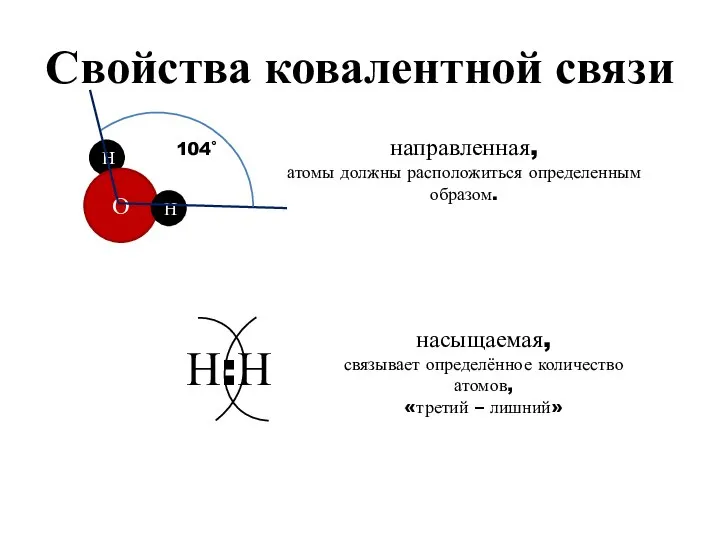
- 19. Свойства ковалентной связи направленная, атомы должны расположиться определенным образом. насыщаемая, связывает определённое количество атомов, «третий –
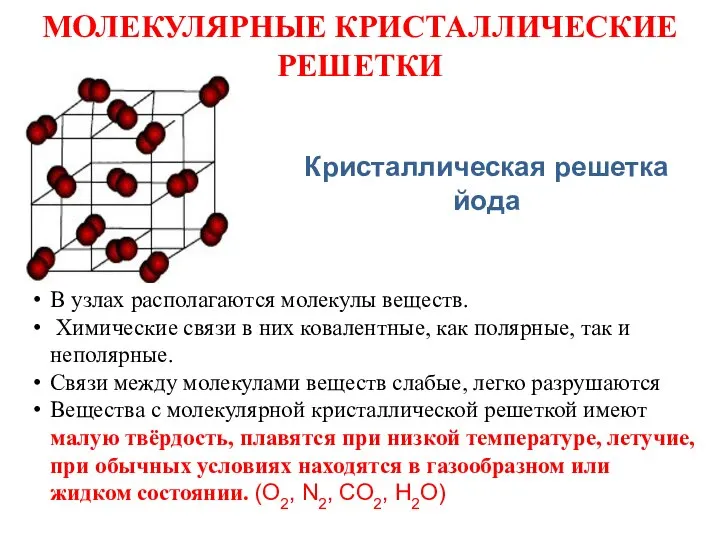
- 20. МОЛЕКУЛЯРНЫЕ КРИСТАЛЛИЧЕСКИЕ РЕШЕТКИ В узлах располагаются молекулы веществ. Химические связи в них ковалентные, как полярные, так
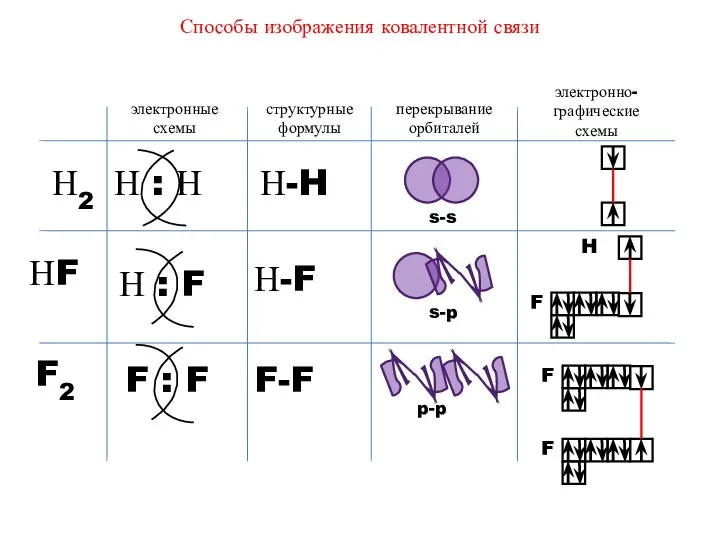
- 21. Способы изображения ковалентной связи электронные схемы структурные формулы перекрывание орбиталей электронно-графические схемы Н2 НF F2 Н-F
- 22. Как определить вид связи в веществе? Определите природу химических элементов если только неметаллы металл и неметалл
- 24. Скачать презентацию















 Золото. Свойство золота
Золото. Свойство золота Д. И. Менделеев человек - загадка Автор: Ким Н. В. учитель химии 2008 год.
Д. И. Менделеев человек - загадка Автор: Ким Н. В. учитель химии 2008 год.  Сутегі. Оттегі. Сутекті алу және оның қасиеттерін зерттеу
Сутегі. Оттегі. Сутекті алу және оның қасиеттерін зерттеу Полярография және оның фармацияда қолданылуы
Полярография және оның фармацияда қолданылуы Нуклеиновые кислоты
Нуклеиновые кислоты Наука химия
Наука химия Тема:Хімія
Тема:Хімія  Электролитическая диссоциация
Электролитическая диссоциация Кадмий (Cadmium)
Кадмий (Cadmium) Мұнай құрамындағы тұздың мөлшерін анықтау
Мұнай құрамындағы тұздың мөлшерін анықтау Введение в органическую химию
Введение в органическую химию Химические составляющие человеческого организма
Химические составляющие человеческого организма Основы химической термодинамики
Основы химической термодинамики Метаморфические горные породы
Метаморфические горные породы Масс-спектры спиртов и фенолов
Масс-спектры спиртов и фенолов Комплексные соединения
Комплексные соединения Процессы соосаждения. Радионуклид без носителя. Индикаторные количества
Процессы соосаждения. Радионуклид без носителя. Индикаторные количества Арены. Бензол
Арены. Бензол Химическое равновесие и его смещение
Химическое равновесие и его смещение Минералы свинца
Минералы свинца Количественный анализ. Гравиметрия
Количественный анализ. Гравиметрия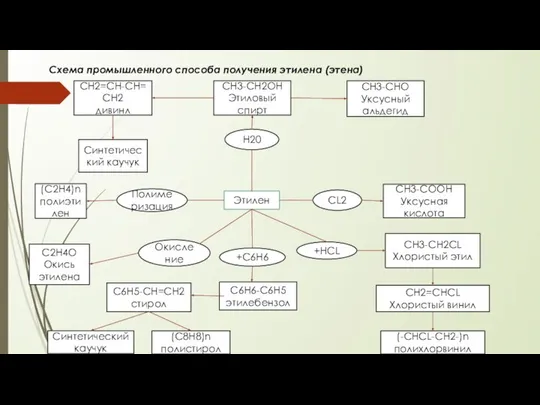 Промышленній способ получения этилена (этена)
Промышленній способ получения этилена (этена) Презентация по Химии "Вода" - скачать смотреть
Презентация по Химии "Вода" - скачать смотреть  Расчеты по уравнениям химической реакции
Расчеты по уравнениям химической реакции Темір және оның қосылыстары
Темір және оның қосылыстары Металлы
Металлы Электролитическая диссоциация. (Лекция 14)
Электролитическая диссоциация. (Лекция 14) Золото
Золото