Содержание
- 2. Электролиты и неэлектролиты Соли Кислоты Щелочи Простые вещества-неметаллы Органические водорастворимые вещества (кроме кислот, аминов, солей)
- 3. Две теории растворов «Растворы – химические соединения, определяе-мые силами, действующи-ми между растворителем и растворенным веществом» Д.И.Менделеев
- 4. Две теории растворов С.Аррениус «Электролиты в растворах состоят частично из диссоциированных молекул, число которых растет при
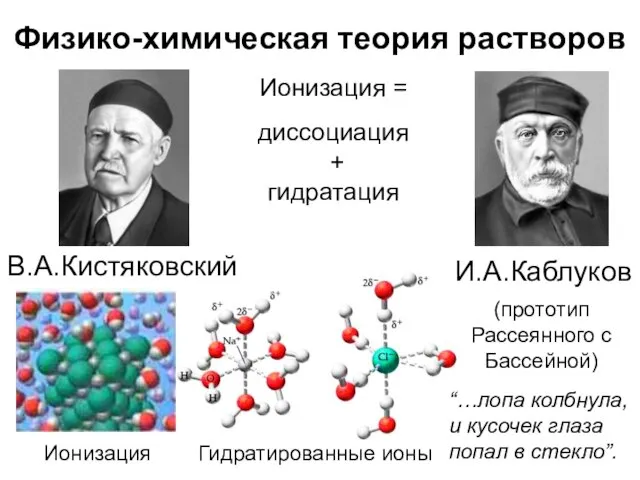
- 5. Физико-химическая теория растворов И.А.Каблуков Ионизация = диссоциация + гидратация Гидратированные ионы (прототип Рассеянного с Бассейной) В.А.Кистяковский
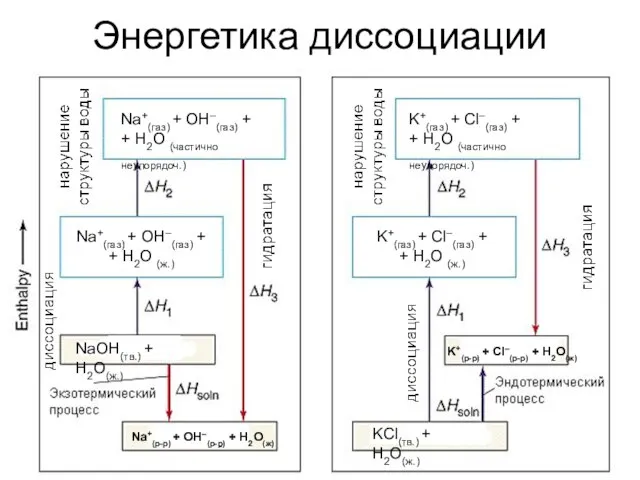
- 6. Энергетика диссоциации Na+(газ) + OH–(газ) + + H2O (частично неупорядоч.) NaOH(тв.) + H2O(ж.) Na+(р-р) + OH–(р-р)
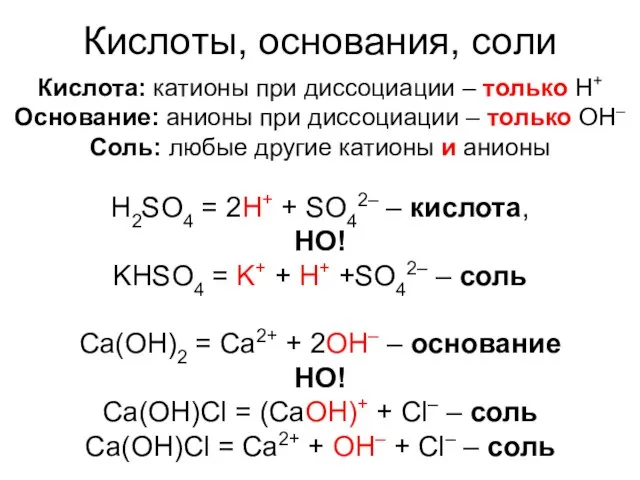
- 7. Кислоты, основания, соли Кислота: катионы при диссоциации – только H+ Основание: анионы при диссоциации – только
- 8. Амфотерные гидроксиды X(OH)n [X(OH)n-1]+ +OH– [XO(OH)n-1]– +H+ Диссоциация по основному типу Диссоциация по кислотному типу От
- 9. Сильные электролиты Диссоциируют полностью или почти полностью
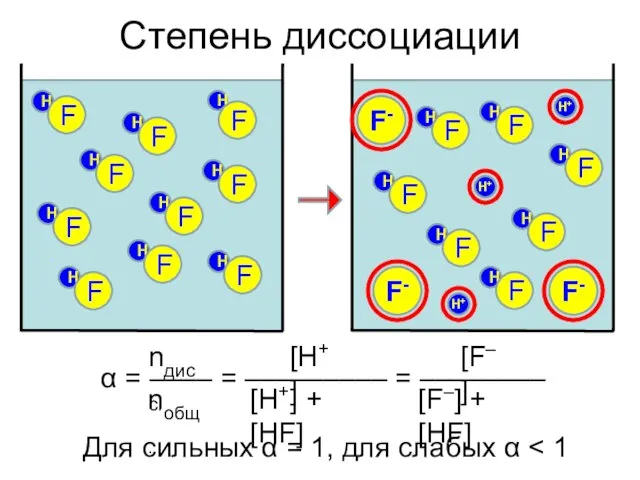
- 10. Степень диссоциации H+ F- H F H F H F H F H F H F
- 11. От чего зависит α? Природа растворителя (полярность и др.) – Н2О > C2H5OH > (C2H5)O >
- 12. Закон разбавления Оствальда К.В.Оствальд Только для очень разбавленных растворов слабых электролитов! α ~ 1/√CKtAn С →
- 13. Константа диссоциации HAn ⇄ H+ + An– – константа диссоциации Для многоосновных кислот – ступенчатая диссоциация
- 14. Вывод закона разбавления HAn ⇄ H+ + An– С0 СHAn 0 0 ΔC –x x x
- 16. Скачать презентацию



![Амфотерные гидроксиды X(OH)n [X(OH)n-1]+ +OH– [XO(OH)n-1]– +H+ Диссоциация по основному типу](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/573857/slide-7.jpg)





 Презентация Химическая связь
Презентация Химическая связь 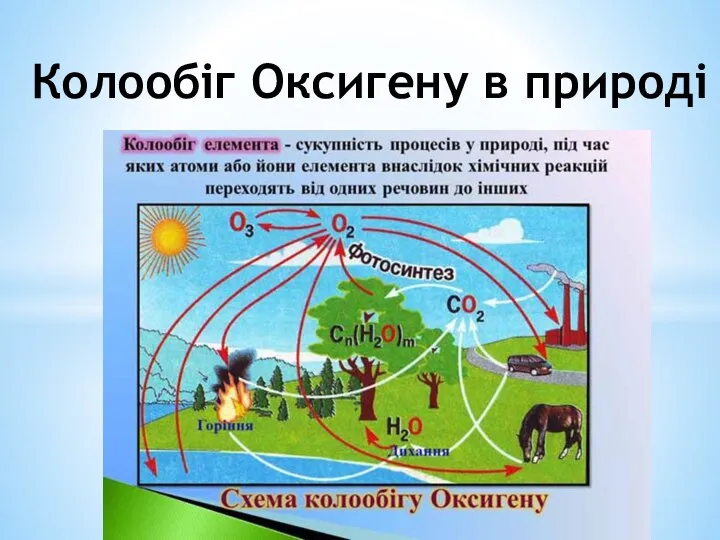 Колообіг Оксигену в природі
Колообіг Оксигену в природі  Химия и физика полимеров. Курс лекций
Химия и физика полимеров. Курс лекций Металлические элементы группы IA. ЛИТИЙ. Работу выполнила: Ученица 11 класса Иванова Ксения
Металлические элементы группы IA. ЛИТИЙ. Работу выполнила: Ученица 11 класса Иванова Ксения Коллекция учебных динамических слайдов по химии. (8 класс)
Коллекция учебных динамических слайдов по химии. (8 класс) Алканы: гомологический ряд, изомерия и номенклатура алканов. МБОУ СОШ №99 г.о. Самара Предмет: Химия Класс: 10 Учебник: О.С. Габр
Алканы: гомологический ряд, изомерия и номенклатура алканов. МБОУ СОШ №99 г.о. Самара Предмет: Химия Класс: 10 Учебник: О.С. Габр Карбоновые кислоты и их функциональные производные
Карбоновые кислоты и их функциональные производные Этиленгликоль. Физические свойства
Этиленгликоль. Физические свойства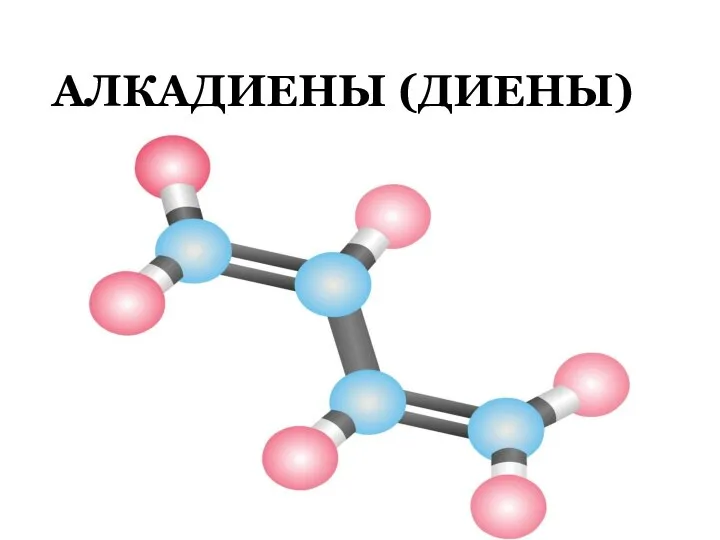 Алкадиены (диены)
Алкадиены (диены)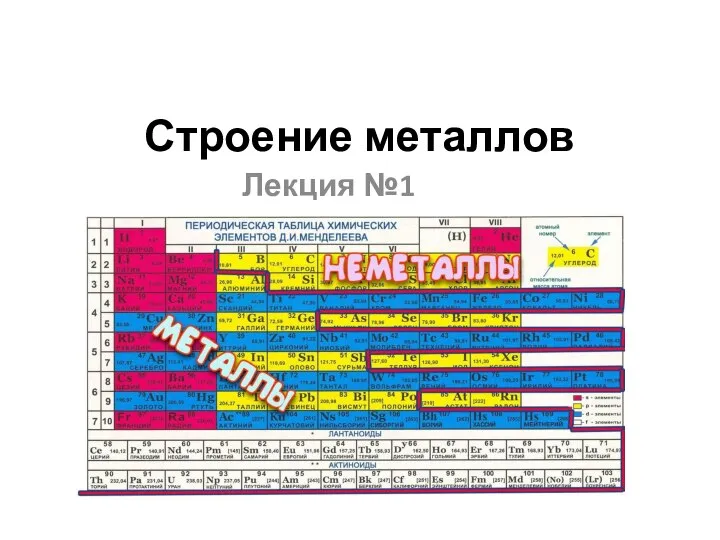 Строение металлов
Строение металлов Функциональные производные с простой связью C-“Э”. Часть 4 …окси-производные
Функциональные производные с простой связью C-“Э”. Часть 4 …окси-производные Презентация по Химии "КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ" - скачать смотреть бесплатно
Презентация по Химии "КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ" - скачать смотреть бесплатно Властивості газів
Властивості газів Автоматизация производства жидкой углекислоты
Автоматизация производства жидкой углекислоты Electrochemical processes
Electrochemical processes Горные породы Крыма
Горные породы Крыма Азот Составил: учитель химии МОУ «Средняя общеобразовательная школа №92 с углубленным изучением отдельных предметов» Бар
Азот Составил: учитель химии МОУ «Средняя общеобразовательная школа №92 с углубленным изучением отдельных предметов» Бар Металлическая связь
Металлическая связь Алюминий
Алюминий Использование ЭОР при подготовке к ЕГЭ и ГИА
Использование ЭОР при подготовке к ЕГЭ и ГИА Гидролиз. Лекция 03-2
Гидролиз. Лекция 03-2 Несовместимые сочетания лекарственных веществ. Способы преодоления несовместимости
Несовместимые сочетания лекарственных веществ. Способы преодоления несовместимости Полимеры
Полимеры Полимеры. Каучуки. Резина
Полимеры. Каучуки. Резина Счастливы вместе с химией
Счастливы вместе с химией Вода. Физические и химические свойства
Вода. Физические и химические свойства ПЕРВОНАЧАЛЬНЫЕ ХИМИЧЕСКИЕ ПОНЯТИЯ ОБОБЩАЮЩИЙ УРОК
ПЕРВОНАЧАЛЬНЫЕ ХИМИЧЕСКИЕ ПОНЯТИЯ ОБОБЩАЮЩИЙ УРОК  Презентация по Химии "Значение химии" - скачать смотреть бесплатно
Презентация по Химии "Значение химии" - скачать смотреть бесплатно