Содержание
- 2. Сванте Аррениус В 1887 г. Шведский ученый С.Арениус для объясннеия особенностей водных растворов веществ предложил теорию
- 3. СОВРЕМЕННОЕ СОДЕРЖАНИЕ ТЭД МОЖНО СВЕСТИ К ЧЕТЫРЕМ ОСНОВНЫМ ПОЛОЖЕНИЯМ. 1-ОЕ ПОЛОЖЕНИЕ Все вещества по их способности
- 4. ВЕЩЕСТВА В РАСТВОРАХ ↓ Электролиты (водные растворы проводят электрический ток) Неэлектролиты (водные растворы не проводят электрический
- 5. ЗАДАНИЯ К 1-МУ ПОЛОЖЕНИЮ ТЭД Какие вещества называются электролитами и неэлектролитами Назовите по два вещества, которые
- 6. В РАСТВОРАХ ЭЛЕКТРОЛИТЫ ДИССОЦИИРУЮТ (РАСПАДАЮТСЯ) НА ПОЛОЖИТЕЛЬНО И ОТРИЦАТЕЛЬНО ЗАРЯЖЕННЫЕ ИОНЫ Процесс распада электролита на ионы
- 7. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ КАТИОН Ионная связь Анион - Молекула воды Al2(SO4)3 → 2Al3+ + 3SO42− CuSO4 →
- 8. HNO3 → H+ + NO3− H2SO4 → 2H+ + SO42− ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
- 9. МЕХАНИЗМ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ ВЕЩЕСТВА КОВАЛЕНТНОЙ СВЯЗЬЮ: ОРИЕНТАЦИЯ ДИПОЛЕЙ ВОДЫ → ГИДРАТАЦИЯ → ИОНИЗАЦИЯ → ДИССОЦИАЦИЯ ВЕЩЕСТВА
- 10. 1) ПО ЗАРЯДУ: КАТИОНЫ (ПОЛОЖИТЕЛЬНО ЗАРЯЖЕНЫ) И АНИОНЫ (ОТРИЦАТЕЛЬНО ЗАРЯЖЕНЫ) 2) ПО ОТНОШЕНИЮ К ВОДЕ: ГИДРАТИРОВАННЫЕ
- 11. УПРОЩЕННО ПРОЦЕСС ДИССОЦИАЦИИ ИЗОБРАЖАЮТ С ПОМОЩЬЮ УРАВНЕНИЙ: NACL → NA+ + CL− HCL → H+ +
- 13. Скачать презентацию










 Сутегі. Оттегі. Сутекті алу және оның қасиеттерін зерттеу
Сутегі. Оттегі. Сутекті алу және оның қасиеттерін зерттеу «Жизнь есть способ существования белковых тел…» (Ф.Энгельс) Выполнила преподаватель химии: Шилькиева И.А. г. Астрахань
«Жизнь есть способ существования белковых тел…» (Ф.Энгельс) Выполнила преподаватель химии: Шилькиева И.А. г. Астрахань  Массообменные процессы
Массообменные процессы Взаимосвязь обмена веществ
Взаимосвязь обмена веществ Производные изоникотиновой кислоты: изониазид
Производные изоникотиновой кислоты: изониазид Повторение 8 класса. Основные понятия химии
Повторение 8 класса. Основные понятия химии Підготувала учениця 11-А класу Білецька Олеся
Підготувала учениця 11-А класу Білецька Олеся  Silicates
Silicates Минералы и их свойства
Минералы и их свойства Кислород как элемент
Кислород как элемент Презентация по Химии "Класифікація хімічних речовин" - скачать смотреть бесплатно
Презентация по Химии "Класифікація хімічних речовин" - скачать смотреть бесплатно Характерные дефекты в монокристаллах кремния и их влияние на свойства. Методы диагностики
Характерные дефекты в монокристаллах кремния и их влияние на свойства. Методы диагностики Химическая связь
Химическая связь Характеристика органических соединений
Характеристика органических соединений Решение 33 задания
Решение 33 задания Колообіг карбону у природі. Виконали: учениці 10-А класу Кирлейза Софія Мустіпан Вікторія
Колообіг карбону у природі. Виконали: учениці 10-А класу Кирлейза Софія Мустіпан Вікторія  Кислотность и основностьорганических соединений
Кислотность и основностьорганических соединений Непредельные углеводороды АЛКЕНЫ Алферова Мария Владимировна учитель химии ГБОУ лицей №486 Выборгского района г. Санкт-Петербу
Непредельные углеводороды АЛКЕНЫ Алферова Мария Владимировна учитель химии ГБОУ лицей №486 Выборгского района г. Санкт-Петербу Классификация минералов по химическому принципу
Классификация минералов по химическому принципу Минералы. Классы минералов
Минералы. Классы минералов Фосфонсірке қышқылының антипирендік қасиеттерін зерттеу
Фосфонсірке қышқылының антипирендік қасиеттерін зерттеу Алюминий и его сплавы
Алюминий и его сплавы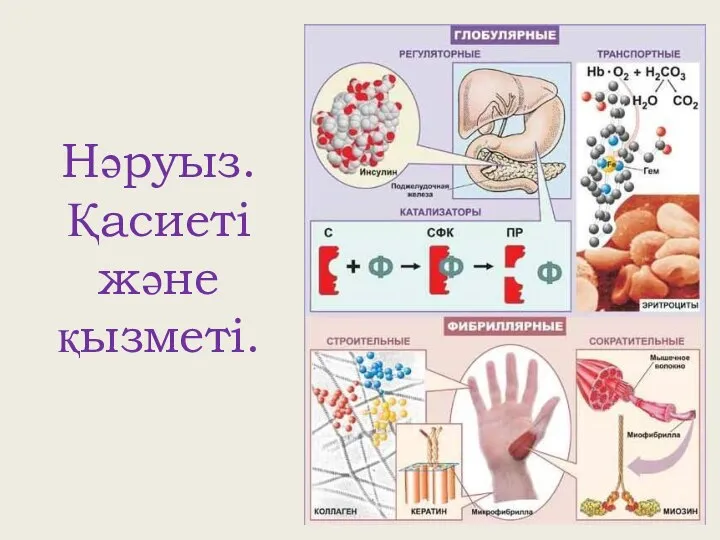 Нәруыз. Қасиеті және қызметі
Нәруыз. Қасиеті және қызметі Алюміній
Алюміній  Волокно капрон
Волокно капрон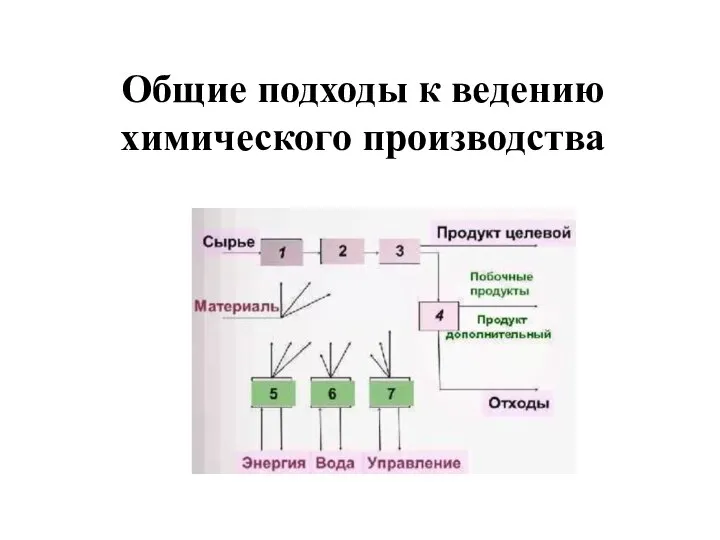 Общие подходы к ведению химического производства
Общие подходы к ведению химического производства Век медный, бронзовый, железный Тужилкина Полина 9 Б класс МОУ «СОШ №92»
Век медный, бронзовый, железный Тужилкина Полина 9 Б класс МОУ «СОШ №92» Парниковий ефект
Парниковий ефект