Содержание
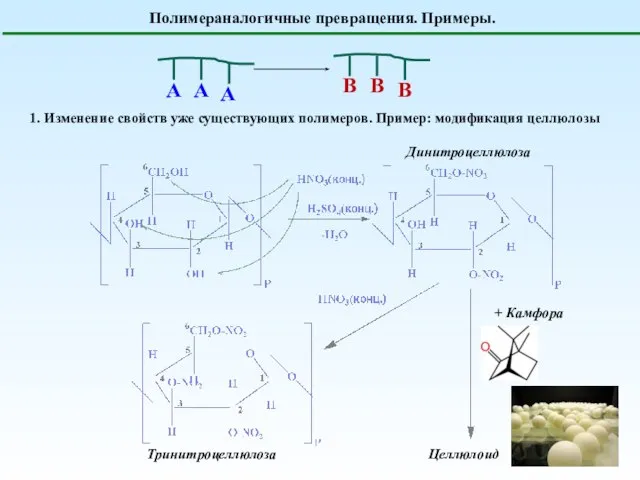
- 2. Полимераналогичные превращения. Примеры. 1. Изменение свойств уже существующих полимеров. Пример: модификация целлюлозы Динитроцеллюлоза Тринитроцеллюлоза + Камфора
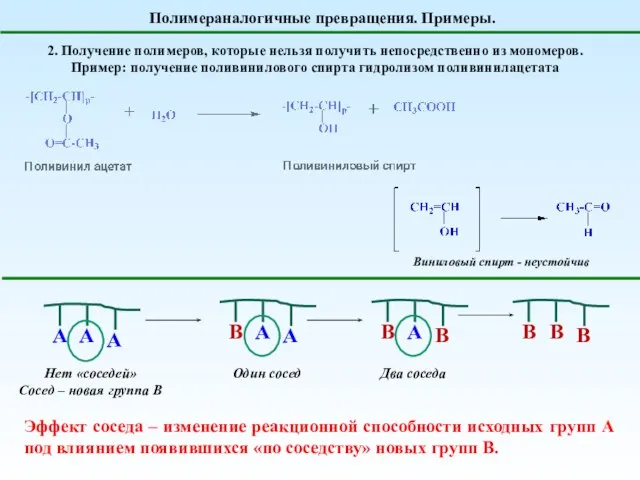
- 3. Полимераналогичные превращения. Примеры. 2. Получение полимеров, которые нельзя получить непосредственно из мономеров. Пример: получение поливинилового спирта
- 4. Полимераналогичные превращения. Эффект соседа. Полимераналогичную реакцию можно считать псевдомономолекулярной, так как концентрация второго компонента (например, воды
- 5. Полимераналогичные превращения. Эффект соседа. ln[A] t «Эффект соседа» отсутствует Замедляющий «эффект соседа» Ускоряющий «эффект соседа» 2.
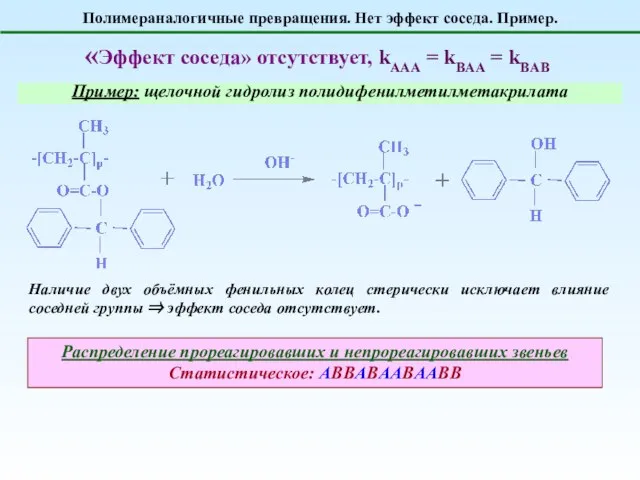
- 6. Полимераналогичные превращения. Нет эффект соседа. Пример. «Эффект соседа» отсутствует, kAAA = kBAA = kBAB Пример: щелочной
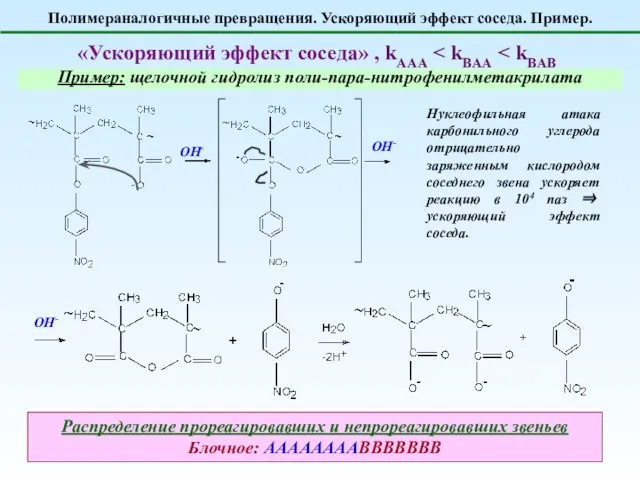
- 7. Полимераналогичные превращения. Ускоряющий эффект соседа. Пример. «Ускоряющий эффект соседа» , kAAA Пример: щелочной гидролиз поли-пара-нитрофенилметакрилата Нуклеофильная
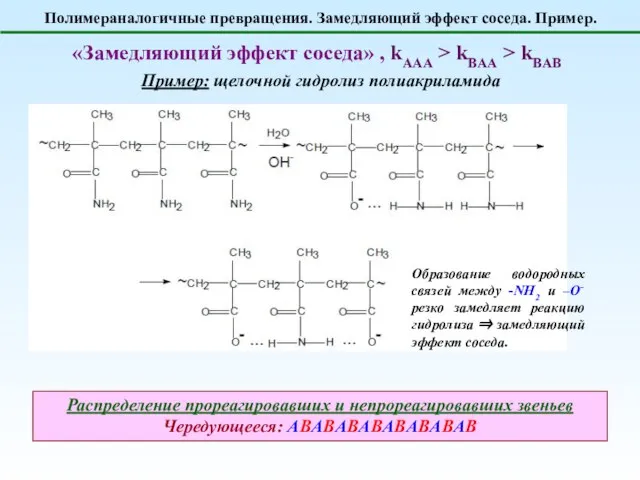
- 8. Полимераналогичные превращения. Замедляющий эффект соседа. Пример. «Замедляющий эффект соседа» , kAAA > kBAA > kBAB Пример:
- 9. Полимераналогичные превращения. Другие полимерные эффекты На скорость полимераналогичных превращений могут оказывать другие полимерные эффекты: Конформационный эффект
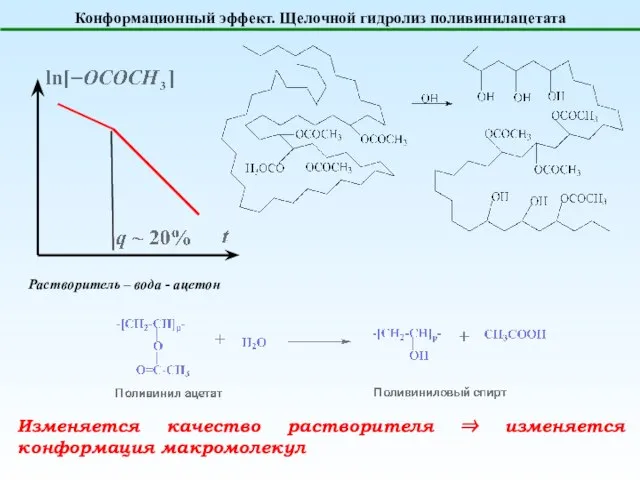
- 10. Конформационный эффект. Щелочной гидролиз поливинилацетата Растворитель – вода - ацетон Изменяется качество растворителя ⇒ изменяется конформация
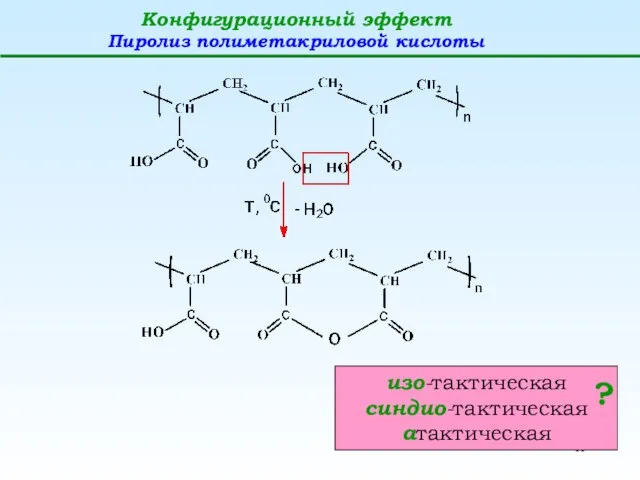
- 11. Конфигурационный эффект Пиролиз полиметакриловой кислоты изо-тактическая синдио-тактическая атактическая ?
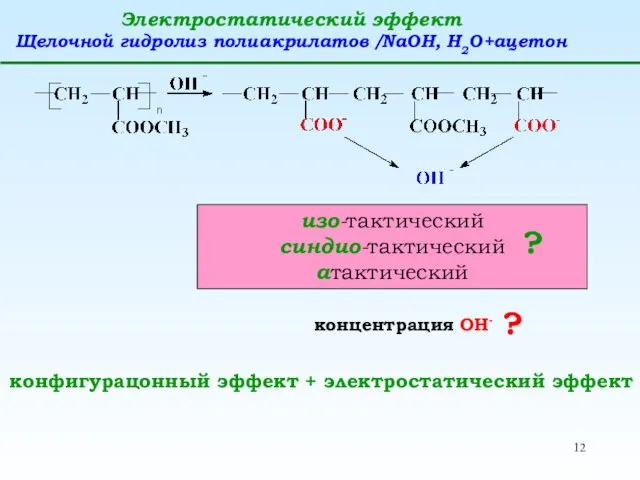
- 12. Электростатический эффект Щелочной гидролиз полиакрилатов /NaOH, H2O+ацетон изо-тактический синдио-тактический атактический ? концентрация ОН- ? конфигурацонный эффект
- 13. Надмолекулярный эффект Окисление полипропилена Скорость уменьшается при предварительной ориентации полимера Хлорирование полиэтилена в твердой фазе Скорость
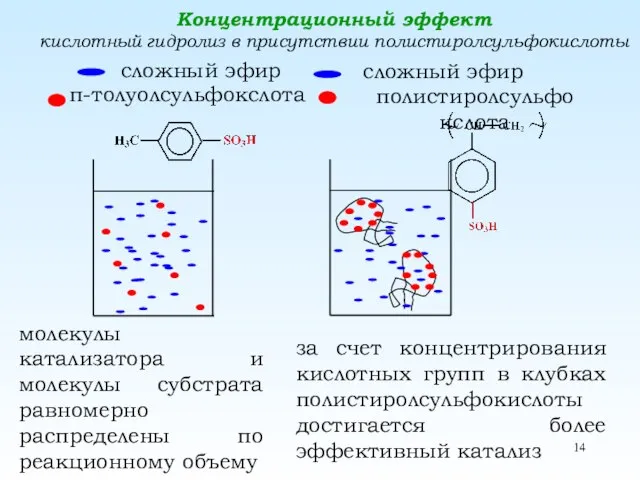
- 14. Концентрационный эффект кислотный гидролиз в присутствии полистиролсульфокислоты сложный эфир п-толуолсульфокслота сложный эфир полистиролсульфокслота молекулы катализатора и
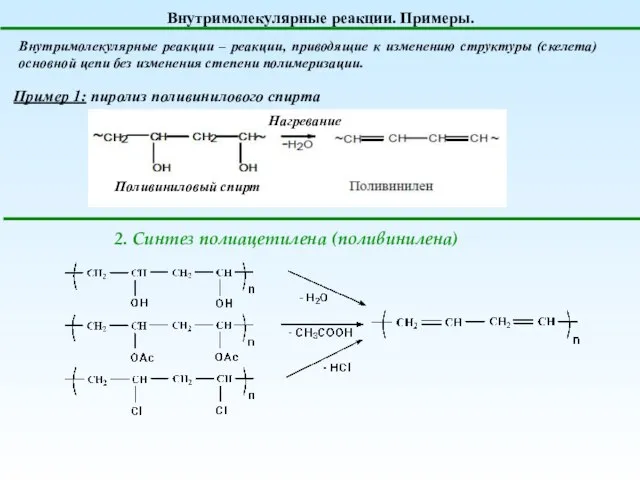
- 15. Внутримолекулярные реакции. Примеры. Внутримолекулярные реакции – реакции, приводящие к изменению структуры (скелета) основной цепи без изменения
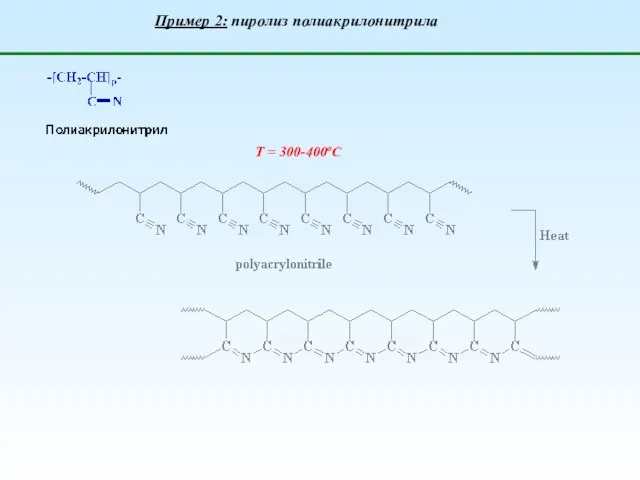
- 16. Т = 300-400оС Пример 2: пиролиз полиакрилонитрила
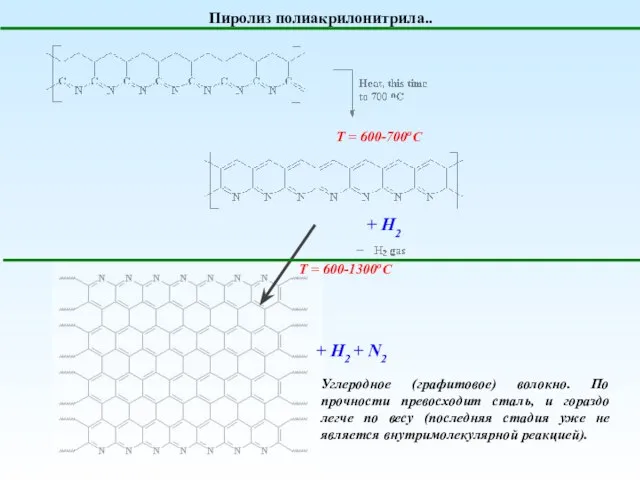
- 17. Пиролиз полиакрилонитрила.. Т = 600-700оС + H2 Т = 600-1300оС + H2 + N2 Углеродное (графитовое)
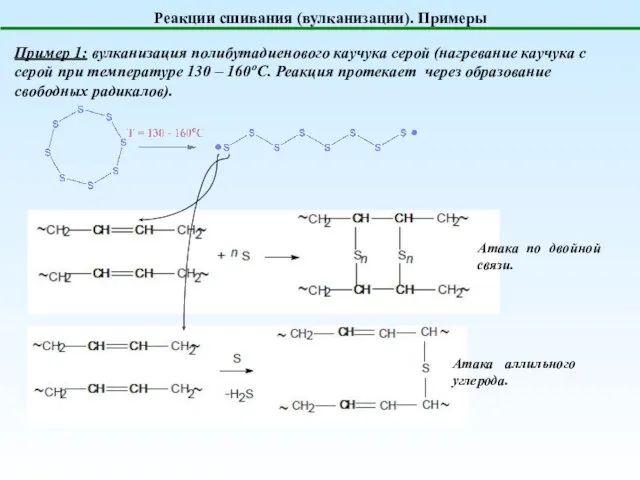
- 18. Реакции сшивания (вулканизации). Примеры Пример 1: вулканизация полибутадиенового каучука серой (нагревание каучука с серой при температуре
- 19. Реакции сшивания (вулканизации). Примеры Пример 2: Вулканизация полиэтилена – получение сшитого полиэтиленового каучука. 1. Получение частично
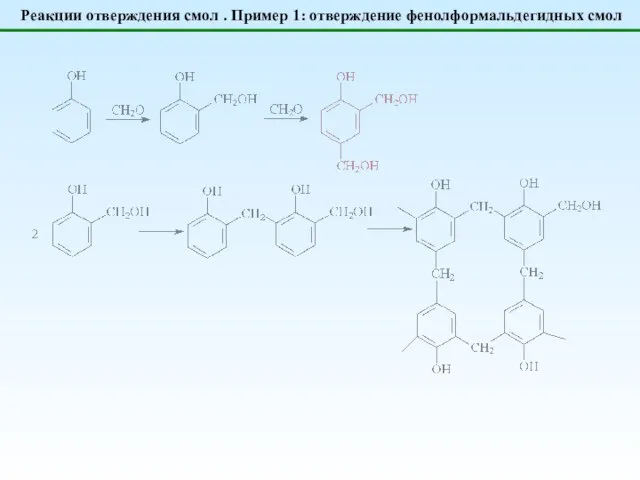
- 20. Реакции отверждения смол . Пример 1: отверждение фенолформальдегидных смол
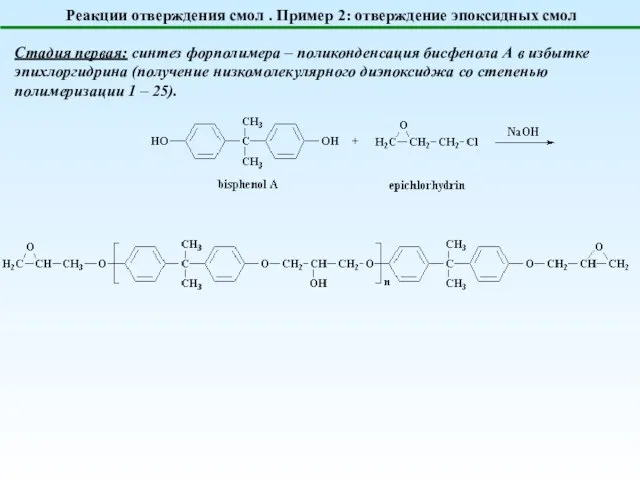
- 21. Реакции отверждения смол . Пример 2: отверждение эпоксидных смол Стадия первая: синтез форполимера – поликонденсация бисфенола
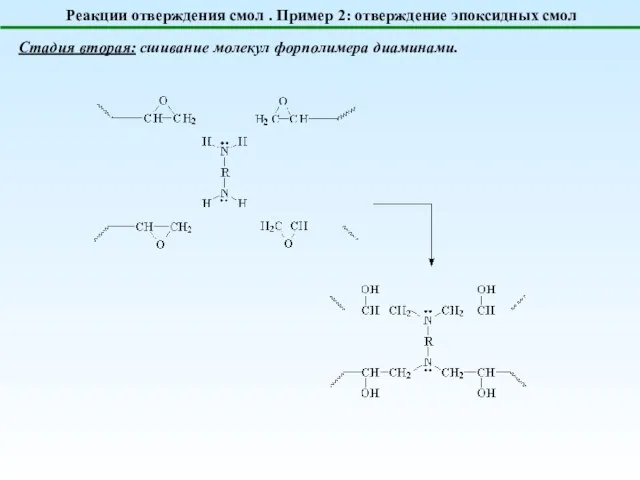
- 22. Реакции отверждения смол . Пример 2: отверждение эпоксидных смол Стадия вторая: сшивание молекул форполимера диаминами.
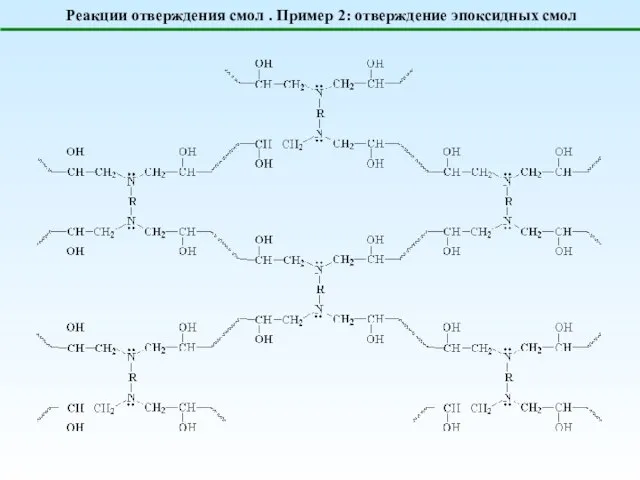
- 23. Реакции отверждения смол . Пример 2: отверждение эпоксидных смол
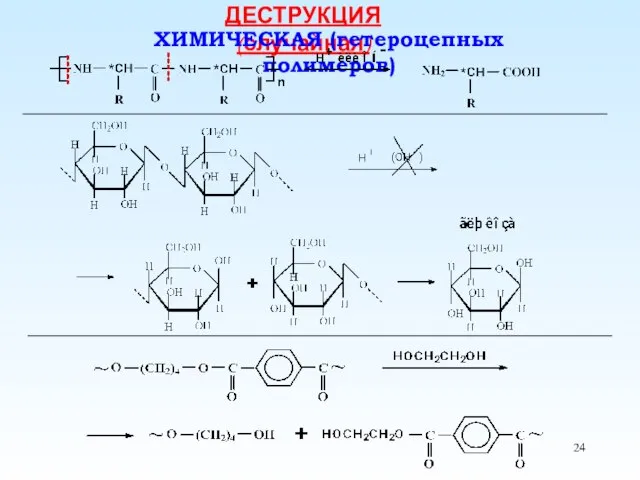
- 24. ДЕСТРУКЦИЯ (случайная) ХИМИЧЕСКАЯ (гетероцепных полимеров)
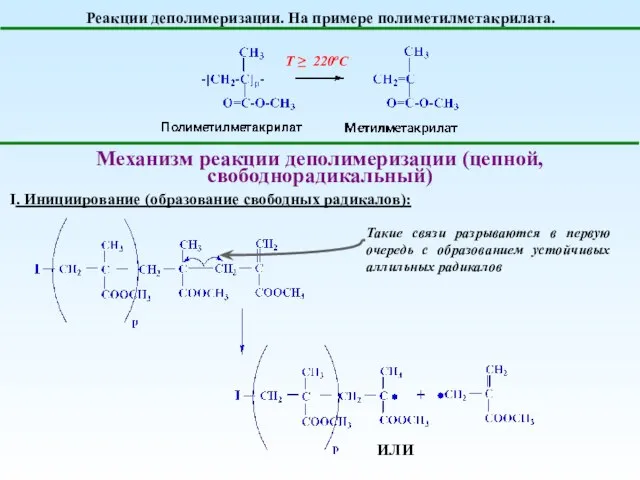
- 25. Реакции деполимеризации. На примере полиметилметакрилата. Т ≥ 220оС Механизм реакции деполимеризации (цепной, свободнорадикальный) I. Инициирование (образование
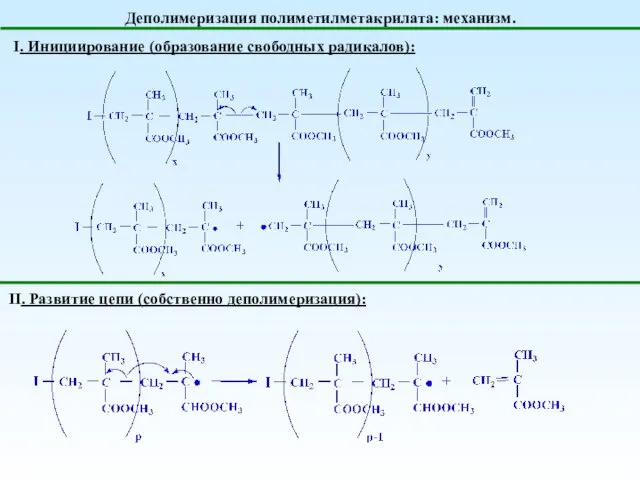
- 26. Деполимеризация полиметилметакрилата: механизм. I. Инициирование (образование свободных радикалов): II. Развитие цепи (собственно деполимеризация):
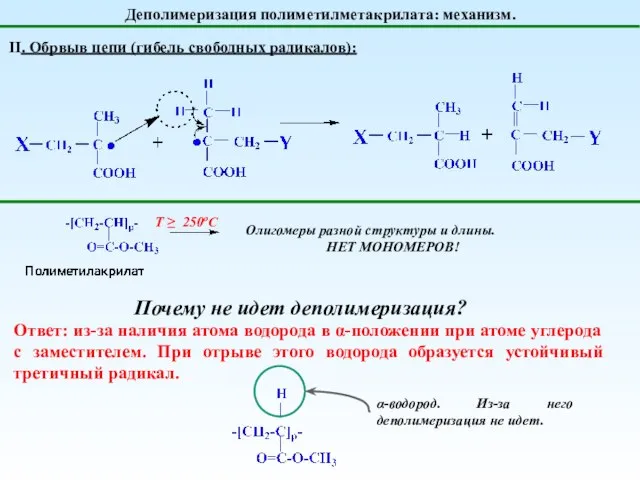
- 27. Деполимеризация полиметилметакрилата: механизм. II. Обрвыв цепи (гибель свободных радикалов): Т ≥ 250оС Олигомеры разной структуры и
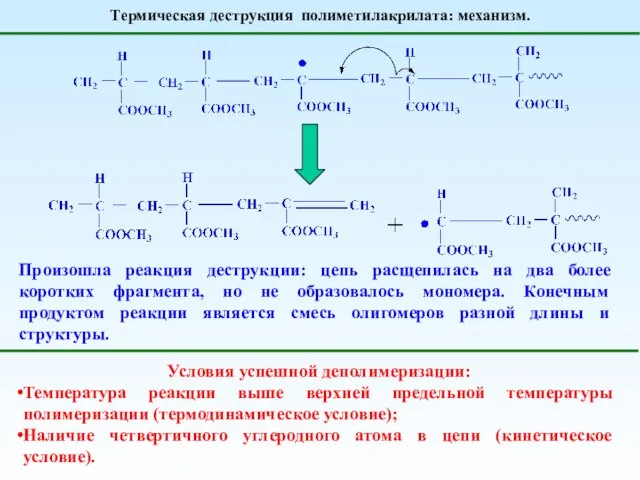
- 28. Термическая деструкция полиметилакрилата: механизм. Реакция деполимеризации протекает Но конкурирующая реакция передачи цепи на полимер протекает МНОГО
- 29. Термическая деструкция полиметилакрилата: механизм. Произошла реакция деструкции: цепь расщепилась на два более коротких фрагмента, но не
- 30. Термолиз различных полимеров и выход мономера -[CH2-CH2]p- -[CF2-CF2]p-
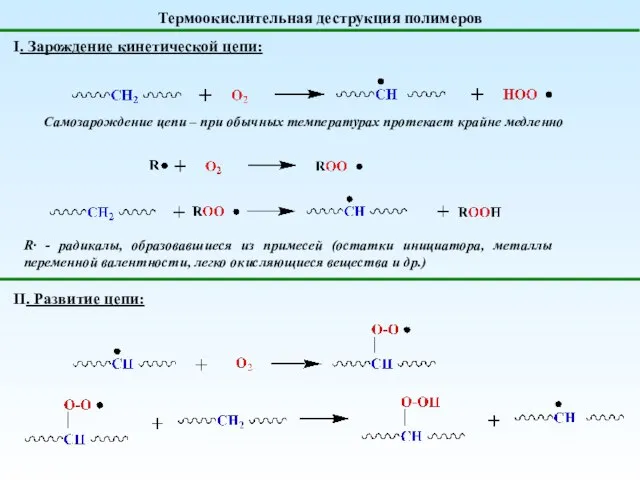
- 31. Термоокислительная деструкция полимеров Самозарождение цепи – при обычных температурах протекает крайне медленно I. Зарождение кинетической цепи:
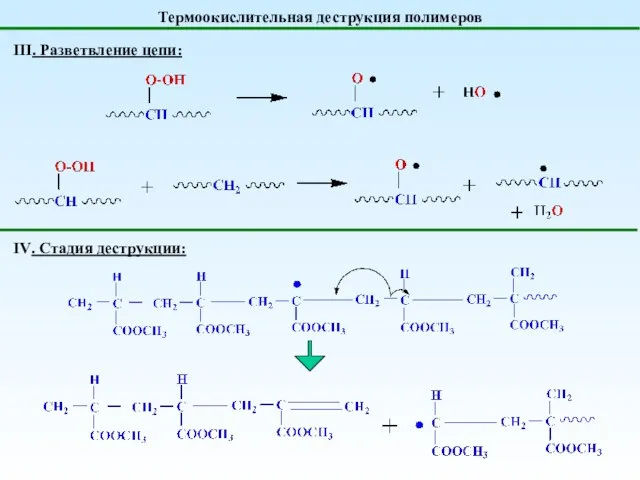
- 32. Термоокислительная деструкция полимеров III. Разветвление цепи: IV. Стадия деструкции:
- 33. Термоокислительная деструкция полимеров Образование свободных радикалов в полимере может происходить не только под действием теплоты, но
- 35. Скачать презентацию

![Полимераналогичные превращения. Эффект соседа. ln[A] t «Эффект соседа» отсутствует Замедляющий «эффект](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/529155/slide-4.jpg)




![Термолиз различных полимеров и выход мономера -[CH2-CH2]p- -[CF2-CF2]p-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/529155/slide-29.jpg)

 Конструкционные функциональные волокнистые композиты
Конструкционные функциональные волокнистые композиты Металлы и сплавы. История цивилизаций
Металлы и сплавы. История цивилизаций Многоатомные спирты. Фенол.
Многоатомные спирты. Фенол. Из чего оно сделано молоко
Из чего оно сделано молоко Алканы. Состав, строение, свойства и химические превращения. Экологические последствия. Синтезы генетическая связь
Алканы. Состав, строение, свойства и химические превращения. Экологические последствия. Синтезы генетическая связь Проблемы и меры по защите окружающей среды ПМР
Проблемы и меры по защите окружающей среды ПМР Различия в молекулярном строении газов, жидкостей и твердых тел
Различия в молекулярном строении газов, жидкостей и твердых тел Презентация по химии Введение в биоорганическую химию
Презентация по химии Введение в биоорганическую химию  160198375
160198375 Методы контроля и анализа веществ
Методы контроля и анализа веществ Чистые вещества и смеси
Чистые вещества и смеси Приборы для измерения температуры
Приборы для измерения температуры Химические реакции. Реакции по фазовому составу
Химические реакции. Реакции по фазовому составу Викторина. Дмитрий Иванович Менделеев
Викторина. Дмитрий Иванович Менделеев Viscoelasticity
Viscoelasticity Фолиевая кислота
Фолиевая кислота  Менделєєв Дмитро Іванович Роботу виконав: Учень 11 - Б класу Вдовіченко І. Вчитель інформатики: Трибко О.Б.
Менделєєв Дмитро Іванович Роботу виконав: Учень 11 - Б класу Вдовіченко І. Вчитель інформатики: Трибко О.Б.  Щелочноземельные металлы
Щелочноземельные металлы Воронежская область п.г.т. Анна, МОУ Аннинская средняя общеобразовательная школа №1 Выполнила: учитель химии высшей квалифика
Воронежская область п.г.т. Анна, МОУ Аннинская средняя общеобразовательная школа №1 Выполнила: учитель химии высшей квалифика Углеводы: простые и сложные. Строение, свойства и биологическая роль
Углеводы: простые и сложные. Строение, свойства и биологическая роль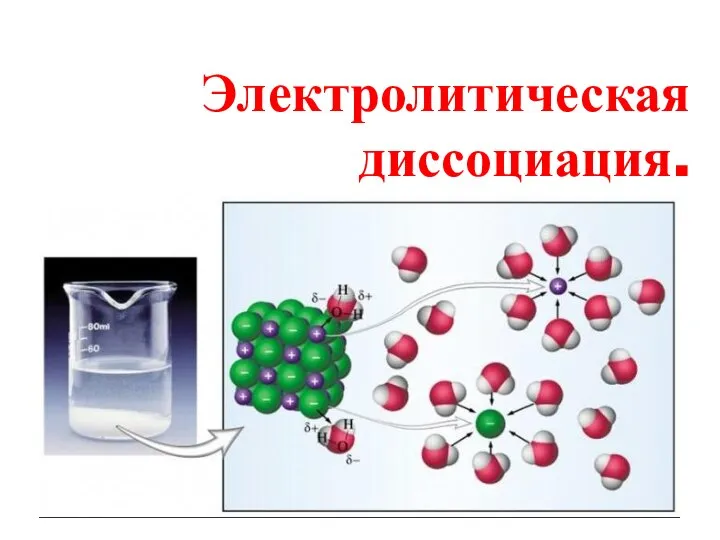 Электролитическая диссоциация
Электролитическая диссоциация Опал
Опал Презентация по Химии "Глюкоза - альдегідоспирт" - скачать смотреть бесплатно
Презентация по Химии "Глюкоза - альдегідоспирт" - скачать смотреть бесплатно Лекарственные растения и сырье, содержащие гликозиды. (Лекция 7)
Лекарственные растения и сырье, содержащие гликозиды. (Лекция 7) Защитные покрытия поверхности металла от коррозии
Защитные покрытия поверхности металла от коррозии Автомобильные бензины и дизельное топливо
Автомобильные бензины и дизельное топливо Адсорбционные равновесия и процессы на подвижных и неподвижных границах раздела
Адсорбционные равновесия и процессы на подвижных и неподвижных границах раздела Степень диссоциации. 9 класс
Степень диссоциации. 9 класс