Содержание
- 2. Гравиметрия (весовой анализ) Химический метод анализа, при котором определяемый компонент выделяют в виде малорастворимого соединения определенного
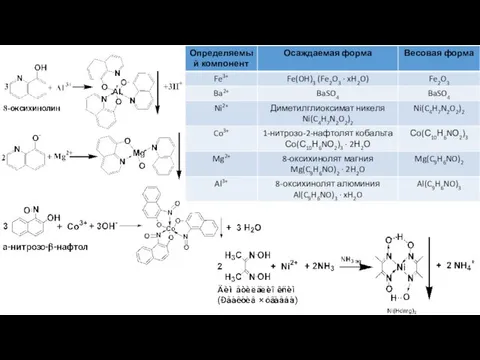
- 3. Требования к осаждаемой форме: Количественное осаждение (в пределах обнаружения) Строго селективное осаждение (отсутствие примесей) Легкость фильтрации
- 4. Требования к весовой форме: Химическая устойчивость Строго постоянный стехиометрический состав Малое значение гравиметрического фактора Гравиметрический фактор
- 5. Представление результатов (точность расчетов) Сложение, вычитание – по меньшему количеству цифр после запятой: 1 + 0,1
- 6. Представление результатов (точность расчетов) Сложный (многостадийный) расчет - ответ округляется в соответствии с точностью наименее точной
- 8. Титриметрия (объемный анализ) Химический метод анализа, при котором количество (массу, концентрацию etc) анализируемого вещества определяют по
- 9. Титриметрия (объемный анализ) Эквивалентная концентрация (нормальность) – условная концентрация активных частиц, эквивалентная концентрации вещества в растворе.
- 10. Титриметрия (объемный анализ) Аналит – вещество, концентрация которого неизвестна (определяемое) Титрант – вещество известной концентрации. Стандартизация
- 11. Титриметрия (объемный анализ) Требования к титриметрическим реакциям: Протекание строго количественное (в пределах обнаружения) Высокая скорость протекания
- 12. Классификация титриметрических реакций По химии процесса: Кислотно-основное титрование ацидиметрическое (титрант – кислота) алкалиметрическое (титрант – щелочь)
- 13. Классификация титриметрических реакций По способу фиксации конечной точки: Визуальная индикация (в присутствии специальных веществ, меняющих окраску
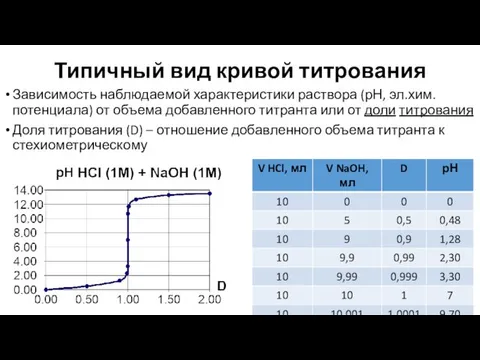
- 14. Типичный вид кривой титрования Зависимость наблюдаемой характеристики раствора (рН, эл.хим. потенциала) от объема добавленного титранта или
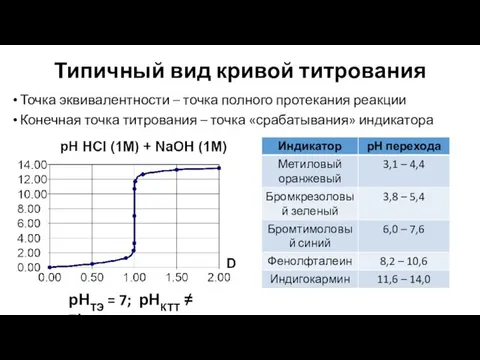
- 15. Типичный вид кривой титрования Точка эквивалентности – точка полного протекания реакции Конечная точка титрования – точка
- 16. Какой индикатор выбрать? CH3COOH (1M) + NaOH(титрант) = CH3COONa + H2O Кд(CH3COOH) = 1,8 ∙ 10-5
- 17. Установка для титрования Штатив Бюретка (наполняется титрантом, фиксирует его расход) Резиновая трубка Шарик (надавливанием на трубку
- 19. Скачать презентацию













 Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Микроцентрифуги для выделения ДНК в ПЦР
Микроцентрифуги для выделения ДНК в ПЦР Начала органической химии
Начала органической химии Презентация по Химии "Карбоновые кислоты 9 класс" - скачать смотреть
Презентация по Химии "Карбоновые кислоты 9 класс" - скачать смотреть  Презентация по Химии "Железо" - скачать смотреть
Презентация по Химии "Железо" - скачать смотреть  Обобщение по типам химических реакций
Обобщение по типам химических реакций Разработка водно-парафиновых эмульсий для антикоррозийной обработки металлов
Разработка водно-парафиновых эмульсий для антикоррозийной обработки металлов Сера и ее важнейшие соединения 16S 1s22s22p63s23p4 (р- элемент) S8 – ромбическая сера (наиболее устойчивая аллотропная модификация серы;
Сера и ее важнейшие соединения 16S 1s22s22p63s23p4 (р- элемент) S8 – ромбическая сера (наиболее устойчивая аллотропная модификация серы; Классификация органических соединений
Классификация органических соединений Разработка технологии получения наноструктурированных катализаторов для гидрирования
Разработка технологии получения наноструктурированных катализаторов для гидрирования Получение искусственного малахита из яичной скорлупы и изучение влияния температуры на скорость химической реакции
Получение искусственного малахита из яичной скорлупы и изучение влияния температуры на скорость химической реакции Температура и тепловое равновесие
Температура и тепловое равновесие «Созвездие талантов». Игра-зачет по теме «Основные классы неорганической химии» 8 класс
«Созвездие талантов». Игра-зачет по теме «Основные классы неорганической химии» 8 класс Основы химической термодинамики. Термохимические расчеты
Основы химической термодинамики. Термохимические расчеты Вода - Н2О
Вода - Н2О Ионная связь. Взаимная поляризация ионов
Ионная связь. Взаимная поляризация ионов Полифункциональные органические соединения
Полифункциональные органические соединения Сероводородная кислота
Сероводородная кислота Фізичні та хімічні властивості кислот (урок хімії у 8 класі)
Фізичні та хімічні властивості кислот (урок хімії у 8 класі) Внеклассное мероприятие по химии. Своя игра
Внеклассное мероприятие по химии. Своя игра Классы неорганических веществ
Классы неорганических веществ Предмет и задачи биохимии. Белки. (Лекция 1)
Предмет и задачи биохимии. Белки. (Лекция 1) Аминокислоты. Белки
Аминокислоты. Белки Пластмаси, синтетичні каучуки Підготували учениці 11-б класу Оренбургська Марина та Козаренко Таїсія
Пластмаси, синтетичні каучуки Підготували учениці 11-б класу Оренбургська Марина та Козаренко Таїсія  Презентация по Химии "Презентація на тему: Природний газ" - скачать смотреть бесплатно
Презентация по Химии "Презентація на тему: Природний газ" - скачать смотреть бесплатно Предалхимический период
Предалхимический период Презентация по Химии "Вперед к вершине Химического Олимпа" - скачать смотреть
Презентация по Химии "Вперед к вершине Химического Олимпа" - скачать смотреть  Домашняя работа на каникулы
Домашняя работа на каникулы