Содержание
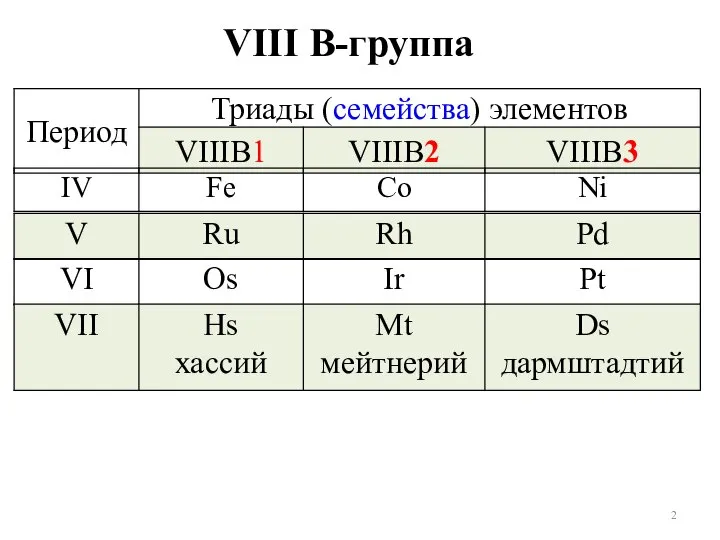
- 2. VIII B-группа
- 3. d-элементы Семейство железа Fe, Co, Ni (n–1)d6ns2 преобладает горизотальная периодичность
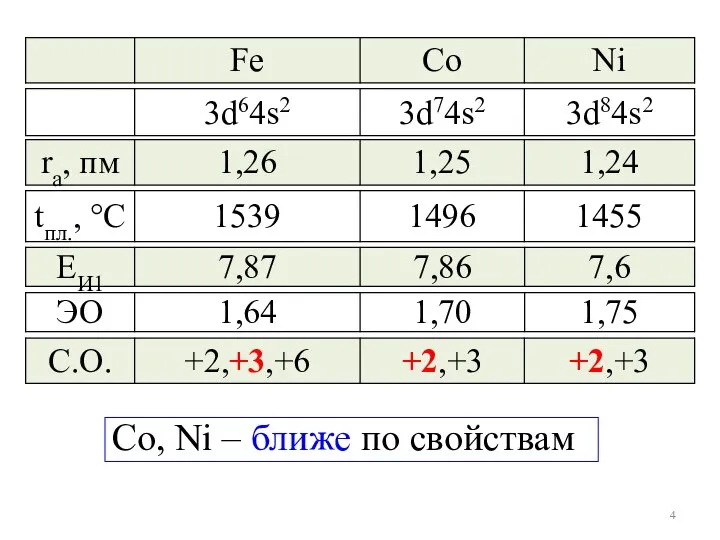
- 4. Со, Ni – ближе по свойствам
- 5. Fe Месопотамия 3000 лет до н.э. Египет 2500 лет до н.э. Название южно-славянское «зализо» или «лезо»
- 6. Co Древний Египет – кобальтовые краски – синие стекла название – Г.И. Гесс как металл –
- 7. Fe2O3 ⋅H2O – лимонит (бурый железняк) Fe2O3 – гематит (красный железняк) Fe3O4 – магнетит (магнитный железняк)
- 8. FeS2 – пирит («золото дураков») FeS, CoS, NiS – колчеданы CoAsS, NiAsS – блески Месторождения Ni
- 9. Получение FeO + C Fe + CO↑ Fe3O4 + CO FeO + CO2↑ 1 способ –
- 10. 3 способ – восстановление водородом 2 способ – бездоменный непосредственное восстановление Ме (Менделеев) отсутствуют жидкие фазы
- 11. Fe(СO)5 Fe + 5CO↑ 5 способ – электролиз 4 способ – термическое разложение карбонилов
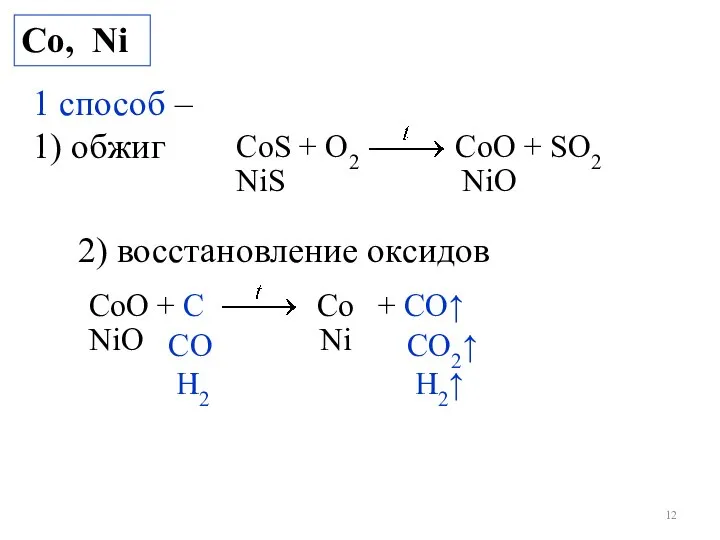
- 12. Со, Ni CoS + O2 CoO + SO2 1 способ – 1) обжиг NiS NiO CoO
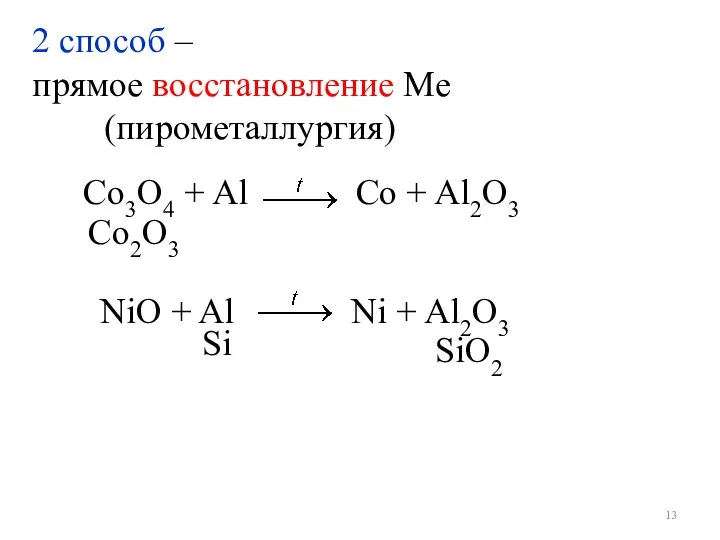
- 13. Со3О4 + Al Co + Al2О3 2 способ – прямое восстановление Ме (пирометаллургия) Со2О3 NiO +
- 14. Химические свойства Fe → Co → Ni ↓ активности
- 15. Реакции с простыми веществами Me + O2 → MeO (Me2O3, Me3O4) образуют – сульфиды карбиды нитриды
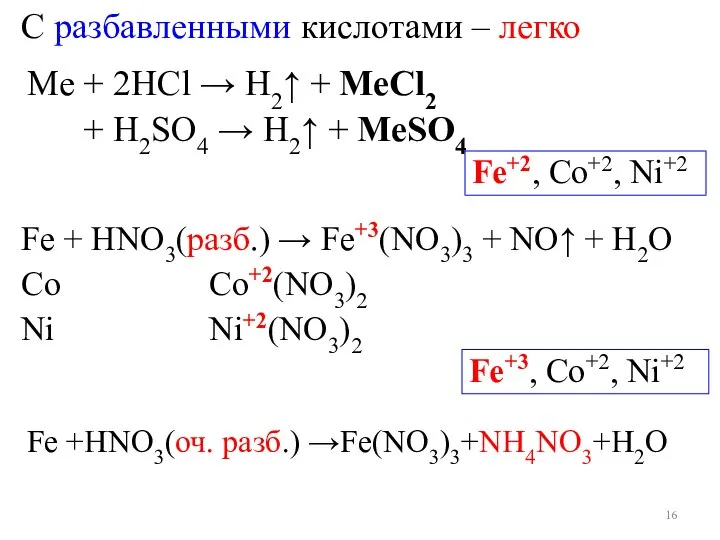
- 16. С разбавленными кислотами – легко Mе + 2НСl → H2↑ + MeCl2 + Н2SO4 → Н2↑
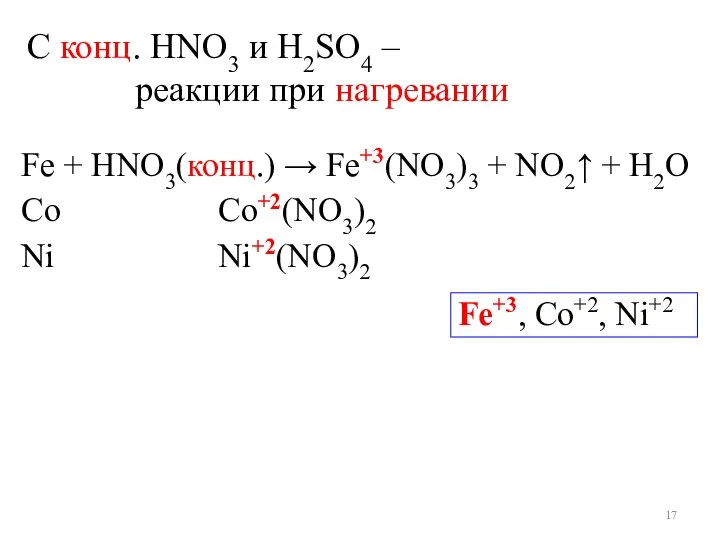
- 17. С конц. HNO3 и H2SO4 – реакции при нагревании Fe + НNO3(конц.) → Fe+3(NO3)3 + NO2↑
- 18. Химическая активность Fe – в реакции с Н2SO4(конц.) Fe + Н2SO4(конц.) = Fe2(SO4)3 + S↓ +
- 19. Реакции со щелочами (конц. ≈ 50% ) Fe + 2OН− + H2O [Fe(OH)4]2− + H2↑ Ni
- 20. Соединения Fe, Co, Ni снижение высшей устойчивой С.О. Fe → Co → Ni Fe+2, Co+2, Ni+2
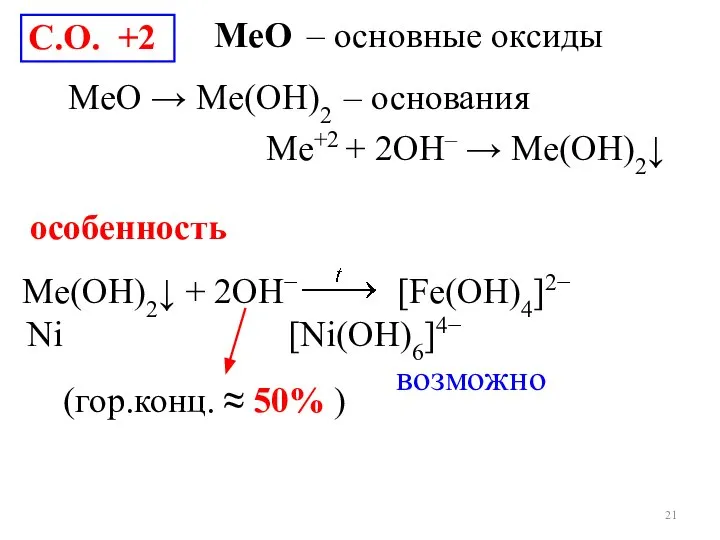
- 21. С.О. +2 MеO – основные оксиды MeO → Me(ОН)2 – основания Ме+2 + 2OH– → Мe(ОН)2↓
- 22. Fe+2 + 2OH– → Fe(ОН)2↓ (белый) на воздухе 4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3↓ бурый
- 23. В водных растворах – гидролиз 1 ступень Me2+ + НОН ⇄ MeOH+ + Н+ рН Ионы
- 24. комплексообразователи [Fe(CN)6]4– анионные [Ni(NН3)6]2+ катионные Fe+2, Co+2, Ni+2 К.Ч. = 4, 6 [Fe(H2O)6] 2+
- 25. К.Ч.= 4 темно-синий К.Ч. = 6 розовый [Co(H2O)6]2+ + 4Сl– = [CoCl4]2– + 6H2O Окраска комплексов
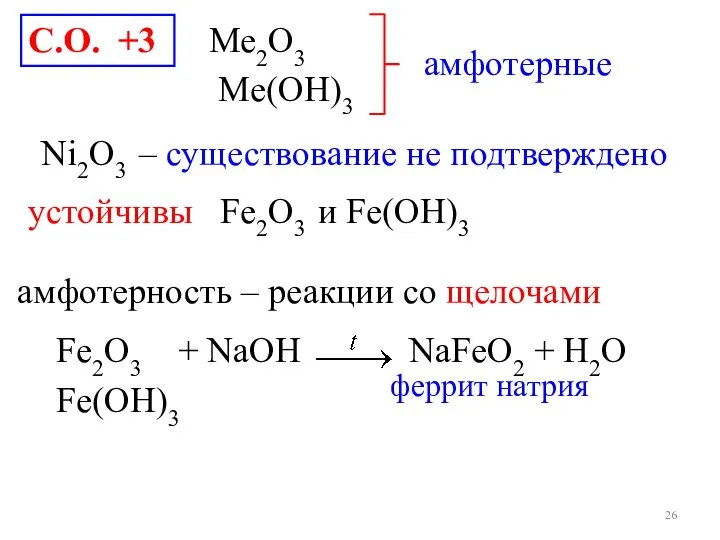
- 26. С.О. +3 Ni2O3 ‒ существование не подтверждено устойчивы Fe2O3 и Fе(OH)3 амфотерные Ме2O3 Mе(OH)3 Fe2O3 +
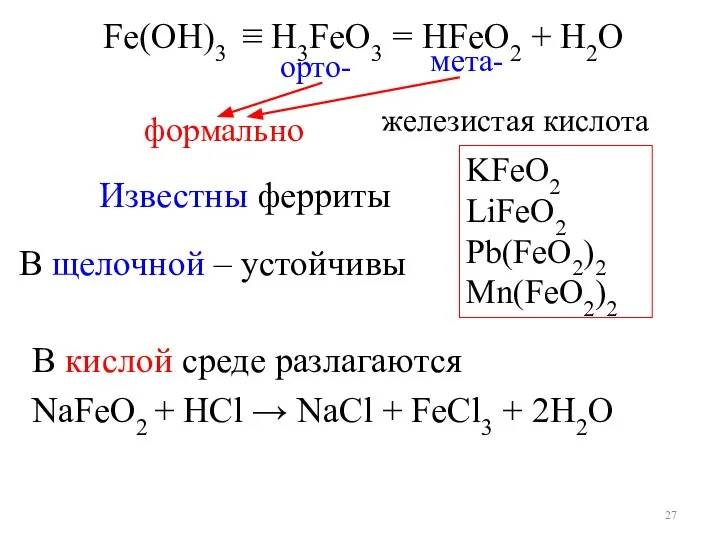
- 27. Fe(OН)3 ≡ H3FeO3 = HFeO2 + H2O орто- мета- железистая кислота формально KFeO2 LiFeO2 Pb(FeO2)2 Mn(FeO2)2
- 28. В водных растворах – гидролиз Fe3+ 1 ступень Fe2+ + НОН ⇄ FeOH2+ + Н+ рН
- 29. Окислительно-восстановительные свойства Fe3+ − окисл.-восст. двойственность Fe3+ + 1ē → Fe2+ окислитель восстановитель Fe3+ + 8OH–
- 30. Co+3(OH)3 + HCl(конц.) = Сo+2Cl2+ Cl2↑+ H2O Ni(OH)3 NiCl2 Co+3(OH)3+H2SO4(конц.) = Сo+2SO4+O2↑+H2O Ni(OH)3 NiSO4 Co3+, Ni3+
- 31. Для Co3+ известны CoF3 CoCl3 CoBr3 CoI3 - почти все они крайне неустойчивы - сильные окислительные
- 32. [Ni(NH3)6]Cl2 + 3H2SO4 = NiCl2 + 3(NH4)2SO4 Комплексные соединения Со3+ - чрезвычайно устойчивы - многообразны аммиакат
- 33. CoCl2 → Na3[Co(NO2)6] + NO + NaCl + +CH3COONa+ H2O → Na3[Co(СN)6] + Н2↑ + NaCl
- 34. между комплексообразователем и лигандами – ионные силы (электростатическое взаимодействие) лиганд – источник заряда (источник кристаллического поля)
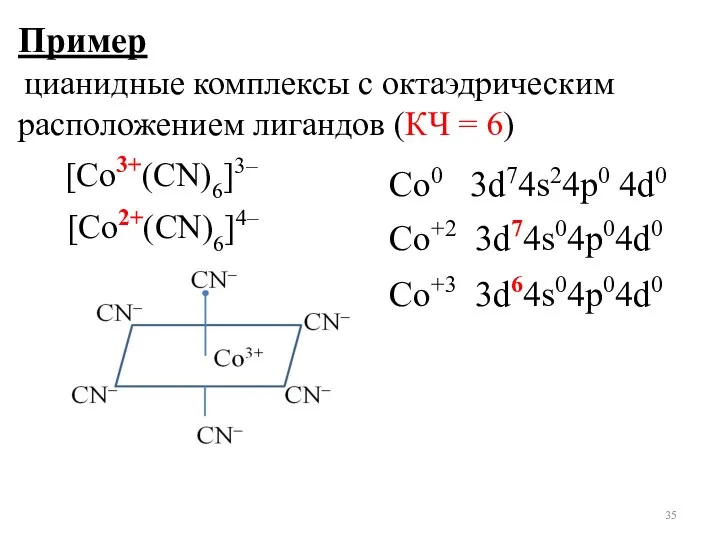
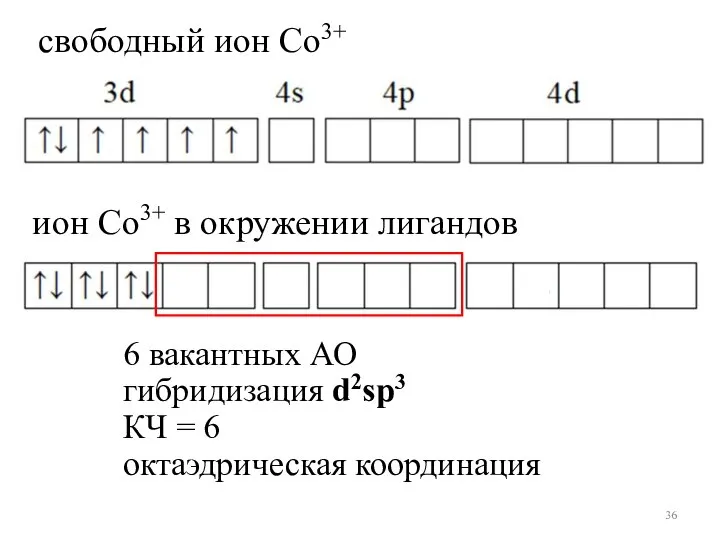
- 35. Пример цианидные комплексы с октаэдрическим расположением лигандов (КЧ = 6) Со0 3d74s24p0 4d0 Со+3 3d64s04p04d0 [Co3+(СN)6]3–
- 36. 6 вакантных АО гибридизация d2sp3 КЧ = 6 октаэдрическая координация свободный ион Со3+ ион Со3+ в
- 37. вырожденное состояние атомных орбиталей 3d-подуровня атома Со
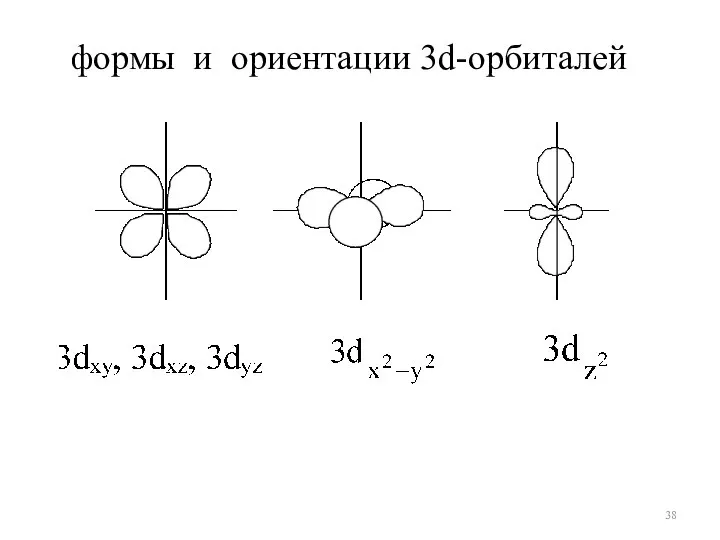
- 38. формы и ориентации 3d-орбиталей
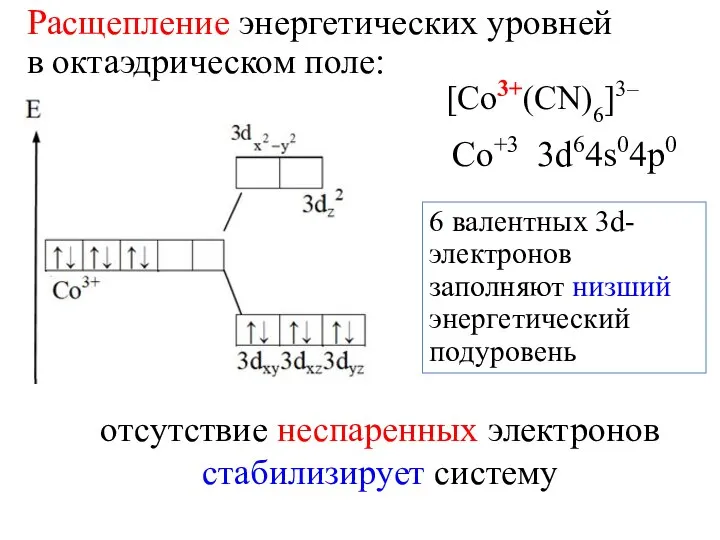
- 39. 6 валентных 3d-электронов заполняют низший энергетический подуровень Расщепление энергетических уровней в октаэдрическом поле: [Co3+(СN)6]3– Со+3 3d64s04p0
- 40. один электрон оказывается на высшем энергетическом подуровне Со+ 3d74s04p0 неспаренный электрон дестабилизирует систему [Co2+(СN)6]4–
- 41. исключительная реакционная активность комплекса: [Со(CN)6]4– – 1ē = [Со(CN)6]3– 2K4[Со2+(CN)6] + 2H2O = = 2K3[Со3+(CN)6] +
- 42. 4 неспаренных ēē с одинаковыми спинами комплекс [Со(NH3)6]3– - высокоспиновый Сила кристаллического поля зависит от природы
- 43. [Со(CN)6]3– - все электроны спаренные ион Со3+ в окружении лигандов Σms = 0 низкоспиновый комплекс (диамагнитный)
- 44. [Со(NН3)6]2+ KН = 2,45∙10–4 [Со(NН3)6]3+ KН = 4,57∙10–33 Устойчивость высокоспиновых комплексов Со3+ выше, чем Со2+
- 45. Для никеля К.Ч. = 6, 5, 4 [Ni(H2O)6]2+ ярко-зеленый аналогичный цвет NiSO4 ∙ 6 H2O [Ni(NH3)6]2+
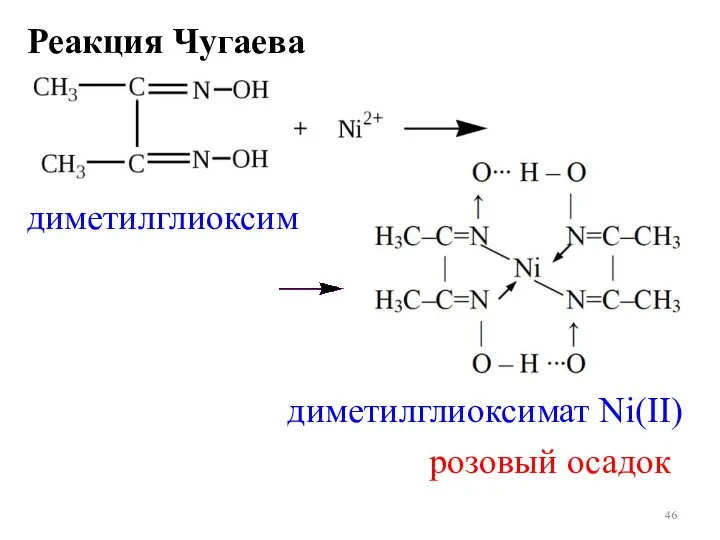
- 46. Реакция Чугаева диметилглиоксим диметилглиоксимат Ni(II) розовый осадок
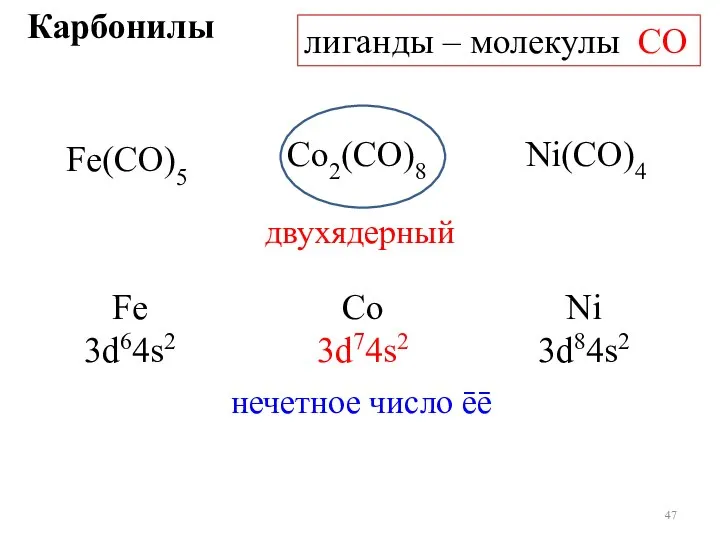
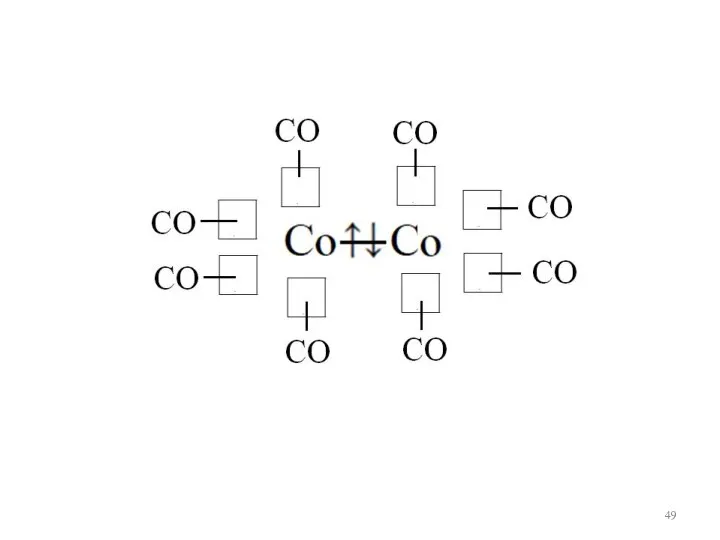
- 47. Карбонилы лиганды – молекулы СО Fe(CO)5 Co2(CO)8 Ni(CO)4 двухядерный Fe 3d64s2 Со 3d74s2 Ni 3d84s2 нечетное
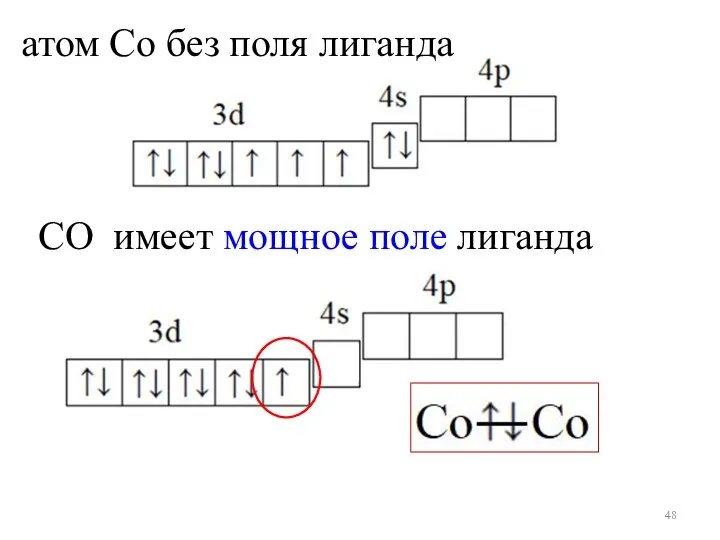
- 48. атом Со без поля лиганда СО имеет мощное поле лиганда
- 50. С.О. +6 FeO3 – кислотный реализуется в феррат-ионе FeО42− Ферраты – соли несуществующей H2FeO4 железная кислота
- 51. В кислой и нейтральной среде FeО42− - сильные окислители превосходят перманганаты FeО42– + 8H+ + 3ē
- 53. Скачать презентацию















![комплексообразователи [Fe(CN)6]4– анионные [Ni(NН3)6]2+ катионные Fe+2, Co+2, Ni+2 К.Ч. = 4, 6 [Fe(H2O)6] 2+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/685396/slide-23.jpg)
![К.Ч.= 4 темно-синий К.Ч. = 6 розовый [Co(H2O)6]2+ + 4Сl– =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/685396/slide-24.jpg)




![[Ni(NH3)6]Cl2 + 3H2SO4 = NiCl2 + 3(NH4)2SO4 Комплексные соединения Со3+ -](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/685396/slide-31.jpg)
![CoCl2 → Na3[Co(NO2)6] + NO + NaCl + +CH3COONa+ H2O →](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/685396/slide-32.jpg)


![один электрон оказывается на высшем энергетическом подуровне Со+ 3d74s04p0 неспаренный электрон дестабилизирует систему [Co2+(СN)6]4–](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/685396/slide-39.jpg)
![исключительная реакционная активность комплекса: [Со(CN)6]4– – 1ē = [Со(CN)6]3– 2K4[Со2+(CN)6] +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/685396/slide-40.jpg)
![4 неспаренных ēē с одинаковыми спинами комплекс [Со(NH3)6]3– - высокоспиновый Сила](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/685396/slide-41.jpg)
![[Со(CN)6]3– - все электроны спаренные ион Со3+ в окружении лигандов Σms](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/685396/slide-42.jpg)
![[Со(NН3)6]2+ KН = 2,45∙10–4 [Со(NН3)6]3+ KН = 4,57∙10–33 Устойчивость высокоспиновых комплексов Со3+ выше, чем Со2+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/685396/slide-43.jpg)
![Для никеля К.Ч. = 6, 5, 4 [Ni(H2O)6]2+ ярко-зеленый аналогичный цвет](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/685396/slide-44.jpg)


 Фенолы. Простые эфиры
Фенолы. Простые эфиры Митохондрии и пластиды
Митохондрии и пластиды ПОЛУЧЕНИЕ СИВУШНЫХ МАСЕЛ И СПИРТА ПРИ БРОЖЕНИИ УГЛЕВОДОВ Кейс 2
ПОЛУЧЕНИЕ СИВУШНЫХ МАСЕЛ И СПИРТА ПРИ БРОЖЕНИИ УГЛЕВОДОВ Кейс 2 Химическое равновесие
Химическое равновесие Промислові способи отримання металів
Промислові способи отримання металів  Уравнения химических реакций
Уравнения химических реакций Углеводороды. Обобщение знаний
Углеводороды. Обобщение знаний Структура ячейки на примере атома железа
Структура ячейки на примере атома железа Основы аналитической химии и физико - химических методов анализа
Основы аналитической химии и физико - химических методов анализа Общие сведения о полезных ископаемых. (Лекция 2)
Общие сведения о полезных ископаемых. (Лекция 2) ИСКУССТВЕННЫЕ ПОЛИМЕРЫ
ИСКУССТВЕННЫЕ ПОЛИМЕРЫ Классификация веществ по характеру связи
Классификация веществ по характеру связи Припекание взаимно растворимых твердых тел
Припекание взаимно растворимых твердых тел Строение атома фосфора. Строение оксида фосфора (V) и его физические свойства
Строение атома фосфора. Строение оксида фосфора (V) и его физические свойства Гетерофункционалды органикалық қосылыстар
Гетерофункционалды органикалық қосылыстар Дезодоранты. Выполнили: Ученицы 11-В класса МОУ «Лицей №3» Доровских Алёна Чучуменко Анастасия
Дезодоранты. Выполнили: Ученицы 11-В класса МОУ «Лицей №3» Доровских Алёна Чучуменко Анастасия Кислоты. Определение кислот
Кислоты. Определение кислот Кристаллическое строение материалов. Лекция 2
Кристаллическое строение материалов. Лекция 2 Тесты для самопроверки
Тесты для самопроверки Производство бензина
Производство бензина Использование проектного метода при изучении химии
Использование проектного метода при изучении химии Старение полимеров. Процессы, протекающие при старении полимеров
Старение полимеров. Процессы, протекающие при старении полимеров Пластмассы
Пластмассы Каустобиолиты, горючие полезные ископаемые органического происхождения
Каустобиолиты, горючие полезные ископаемые органического происхождения Теплові прояви механічної, електричної та хімічної енергії
Теплові прояви механічної, електричної та хімічної енергії Алканы CnH2n+2 - Презентация по Химии
Алканы CnH2n+2 - Презентация по Химии Химическая кинетика
Химическая кинетика Ферроцен. Свойства, получение и применение
Ферроцен. Свойства, получение и применение