Содержание
- 2. Строение атома фосфора. Строение оксида фосфора (V) и его физические свойства. Получение и химические свойства. Строение
- 3. Р заряд ядра= +15 31P Электронная конфигурация: Р Р* (стационарное) (возбужденное) 1s22s2 2p6 3s1 3p3 3d1
- 4. Фосфин и фосфиды
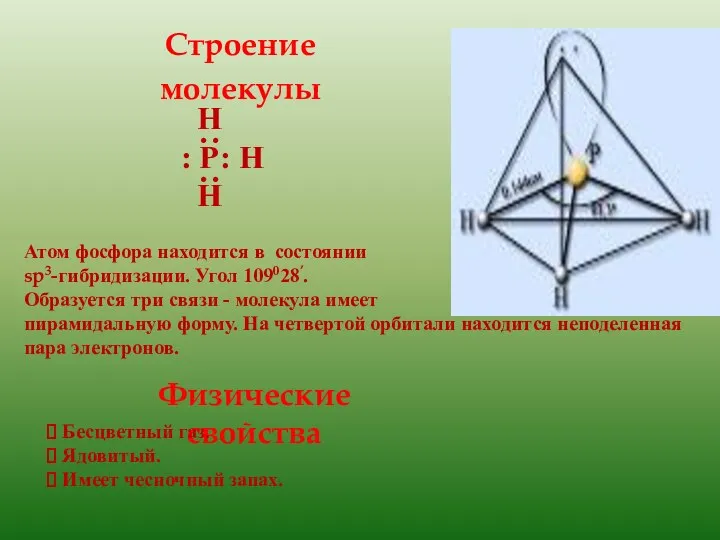
- 5. Н : Р: Н Н ∙∙ ∙∙ Атом фосфора находится в состоянии sp3-гибридизации. Угол 109028’. Образуется
- 6. Получение фосфина Получают фосфин действием воды на фосфид кальция: 3Са + 2Р = Са3Р2 Са3Р2 +
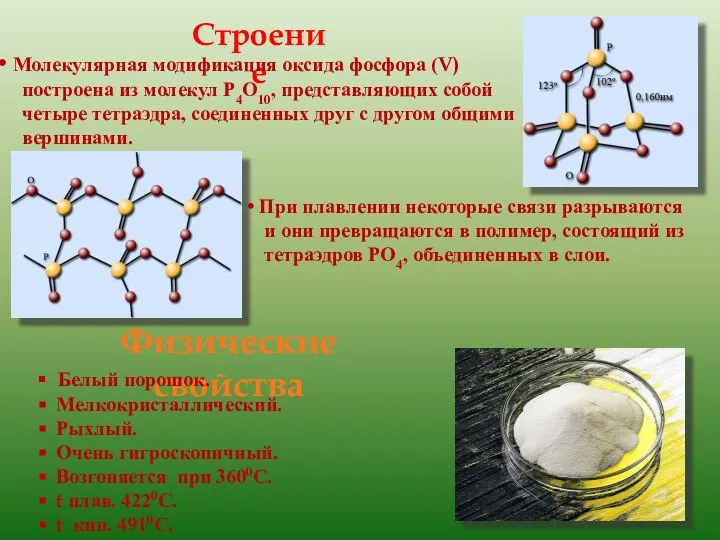
- 7. Оксид фосфора(V)
- 8. Физические свойства Белый порошок. Мелкокристаллический. Рыхлый. Очень гигроскопичный. Возгоняется при 3600С. t плав. 4220С. t кип.
- 9. Получение и химические свойства фосфорного ангидирида Оксид фосфора (V) образуется при сгорании фосфора: 4Р + 5О2
- 10. Фосфорная кислота
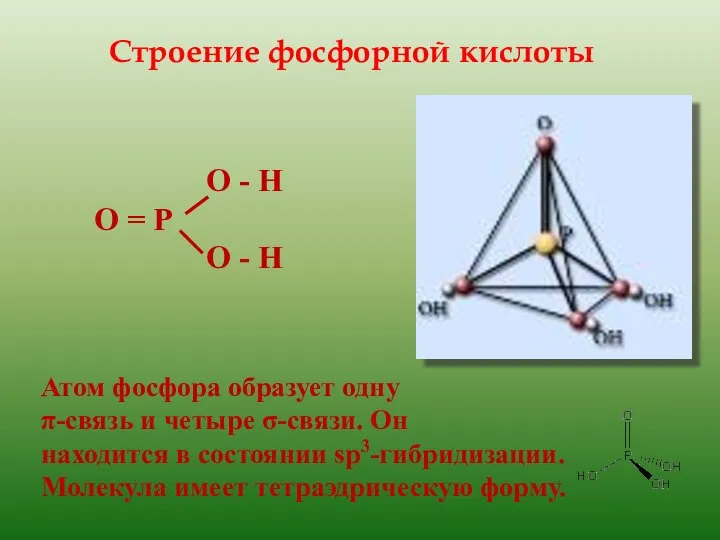
- 11. Строение фосфорной кислоты О - Н О = Р О - Н Атом фосфора образует одну
- 12. Физические свойства Бесцветные кристаллы ромбической формы. Гигроскопична. Температура плавления 42,30С. После плавления образует вязкую маслообразную жидкость
- 13. Фосфорную кислоту открыл Р. Бойль с помощью индикаторов: сжигая фосфор и растворяя образовавшийся белый продукт в
- 14. Получение Термический способ: Ca3(PO4)2 → P → P2O5 → H3PO4 Ca3(PO4)2 + 3SiO2 + 5C =
- 15. Химические свойства Диссоциирует ступенчато: H3PO4 H+ + H2PO4- К1 = 7,6∙10-3 дигидрофосфат-ион H2PO4- H+ + HPO42-
- 16. 5. Реакции с металлами тормозятся образованием нерастворимых фосфатов: 3Mg + 2H3PO4 = Mg3(PO4)2↓ + 3H2↑ При
- 17. Фосфаты - соли фосфорной кислоты Фосфаты - вещества с ионным типом кристаллической решетки. Это - твердые
- 18. Фосфорная кислота в природе Растения. Один из компонентов питания растений. Фосфор используется для построения семян и
- 19. Применение Производство минеральных удобрений: повышают урожайность; придают зимостойкость; создают условия для быстрого созревания. Производство кормовых добавок.
- 21. Скачать презентацию















 Алканы. Аминокислоты
Алканы. Аминокислоты Благородные металлы
Благородные металлы Сера. Свойства серы
Сера. Свойства серы Переосаждение. (Глава 4. § 20. Задача 13)
Переосаждение. (Глава 4. § 20. Задача 13) Жиры. История открытия жиров
Жиры. История открытия жиров Основные разделы химии
Основные разделы химии Интоксикация пестицидами
Интоксикация пестицидами Defect in solid
Defect in solid Основы общей химии
Основы общей химии Биологическое окисление
Биологическое окисление Качественный химический анализ воды на определение металлов
Качественный химический анализ воды на определение металлов Презентация по дисциплине «Химия» по теме: «Нефть, состав и свойства. Переработка нефти. Нефтепродукты, их применение.» студентк
Презентация по дисциплине «Химия» по теме: «Нефть, состав и свойства. Переработка нефти. Нефтепродукты, их применение.» студентк Производные пиррола и индола. (Лекция 4)
Производные пиррола и индола. (Лекция 4) Массообменные процессы
Массообменные процессы Фенолдар. Анықтама
Фенолдар. Анықтама Презентация по Химии "ПЛАСТМАССА" - скачать смотреть
Презентация по Химии "ПЛАСТМАССА" - скачать смотреть  Ароматические кислоты и их производные. Общая характеристика, методы получения и исследования
Ароматические кислоты и их производные. Общая характеристика, методы получения и исследования Конструкционные функциональные волокнистые композиты
Конструкционные функциональные волокнистые композиты Висмут Bi
Висмут Bi Строение и устойчивость дисперсий льда, стабилизированных гидрофобизированным нанокремнеземом
Строение и устойчивость дисперсий льда, стабилизированных гидрофобизированным нанокремнеземом Серная кислота и её свойства
Серная кислота и её свойства Материаловедение. Теория сплавов. (Тема 6)
Материаловедение. Теория сплавов. (Тема 6) Циклічна обернено-похідна хронопотенціометрія пірокатехіну та його похідних
Циклічна обернено-похідна хронопотенціометрія пірокатехіну та його похідних Фармацевтические суспензии и эмульсии
Фармацевтические суспензии и эмульсии Структура гетероциклов, нуклеозидов и нуклеотидов
Структура гетероциклов, нуклеозидов и нуклеотидов Основы цитологии. Химический состав клетки.
Основы цитологии. Химический состав клетки. Химическая термодинамика биологических процессов
Химическая термодинамика биологических процессов Металлические яды, изоляция минерализацией. Применение металлов и их соединений в клинической фармации
Металлические яды, изоляция минерализацией. Применение металлов и их соединений в клинической фармации