Содержание
- 2. КОНФЕРЕНЦИЯ В ПРОГРАММЕ ZOOM РАССЧИТАНА НА 40 МИНУТ, ПОЭТОМУ РАБОТАЕМ С 19:00 ДО 19:40, ПЕРЕРЫВ 5
- 3. ПОЖАЛУЙСТА, МАТЕРИАЛ КОНСПЕКТИРУЙТЕ. ОСОБОЕ ВНИМАНИЕ УДЕЛЯЕМ ОСНОВНЫМ ПОНЯТИЯМ И ЗАКОНАМ. ПО ЭТОЙ ТЕМЕ ДАЛЕЕ БУДЕТ ПРАКТИЧЕСКОЕ
- 4. Тема лекции Развитие материалистических представлений в химии. Основные химические понятия и законы.
- 5. ВВЕДЕНИЕ Цель дисциплины создать основу для дальнейшего изучения химических дисциплин, сформировать элементарные навыки работы в химической
- 6. ПРОИСХОЖДЕНИЕ ТЕРМИНА “ХИМИЯ” Есть несколько версий: от египетского слова "Хем" - арабского названия этой страны -
- 7. ПЕРИОДИЗАЦИЯ ИСТОРИИ ХИМИИ Выделяют 2 основных периода: а) эмпирический (с древности до XVIIIв); процесс познания через
- 8. ОСНОВНЫЕ ПЕРИОДЫ В ИСТОРИИ ХИМИИ 1. Период алхимии - с древности до XVI в. нашей эры.
- 9. Античная атомистика V-IV в до н.э. Основателями первой древнегреческой атомистической теории считают Левкиппа и Демокрита. В
- 10. Роберт Бойль Он положили начало рождению новой химической науки, отдельной от медицины. Систематизируя многочисленные цветные реакции
- 11. К концу XVIII в. в химии был накоплен большой объем экспериментальных данных, которые необходимо было систематизировать
- 12. ПЕРИОД НАУЧНОЙ ХИМИИ XIX—XX ВВ За открытым Лавуазье законом сохранения массы последовал целый ряд новых количественных
- 13. М. В. ЛОМОНОСОВ - ОСНОВОПОЛОЖНИК НАУЧНОЙ ХИМИИ В РОССИИ М.В. Ломоносов - создатель школы российских химиков.
- 14. Й. Я. БЕРЦЕЛИУС вычислил относительные атомные массы всех известных к тому времени элементов (45). Берцелиус ввел
- 15. МОЛЕКУЛЯРНАЯ ТЕОРИЯ АВОГАДРО В 1814 г. итальянский физик и химик А. Авогадро сформулировал закон, который носит
- 16. МЕЖДУНАРОДНЫЙ СЪЕЗД ХИМИКОВ В КАРЛСРУЭ. РЕФОРМА АТОМНО-МОЛЕКУЛЯРНОЙ ТЕОРИИ В середине XIX в. у различных школ и
- 17. ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ
- 18. Химия – это наука о составе, строении, свойствах и превращениях веществ. Вещество – один из видов
- 19. ЗАДАЧИ ХИМИИ Изучение веществ, их физических и химических свойств Изучение превращений веществ и процессов, сопровождающих эти
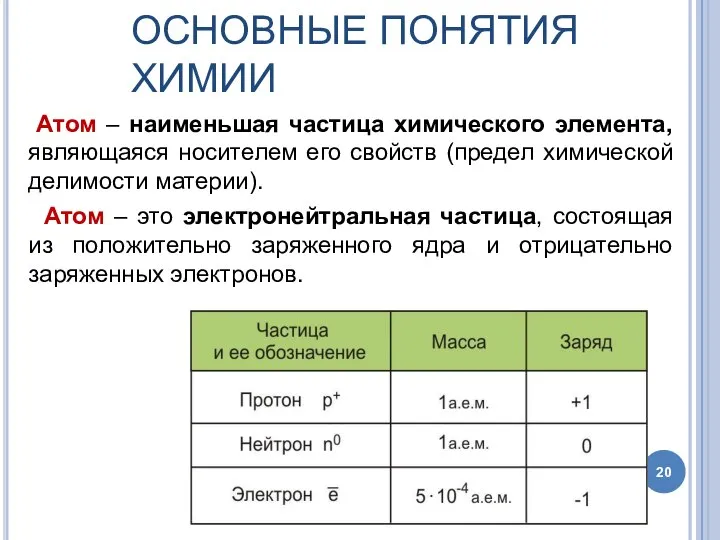
- 20. ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ Атом – наименьшая частица химического элемента, являющаяся носителем его свойств (предел химической делимости
- 21. Химический элемент – это совокупность атомов с одинаковым зарядом ядра. Объектом изучения в химии являются химические
- 22. ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ Элементы принято обозначать первой или первой и одной из последующих букв латинских названий
- 23. ХИМИЧЕСКИЙ ЗНАК (СИМВОЛ) – обозначает название элемента, один его атом, один моль атомов этого элемента. По
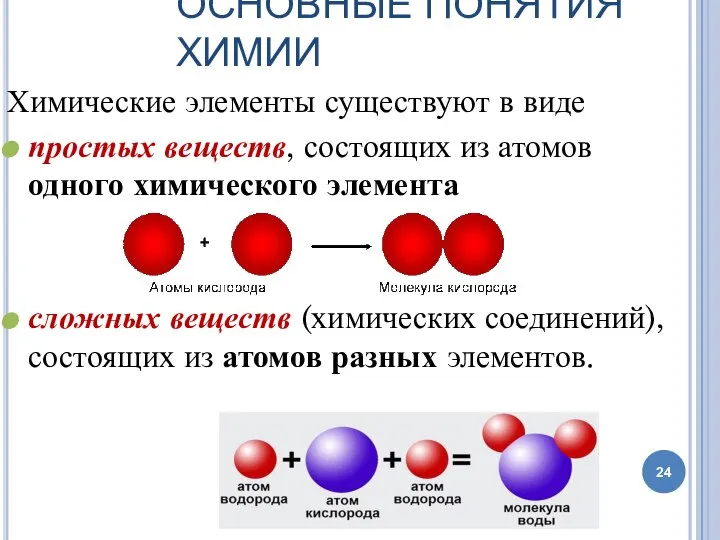
- 24. ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ Химические элементы существуют в виде простых веществ, состоящих из атомов одного химического элемента
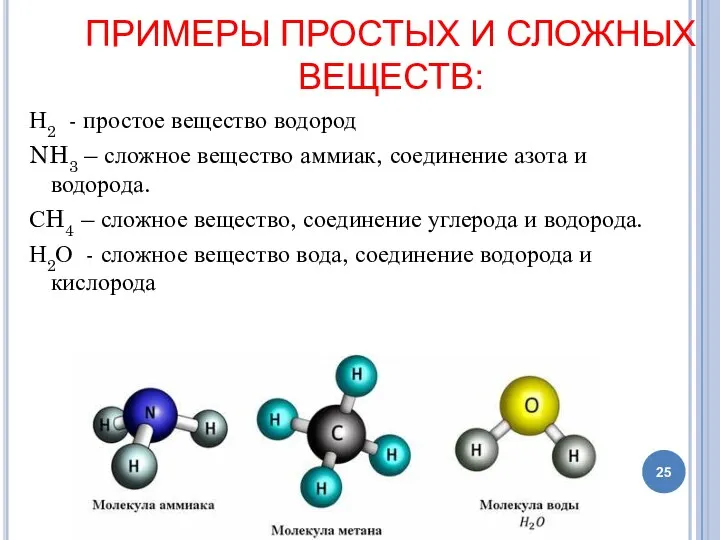
- 25. ПРИМЕРЫ ПРОСТЫХ И СЛОЖНЫХ ВЕЩЕСТВ: Н2 - простое вещество водород NH3 – сложное вещество аммиак, соединение
- 26. Аллотропия – способность химического элемента образовывать несколько простых веществ, называемых аллотропными модификациями ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ
- 27. Аллотропные модификации углерода (С): алмаз, графит, фуллерен, графен, нанотрубки ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ
- 28. АЛЛОТРОПИЯ Аллотропные модификации фосфора Р: белый (желтый), красный и черный
- 29. ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ Молекула – это электронейтральная частица, образующаяся при возникновении ковалентных связей между атомами одного
- 30. ХИМИЧЕСКАЯ ФОРМУЛА - это условная запись качественного и количественного состава вещества при помощи химических знаков и
- 31. ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ Широко используются несколько видов химических формул: Простейшая (эмпирическая) формула показывает качественный состав и
- 32. АТОМНАЯ МАССА ЭЛЕМЕНТА Масса атомов, молекул и ионов очень мала, 10-24 – 10-23 г Например, масса
- 33. Атомная единица массы (а.е.м.) - внесистемная единица массы. Атомная единица массы – это единица массы, равная
- 34. Относительная атомная масса элемента Ar Относительная атомная масса элемента показывает во сколько раз масса его атома
- 35. Атомные массы элементов приведены в периодической системе элементов.
- 36. МАССА МОЛЕКУЛЫ Относительная молекулярная масса Мr (молекулярная масса) Мr равна сумме относительных атомных масс всех атомов,
- 37. КОЛИЧЕСТВО ВЕЩЕСТВА В Международной системе СИ за единицу количества вещества принят моль. МОЛЬ - это количество
- 38. ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ Постоянная Авогадро ( ) – число атомов или молекул (или других структурных единиц),
- 39. Моль – единица количества вещества ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ
- 40. МОЛЯРНАЯ МАССА (М) – масса 1 моля вещества в граммах [М] = [г/моль] Молярная масса численно
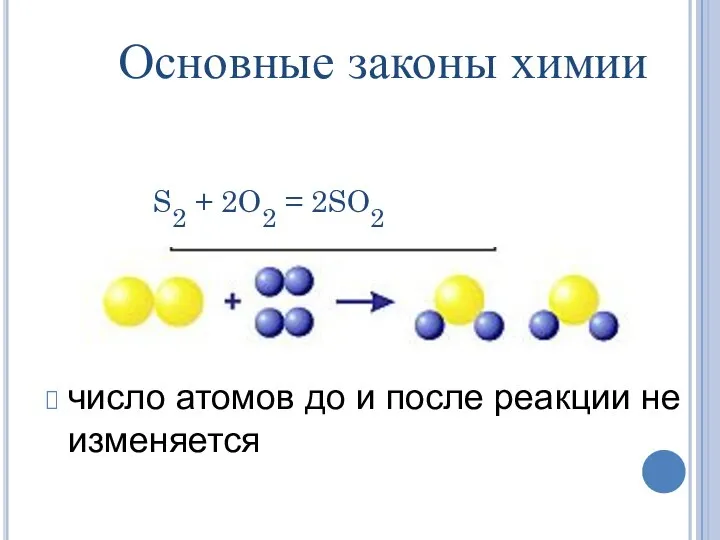
- 41. ОСНОВНЫЕ ЗАКОНЫ ХИМИИ Закон сохранения массы. Масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в
- 42. S2 + 2O2 = 2SO2 число атомов до и после реакции не изменяется Основные законы химии
- 43. ОСНОВНЫЕ ЗАКОНЫ ХИМИИ Закон объемных отношений Объемы газов, вступающих в химическую реакцию, и объемы газов, образующихся
- 44. ОСНОВНЫЕ ЗАКОНЫ ХИМИИ Закон объемных отношений Следствие. Стехиометрические коэффициенты в уравнениях химических реакций для газообразных веществ
- 45. ОСНОВНЫЕ ЗАКОНЫ ХИМИИ Закон постоянства состава вещества. Сформулирован Ж.-Л. Прустом в 1799 г.. Всякое чистое вещество
- 46. ОСНОВНЫЕ ЗАКОНЫ ХИМИИ Современная формулировка закона постоянства состава вещества таков: Состав соединений молекулярной структуры является постоянным
- 47. ОСНОВНЫЕ ЗАКОНЫ ХИМИИ Соединения постоянного состава - дальтониды (в память английского химика и физика Дальтона). Состав
- 48. ЗАКОН ПОСТОЯНСТВА СОСТАВА ВЕЩЕСТВА Так, СО2 можно получить по любой из следующих реакций: С + О2
- 49. ОСНОВНЫЕ ЗАКОНЫ ХИМИИ Закон Авогадро. В равных объемах различных газов при одинаковых условиях (температура, давление и
- 50. ЗАКОН АВОГАДРО. Один моль любого газа при одинаковых условиях занимает один и тот же объем.
- 51. СЛЕДСТВИЯ ИЗ ЗАКОНА АВОГАДРО : 1. Молярный объем газа Vm – объем 1 моля газа при
- 52. ОСНОВНЫЕ ЗАКОНЫ ХИМИИ Массы двух разных газов, занимающих одинаковый объем при одинаковых условиях, относятся между собой
- 54. Скачать презентацию



































![МОЛЯРНАЯ МАССА (М) – масса 1 моля вещества в граммах [М]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/680127/slide-39.jpg)











 Биохимия печени. (Лекция 31)
Биохимия печени. (Лекция 31) Фосфатные породы
Фосфатные породы Элементы V группы Периодической системы химических элементов Д.И.Менделеева Работу выполнила учитель химии МОУ Северн
Элементы V группы Периодической системы химических элементов Д.И.Менделеева Работу выполнила учитель химии МОУ Северн Ауыз судың химиялық тұрғыдан зиянсыздығын сипаттаушы көрсеткіштер
Ауыз судың химиялық тұрғыдан зиянсыздығын сипаттаушы көрсеткіштер Титан. Физические свойства титана
Титан. Физические свойства титана Природные и синтетические красители и ароматизаторы
Природные и синтетические красители и ароматизаторы Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Краткая история химии
Краткая история химии Фосфонсірке қышқылының антипирендік қасиеттерін зерттеу
Фосфонсірке қышқылының антипирендік қасиеттерін зерттеу Положение в ПСХЭ водорода, лантаноидов, актиноидов и искусственно полученных элементов
Положение в ПСХЭ водорода, лантаноидов, актиноидов и искусственно полученных элементов Аттестационная работа. Исследование электрических свойств воды и её растворов
Аттестационная работа. Исследование электрических свойств воды и её растворов Металлы в природе, общие способы получения металлов
Металлы в природе, общие способы получения металлов Производство аммиака
Производство аммиака Семинар по неорганической химии: Комплексные соединения. Качественный анализ
Семинар по неорганической химии: Комплексные соединения. Качественный анализ “TERRA” программасы бойынша ферросиликоалюминийдің балқуының фазалық күйіндегі термодинамикалық есептеуі
“TERRA” программасы бойынша ферросиликоалюминийдің балқуының фазалық күйіндегі термодинамикалық есептеуі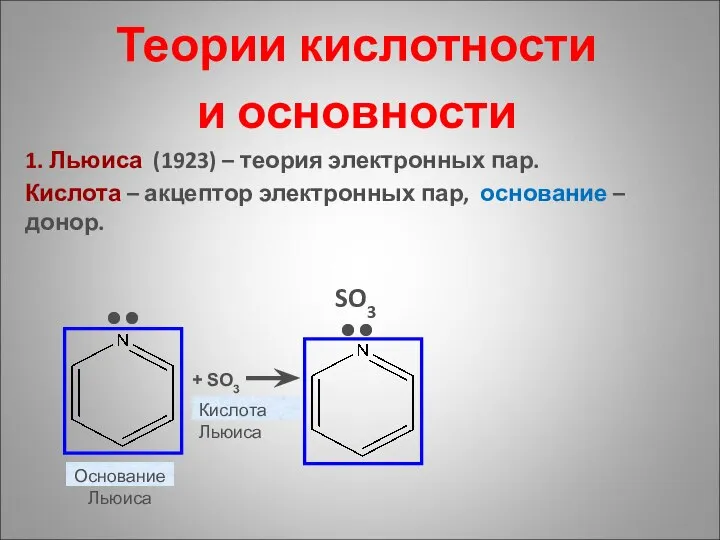 Теории кислотности и основности. Химические свойства спиртов, фенолов, аминов и их производных
Теории кислотности и основности. Химические свойства спиртов, фенолов, аминов и их производных Закономерности процессов тепло- и газообмена на пожаре
Закономерности процессов тепло- и газообмена на пожаре Органічні сполуки і здоров’я людини. Жири, білки, вуглеводи, вітаміни як компоненти їжі, їх роль в організмі
Органічні сполуки і здоров’я людини. Жири, білки, вуглеводи, вітаміни як компоненти їжі, їх роль в організмі Карбонильные соединения. Эфирные масла. Парфюмерия. Семинар 3. Индустрия красоты
Карбонильные соединения. Эфирные масла. Парфюмерия. Семинар 3. Индустрия красоты Сушка стекол для заливки полиакриламидных гелей
Сушка стекол для заливки полиакриламидных гелей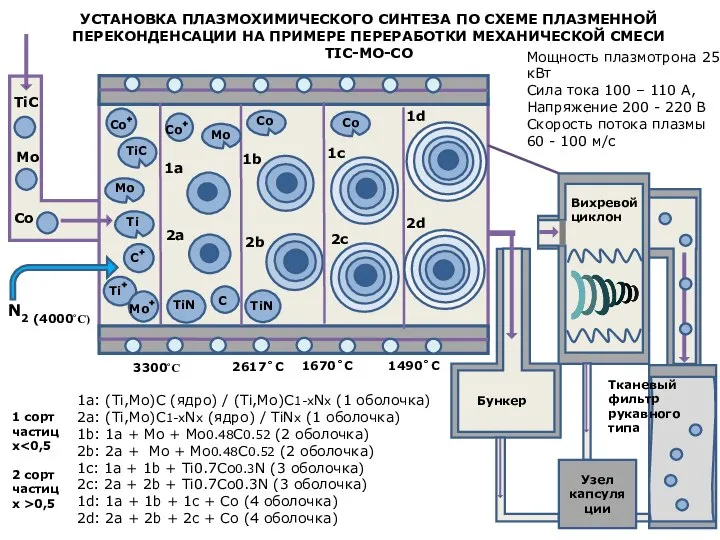 Установка плазмохимического синтеза по схеме плазменной переконденсации на примере переработки механической смеси tic-mo-co
Установка плазмохимического синтеза по схеме плазменной переконденсации на примере переработки механической смеси tic-mo-co Տերպենոիդներ (Իզոպրենոիդներ) պարունակող դեղաբույսեր եվ հումք
Տերպենոիդներ (Իզոպրենոիդներ) պարունակող դեղաբույսեր եվ հումք Презентация по Химии "Вода – важнейшая составляющая жизни на Земле" - скачать смотреть
Презентация по Химии "Вода – важнейшая составляющая жизни на Земле" - скачать смотреть  Алюминиевые сплавы
Алюминиевые сплавы Презентация по Химии "Определение геометрических размеров молекул изомеров октана" - скачать смотреть
Презентация по Химии "Определение геометрических размеров молекул изомеров октана" - скачать смотреть  Системы эвтектического типа
Системы эвтектического типа Основные характеристики клеев
Основные характеристики клеев Фолиевая кислота
Фолиевая кислота