Содержание
- 2. Титан — химический элемент с атомным номером 22. Принадлежит к 4-й группе периодической таблицы химических элементов,
- 3. Открытие титана Относительно чистый титан из-за сложности очистки был получен только в 1825 году шведским химиком
- 4. Физические свойства титана Титан — легкий серебристо-белый металл, тугоплавкий, в обычных условиях отличается высокой прочностью и
- 5. Химические свойства титана Чистый титан — химически активный переходный элемент, в соединениях имеет степень окисления +4,
- 6. Получение титана Процесс получения титана протекает в несколько стадий: Руду и концентрат титана переводят в диоксид
- 7. Производство титана Промышленное производство титана началось с 1948 года. Сначала в США. Затем в Англии, Японии,
- 8. Месторождения Крупные коренные месторождения титана находятся на территории ЮАР, России, Украины, Канады, США, Китая, Норвегии, Швеции,
- 9. Применение Металл применяется в химической промышленности (реакторы, трубопроводы, высоковакуумные насосы, трубопроводная арматура), военной промышленности (бронежилеты, броня
- 11. Применение Титан является физиологически инертным, благодаря чему применяется в медицине (протезы, остеопротезы, зубные имплантаты), в стоматологических
- 12. Первой в мировой практике монументальной литой скульптурой из титана является памятник Юрию Гагарину на площади его
- 13. Интересные факты Крупнейший производитель самого твердого металла в мире является российское предприятие «ВСМПО-Ависма», которое удовлетворяет треть
- 14. Интересные факты Титан имеет небольшую плотность, что важно в судостроительной сфере. Изделия из титана легкие, а
- 16. Скачать презентацию













 Сера в природе. Применение серы. Сероводород и сульфиды
Сера в природе. Применение серы. Сероводород и сульфиды Органическая химия. Непредельные углеводороды
Органическая химия. Непредельные углеводороды Хром. Основні характеристики
Хром. Основні характеристики В мире криссталлов
В мире криссталлов Органическая химия. Лекция - Гидроксикислоты
Органическая химия. Лекция - Гидроксикислоты Ионный обмен или сорбция
Ионный обмен или сорбция Вольфрам және молибден
Вольфрам және молибден Развивающие занятия в ГПД «Поделочные камни»
Развивающие занятия в ГПД «Поделочные камни» Исследование равновесия в системе газ-жидкость
Исследование равновесия в системе газ-жидкость Технологическое использование конденсированных ВВ. Компактирование порошков. Ударные волны в дисперсной среде. (Раздел 3.12)
Технологическое использование конденсированных ВВ. Компактирование порошков. Ударные волны в дисперсной среде. (Раздел 3.12) Непредельные углеводороды: алкены
Непредельные углеводороды: алкены Масс-спектрометрия в органической химии
Масс-спектрометрия в органической химии Солеобразующие оксиды
Солеобразующие оксиды Обобщение и систематизация знаний по теме Спирты и фенолы
Обобщение и систематизация знаний по теме Спирты и фенолы Лекарственные средства, производные конденсированных гетероциклических систем. (Тема 5)
Лекарственные средства, производные конденсированных гетероциклических систем. (Тема 5) Барометр – анероид. Атмосферное давление на различных высотах. Манометры
Барометр – анероид. Атмосферное давление на различных высотах. Манометры Химический элемент цинк
Химический элемент цинк Пищевые добавки
Пищевые добавки Производство аммиачной селитры под атмосферным давлением
Производство аммиачной селитры под атмосферным давлением История создания термометра: как придумали первый градусник?
История создания термометра: как придумали первый градусник? Муниципальное бюджетное общеобразовательное учреждение «Средняя общеобразовательная школа №9 с углубленным изучением отдельн
Муниципальное бюджетное общеобразовательное учреждение «Средняя общеобразовательная школа №9 с углубленным изучением отдельн Низкомолекулярные органические соединения витамины
Низкомолекулярные органические соединения витамины Cкорость химической реакции
Cкорость химической реакции Растворы. Способы выражения концентрации растворенного вещества
Растворы. Способы выражения концентрации растворенного вещества Кровь. Клеточный состав, функции, физико-химические константы и свойства. (Лекция 21)
Кровь. Клеточный состав, функции, физико-химические константы и свойства. (Лекция 21)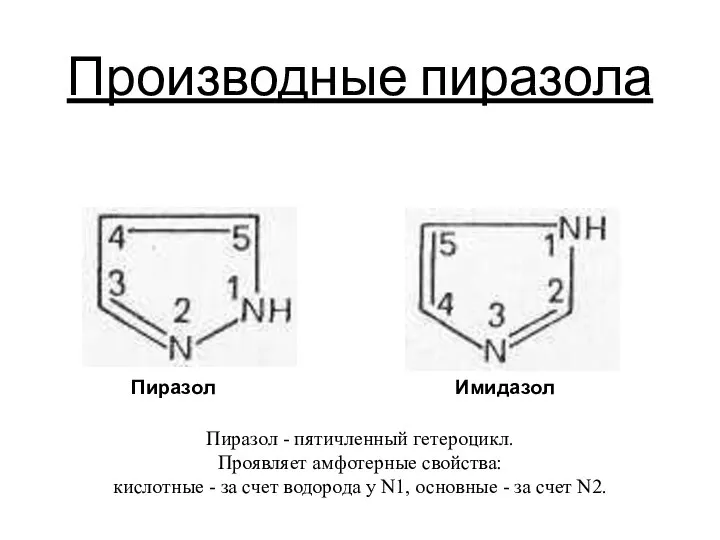 Производные пиразола
Производные пиразола Химия углеводородов. Часть 2
Химия углеводородов. Часть 2 Применение химических реакций в быту
Применение химических реакций в быту