Содержание
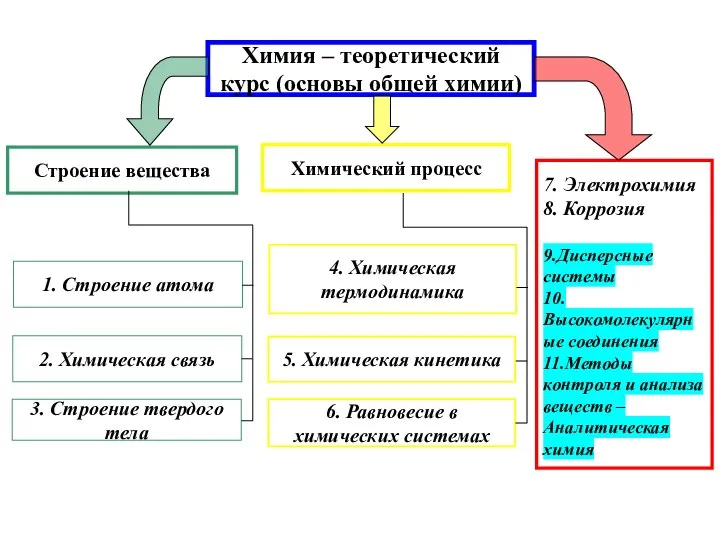
- 2. Химия – теоретический курс (основы общей химии) 1. Строение атома 2. Химическая связь 3. Строение твердого
- 4. I. Строение атома 3 этапа развития учения о строении атома 1 – Натурфилософские представления об атомном
- 5. Физические модели строения атома Эрнест Резерфорд - планетарная модель атома (1911 г.) Атом - сложная частица,
- 6. Корпускулярно-волновой дуализм свойств материи [проблема природы лучистой энергии - эл.магн.излучения(ЭМИ)] Электромагнитное излучение Волна: λ - длина
- 7. (дуализм-общее свойство материи, а не только ЭМИ) - гипотеза-постулат о связи импульса P любого движущегося материальн.объекта
- 8. Дифракция электронов Дэвиссон, Джермер(1927 г.); Томсон, Рейд(1928 г.) + Анод
- 9. Принцип неопределенности [для микрочастиц(электрона)] Вернер Гейзенберг постулировал этот принцип в 1927 г. для одномерного пространства в
- 10. График и уравнение волновой функции - плоской стоячей волны ᴪ(x,t) – для описания волнового характера движения
- 11. Уравнение Шредингера 1. Уравнение отображает волновой характер движения электрона в 3-х мерном пространстве с координатами (x,y,z)
- 12. λ → m, Ek = mv 2 / 2 = m 2 v 2 / 2m
- 13. Физический смысл волновой функции Ψ(x,y,z) - пси функция - волновая функция Макс Борн, 1926 г. волновая
- 14. Электрон в одномерном потенциальном ящике(яме). Решение ур. Шредингера. Потенциальная яма (ящик) - область пространства, вне которой
- 15. Нахождение волновой функции состояния электрона в потенц.ящике Решение ур.Шредингера в явном виде – набор волн.функций (собственных)
- 16. Нахождение энергии электрона Набору собственных волн.функций ᴪ(x) соответствует набор собственных значений Е, n = 1,2,3…- квантовое
- 17. Электрон в связанном состоянии (потенциальном ящике) – модель реального атома Выводы: Полная энергия электрона – квантована(дискретна):
- 18. Электрон в трехмерном потенциальном ящике Решение: электрон описывается где a,b,c – параметры потенц.ящика; nx, ny, nz
- 19. Вырожденные энергетические состояния Одно значение энергии – при нескольких наборах квантовых чисел (несколько наборов волновых функций).
- 20. Квантово-механическая модель атома. Основное состояние атома водорода [k=1/4πε0] - константа в з-не Кулона x = r⋅sinϑ⋅cosϕ
- 21. Решение уравнения Шредингера для основного состояния атома водорода
- 22. Решение системы ВЫВОД: Сходимость значений энергии Е электрона расчетной и экспериментальной (-13,6 эВ в основном состоянии)
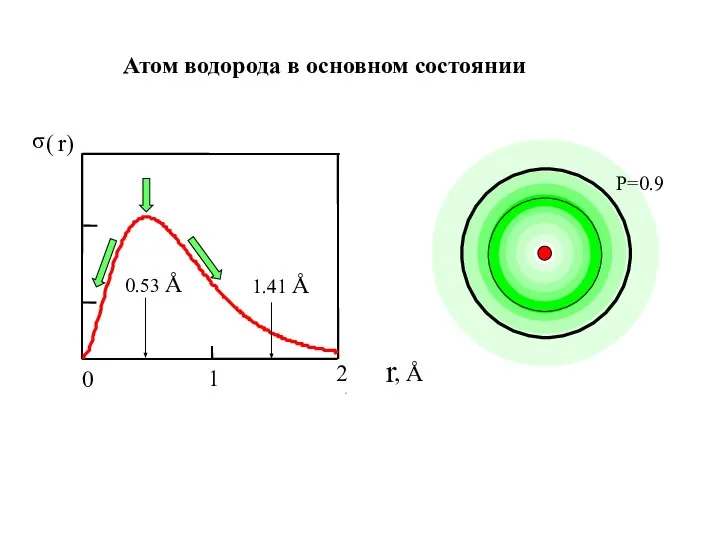
- 23. Радиальное распределение электронной плотности. Понятие электронной орбитали 1.41 Å Для сферы: dV = 4πr2dr dV-объём сферич.слоя
- 24. Атом водорода в основном состоянии
- 25. Возбужденные состояния атома водорода –более сложный вид волновых функций, чем Ψ(r) Общий вид таких волновых функций
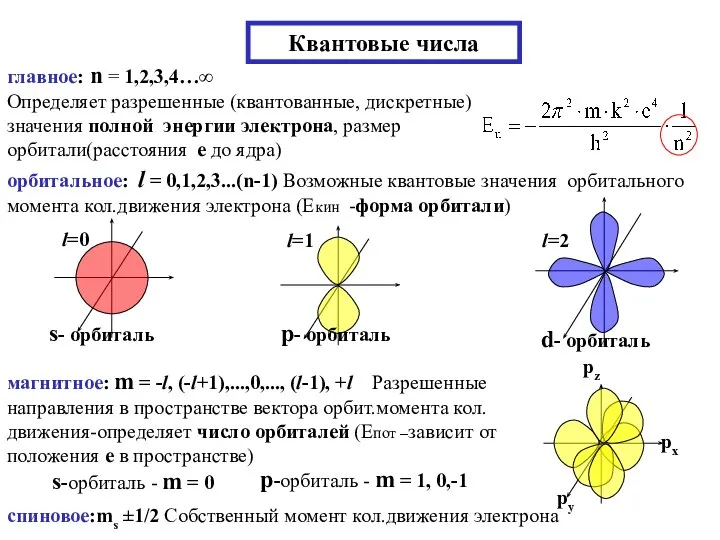
- 26. Квантовые числа главное: n = 1,2,3,4…∞ Определяет разрешенные (квантованные, дискретные) значения полной энергии электрона, размер орбитали(расстояния
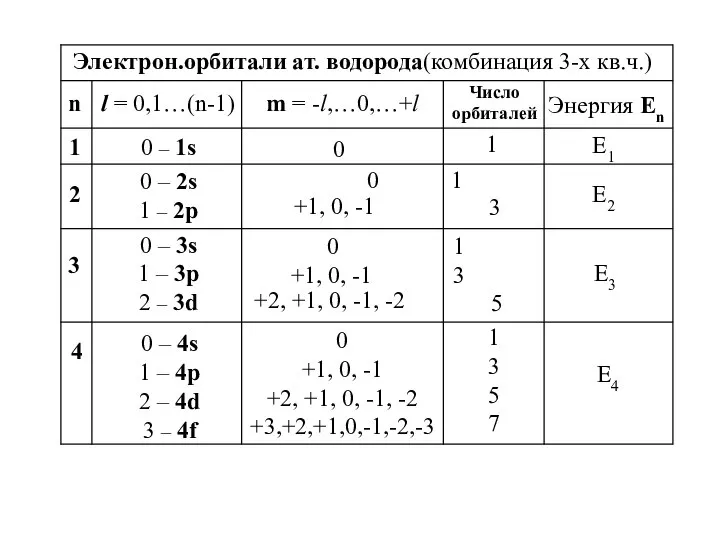
- 27. n l = 0,1…(n-1) m = -l,…0,…+l Число орбиталей Энергия Еn 1 E2 2 1 0
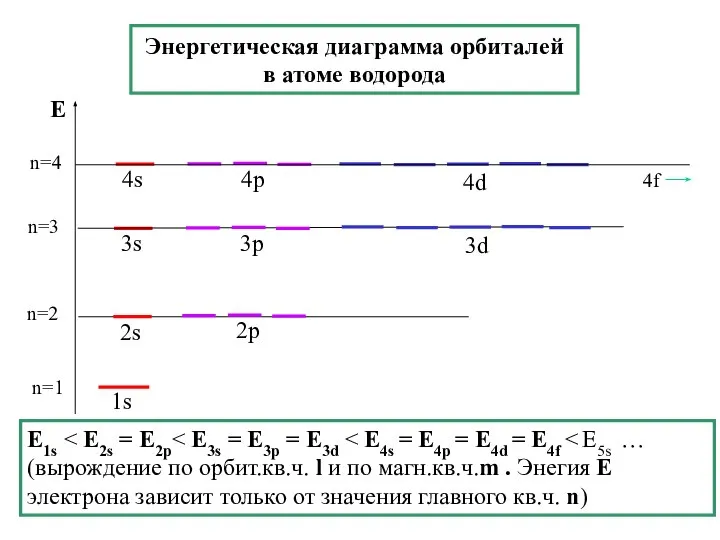
- 28. Энергетическая диаграмма орбиталей в атоме водорода n=1 E1s
- 29. Функции радиального распределения электронной плотности для различных энергетических состояний атома водорода. (*) Проникающая способность орбиталей: ns>np>nd;
- 30. 1.7 Многоэлектронный атом (одноэлектронное приближение - водородоподобная система, описание многоэлектронного атома похоже на описание атома водорода).
- 31. Зависимость энергии орбиталей Е от Z (заряда ядра) и от различия радиального распределения электронной плотности s,p
- 32. Таблица электронных орбиталей многоэлектронных атомов
- 33. Электронные конфигурации многоэлектронных атомов. Правила заселения электронами орбиталей 1. Принцип минимума энергии электронов. 2. Принцип (запрет)
- 34. 1.8 Периодическая таблица элементов (1869)
- 35. Физико-химические характеристики атома Ковалентный радиус ( RA = rсв /2) и радиус иона
- 36. Энергия ионизации - Eи (эВ) А0 – е → А+ s1 s2 s2p1 s2p3
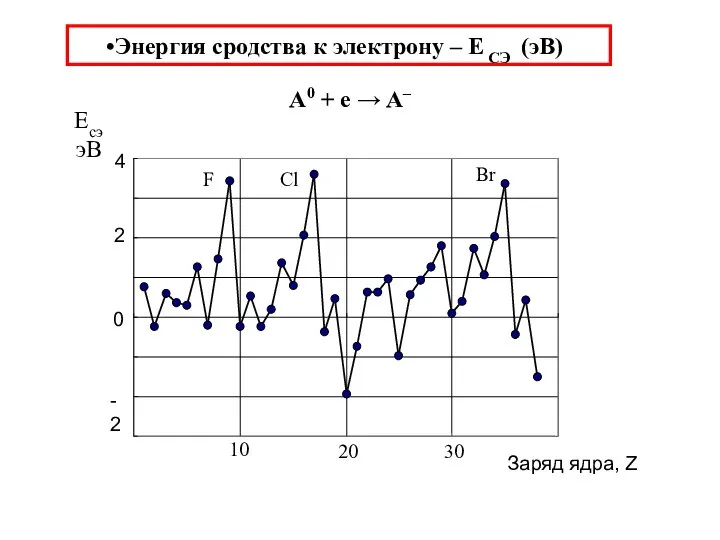
- 37. Энергия сродства к электрону – Е СЭ (эВ) A0 + e → A–
- 39. Скачать презентацию



![Корпускулярно-волновой дуализм свойств материи [проблема природы лучистой энергии - эл.магн.излучения(ЭМИ)] Электромагнитное](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/696979/slide-5.jpg)


![Принцип неопределенности [для микрочастиц(электрона)] Вернер Гейзенберг постулировал этот принцип в 1927](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/696979/slide-8.jpg)










![Квантово-механическая модель атома. Основное состояние атома водорода [k=1/4πε0] - константа в](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/696979/slide-19.jpg)












 Акриловые волокна
Акриловые волокна Химические реакции
Химические реакции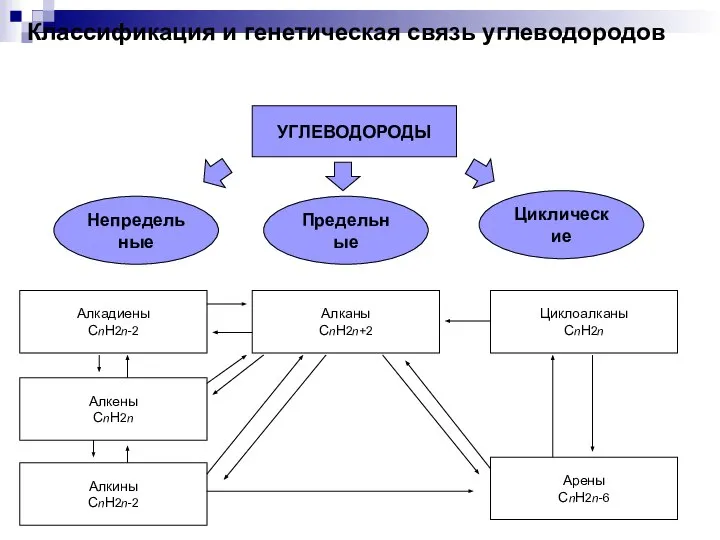 Классификация и генетическая связь углеводородов
Классификация и генетическая связь углеводородов Дипломная работа. Тема: Получение гальванических покрытий на основе цинка
Дипломная работа. Тема: Получение гальванических покрытий на основе цинка ПРИРОДНЫЕ И ПОПУТНЫЕ ГАЗЫ.
ПРИРОДНЫЕ И ПОПУТНЫЕ ГАЗЫ. Обзор основных методов исследования супрамолекулярных объектов
Обзор основных методов исследования супрамолекулярных объектов Каталитическая активность ферментов Работу выполнили: Кичаева Нина Иванькова Елена Ученицы 10 класса МОУ Сергиевской СОШ №1 «О
Каталитическая активность ферментов Работу выполнили: Кичаева Нина Иванькова Елена Ученицы 10 класса МОУ Сергиевской СОШ №1 «О Получение полимеров из низкомолекулярных соединений
Получение полимеров из низкомолекулярных соединений Карбон Характеристика елемента та утворених ним сполук, кругообіг елемента в природі
Карбон Характеристика елемента та утворених ним сполук, кругообіг елемента в природі  Химические формулы. Классы неорганических веществ. Урок №1
Химические формулы. Классы неорганических веществ. Урок №1 Геохимия урана и тория в карбонатитовом процессе
Геохимия урана и тория в карбонатитовом процессе Горение и медленное окисление. Тепловой эффект химической реакции
Горение и медленное окисление. Тепловой эффект химической реакции Галогены. Межгалогенные соединения
Галогены. Межгалогенные соединения Способы переработки нефти
Способы переработки нефти Свойство воды, устранение жесткости воды и очистка воды
Свойство воды, устранение жесткости воды и очистка воды 1. Взаємодія неметалів з металами: 1. Взаємодія неметалів з металами: а) Сu0 + Cl20 = Сu+2 Cl2-1 – купрум (ІІ) хлорид Сu0 – 2e-→ Сu+2 2 Cl20 + 2(1e-) → Cl2−1 2 б) Fe0 + Cl20 = Fe+3 Cl3-1 – ферум
1. Взаємодія неметалів з металами: 1. Взаємодія неметалів з металами: а) Сu0 + Cl20 = Сu+2 Cl2-1 – купрум (ІІ) хлорид Сu0 – 2e-→ Сu+2 2 Cl20 + 2(1e-) → Cl2−1 2 б) Fe0 + Cl20 = Fe+3 Cl3-1 – ферум Изучение геохимических свойств редкоземельных элементов
Изучение геохимических свойств редкоземельных элементов Physics and chemistry of surface phenomena
Physics and chemistry of surface phenomena Классы неорганических веществ. Оксиды. Кислоты
Классы неорганических веществ. Оксиды. Кислоты Строение атома
Строение атома Значение органической химии в жизни людей
Значение органической химии в жизни людей Химическая посуда
Химическая посуда Технология коллоидов и наносистем. Лекция 4. Физико-химические основы нуклеации и технологии формирования новой фазы
Технология коллоидов и наносистем. Лекция 4. Физико-химические основы нуклеации и технологии формирования новой фазы Химический эквивалент. Значение растворов в жизнедеятельности организмов. Способы выражения состава растворов
Химический эквивалент. Значение растворов в жизнедеятельности организмов. Способы выражения состава растворов Буферные системы
Буферные системы Классификация углеводов. Глюкоза
Классификация углеводов. Глюкоза Водород- зеленое топливо
Водород- зеленое топливо Химические компоненты животной клетки
Химические компоненты животной клетки