Содержание
- 2. 4. Химия сверхкритических жидкостей Целями данного семинара являются: Ознакомление со свойствами сверхкритических флюидов (СКФ) Отработки навыков
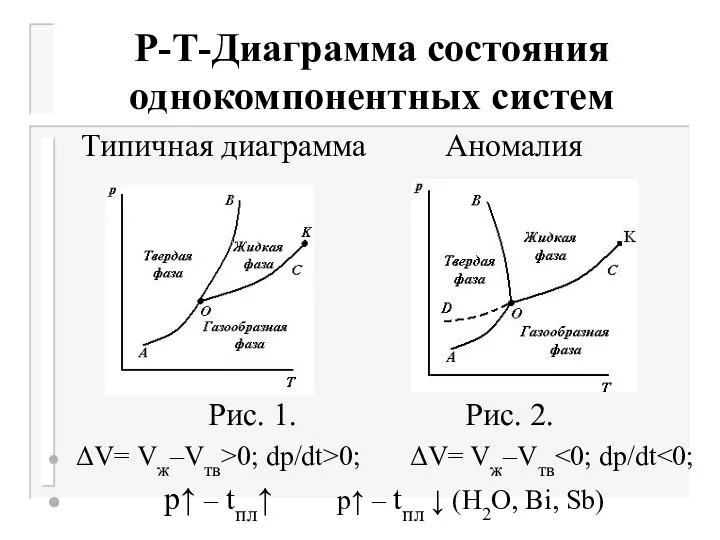
- 3. Р-Т-Диаграмма состояния однокомпонентных систем Типичная диаграмма Аномалия Рис. 1. Рис. 2. ΔV= Vж–Vтв>0; dp/dt>0; ΔV= Vж–Vтв
- 4. Р-Т-Диаграмма состояния однокомпонентных систем 1. Для большинства веществ для кривой плавления ОВ dp/dt>0 и при повышении
- 5. Р-Т-Диаграмма состояния однокомпонентных систем 2. В случае веществ, для которых характерна диаграмма, представленная на рис. 2
- 6. Р-Т-Диаграмма состояния однокомпонентных систем Задание 1. Объясните, почему при замерзании воды происходит увеличение объёма. Что представляет
- 7. Р-Т-Диаграмма состояния однокомпонентных систем Задание 1. Объясните, почему при замерзании воды происходит увеличение объёма. Что представляет
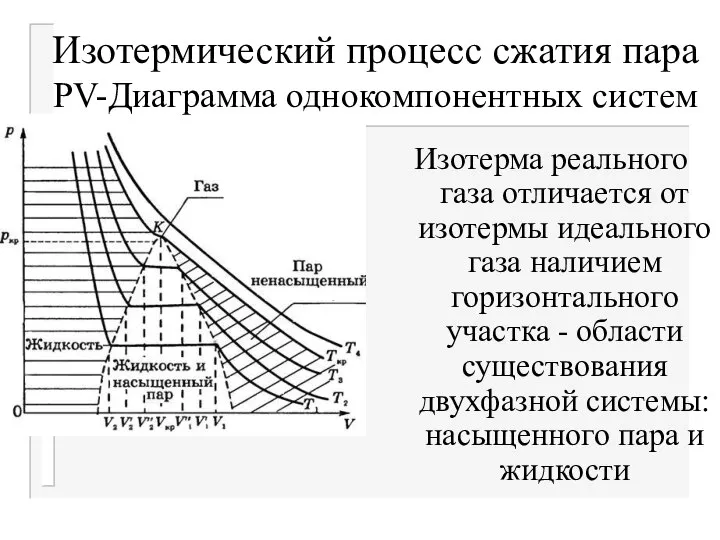
- 8. Изотермический процесс сжатия пара РV-Диаграмма однокомпонентных систем Изотерма реального газа отличается от изотермы идеального газа наличием
- 9. РV-Диаграмма состояния однокомпонентных систем Задание 2. Объясните, как при повышении температуры изменяется объём, при котором начинается
- 10. РV-Диаграмма состояния однокомпонентных систем Задание 2. Объясните, как при повышении температуры изменяется объём, при котором начинается
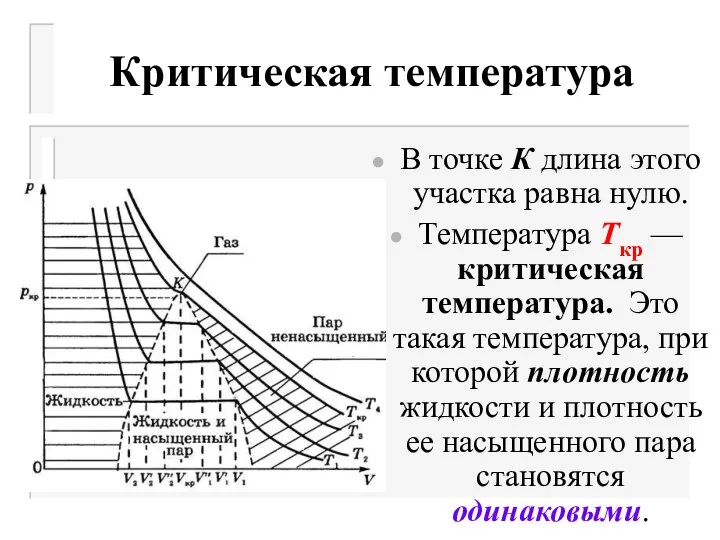
- 11. Критическая температура В точке К длина этого участка равна нулю. Температура Tкр — критическая температура. Это
- 12. Критические параметры Давление насыщенного пара какого-либо вещества при его критической температуре называется критическим давлением Ркр. Оно
- 13. 4.2. Критическое состояние Критическая точка — сочетание значений температуры и давления (или температуры и молярного объема
- 14. В окрестностях Ткр. наблюдаются следующие критические явления: Плотность жидкости равна плотности пара, Поверхностное натяжение жидкости падает
- 15. Критические параметры
- 16. Критические параметры
- 17. Критические параметры Задание 3. Как изменяется молярный объём жидкости при повышении температуры? Что такое критический молярный
- 18. Критические параметры Задание 3. Как изменяется молярный объём жидкости при повышении температуры? Что такое критический молярный
- 19. Оценка критических параметров Для 1 моля идеального газа PV/RT=1. Параметры всегда можно подсчитать. Для оценки критических
- 20. Молярный объем растворителя Vм 1-вода, 2-метанол, 3-ацетонитрил (СН3СN), 4-этанол, 5-ацетон (СН3)2CO, 6-пропанол, 7-бутанол, 8-амиловый спирт
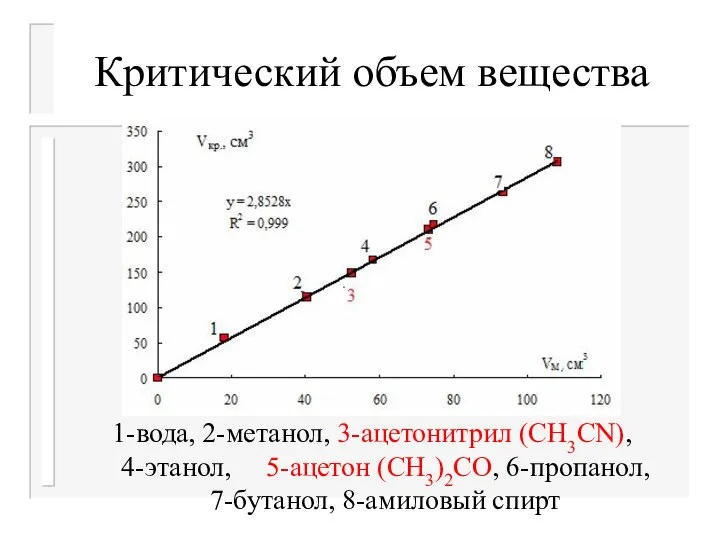
- 21. Критический объем вещества 1-вода, 2-метанол, 3-ацетонитрил (СН3СN), 4-этанол, 5-ацетон (СН3)2CO, 6-пропанол, 7-бутанол, 8-амиловый спирт
- 22. Критический объем вещества 1-вода, 2-метанол, 3-ацетонитрил (СН3СN), 4-этанол, 5-ацетон (СН3)2CO, 6-пропанол, 7-бутанол, 8-амиловый спирт
- 23. Критический объем вещества Если зависимость молярного объема Vм от молярной массы М описывается уравнением Vм= 1,25
- 24. Критические параметры Задание 4. Критический молярный объём Vкр жидкости можно оценить исходя из её молярной массы.
- 25. Критические параметры Задание 4. Критический молярный объём Vм жидкости можно оценить исходя из её молярной массы.
- 26. Оценка критических параметров
- 27. Оценка критических параметров
- 28. Оценка критических параметров Задание 5. Критические параметры пропена: Ркр.=45 атм., а Vкр=180 см3. Оцените критическую температуру
- 29. Оценка критических параметров Задание 5. Критические параметры пропена: Ркр.=45,6 атм., а Vкр=181 см3. Оцените критическую температуру
- 30. Оценка критических параметров Задание 6. Плотность находящегося в критическом состоянии пропанола равна 0,2727 г/cм3, а критическая
- 31. Оценка критических параметров Задание 6. Плотность находящегося в критическом состоянии пропанола равна 0,2727 г/cм3, а критическая
- 32. Vкр = 3,56 М , а Ркр, Ткр ? Для кислородсодержащих органических соединений (спирты, альдегиды, кетоны)
- 33. Оценка критических параметров Задача 7. Критическая температура пропанола равна 264 оС. Оценить другие критические параметры этого
- 34. Оценка критических параметров Задача 7. Критическая температура пропанола равна 264 оС. Оценить другие критические параметры этого
- 35. Критическое состояние Следующий шаг Необходимо оценить расстояние между молекулами вещества dк и сравнить его с расстоянием
- 36. 1. Расстояние между молекулами в идеальном газе Идеальным газ при нормальных условиях и занимает объем Vо=22,4
- 37. 1. Расстояние между молекулами в идеальном газе Определим объем одного такого кубика (в котором находится одна
- 38. 1. Расстояние между молекулами в идеальном газе Считая, что молекулы газа находятся в центрах кубиков, получаем
- 39. 2. Расстояние между молекулами в жидкой фазе 2.1. Вода В результате конденсации пара 1 моль воды
- 40. 2. Расстояние между молекулами воды в жидкой фазе «Ребро куба» d d =(V(Н2О))1/3 =3,11∙10–10 м=3,11 Ǻ.
- 41. 2. Расстояние между молекулами воды в жидкой фазе Молекула не занимает весь объем куба. Если шар
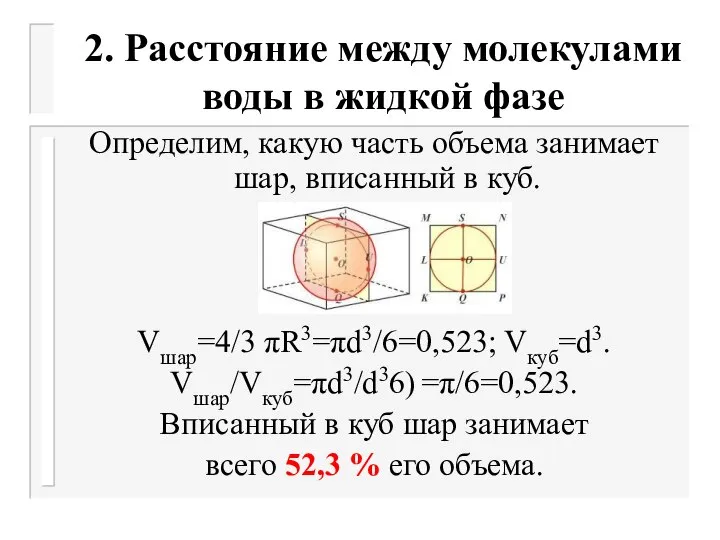
- 42. 2. Расстояние между молекулами воды в жидкой фазе Определим, какую часть объема занимает шар, вписанный в
- 43. 2. Расстояние между молекулами воды в жидкой фазе Для степени заполнения 52,3 % V(Н2О) будет равен
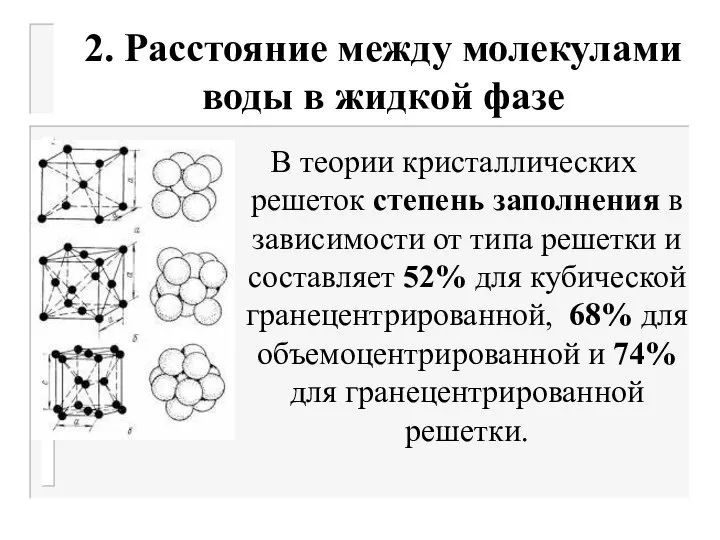
- 44. 2. Расстояние между молекулами воды в жидкой фазе В теории кристаллических решеток степень заполнения в зависимости
- 45. 2. Расстояние между молекулами воды в жидкой фазе Для гранецентрированной решетки: V(Н2О) =30∙10–30∙0,74=22,2∙10–30 м3 Тогда d
- 46. 2. Расстояние между молекулами в жидкой фазе В общем виде для молярного объема Vм V1=0,7Vм/Na= 0,7Vм/(6∙1023)=
- 47. 2. Расстояние между молекулами в жидкой фазе (V=0,7Vкуб) Поступая аналогичным образом получаем: Растворитель М, г/моль Vм,
- 48. 3. Критическое состояние. Расстояние между молекулами Расчет dкр. V1=Vкр/Na= Vкр/(6∙1023)=1,66∙10-24Vкр см3 d=(1,66∙10-24Vкр)1/3=1,184(Vкр)1/3 см Вода: Vкр= 55,9
- 49. 3. Критическое состояние. Расстояние между молекулами Для dкр =1,184 (Vкр)1/3 Растворитель М, г/моль Vкр, cм3 dкр,
- 50. Оценка критических параметров Задача 8. Молярный объём пропанола равен 74,6 см3, а критический объём – 220
- 51. Оценка критических параметров Задача 8. Молярный объём пропанола равен 74,6 см3, а критический объём пропанола равен
- 53. Скачать презентацию












































 Гидрокрекинг нефтяного сырья
Гидрокрекинг нефтяного сырья Презентация Алкины Ацетилен
Презентация Алкины Ацетилен Застосування вуглеводів. Їх біологічна роль
Застосування вуглеводів. Їх біологічна роль Аммиак NH3
Аммиак NH3 Лаборатория мирового уровня в области термического анализа и физико-химии процессов тепловых методов добычи
Лаборатория мирового уровня в области термического анализа и физико-химии процессов тепловых методов добычи Классическая теория гармонического кристалла. Гармоническое приближение. Адиабатическое приближение
Классическая теория гармонического кристалла. Гармоническое приближение. Адиабатическое приближение Великий Ломоносов Работу выполнила учитель химии МБОУ «СОШ №27 с углубленным изучением отдельных предметов» Карташова Л.А.
Великий Ломоносов Работу выполнила учитель химии МБОУ «СОШ №27 с углубленным изучением отдельных предметов» Карташова Л.А. Вакуумная перегонка мазута
Вакуумная перегонка мазута Подгруппа селена
Подгруппа селена Электрические свойства дисперсных систем. (Лекция 5)
Электрические свойства дисперсных систем. (Лекция 5) Автомобильные бензины и дизельное топливо
Автомобильные бензины и дизельное топливо Обобщающее повторение по теме Неметаллы. Урок №7
Обобщающее повторение по теме Неметаллы. Урок №7 Полярография және оның фармацияда қолданылуы
Полярография және оның фармацияда қолданылуы Эмульсиялардың тұрақтылығына полиэтиленгликоль-баз композицияларының әсері
Эмульсиялардың тұрақтылығына полиэтиленгликоль-баз композицияларының әсері Полімери
Полімери  Тест- тренажер по теме: Основные классы неорганических веществ «Оксиды»
Тест- тренажер по теме: Основные классы неорганических веществ «Оксиды» Периодическая Система Д. И. Менделеева в свете учения о строении атома
Периодическая Система Д. И. Менделеева в свете учения о строении атома Счастливы вместе с химией
Счастливы вместе с химией Тема урока: Сложные эфиры.
Тема урока: Сложные эфиры. Применение s-, p-, d- элементов в медицине
Применение s-, p-, d- элементов в медицине Валентність
Валентність  Реологические свойства полимерных материалов
Реологические свойства полимерных материалов Кислородосодержащие органические соединения (2 часть) Муравьева Н.А. – учитель химии МОУ «Арбузовская сош»
Кислородосодержащие органические соединения (2 часть) Муравьева Н.А. – учитель химии МОУ «Арбузовская сош»  «Химия и цвет» Интегрированный урок по изобразительному искусству и химии Запольская О.А. Учитель МКОУ СОШ №1 п.Сосьва
«Химия и цвет» Интегрированный урок по изобразительному искусству и химии Запольская О.А. Учитель МКОУ СОШ №1 п.Сосьва Микрофлора и биохимические реакции подземных вод
Микрофлора и биохимические реакции подземных вод Номенклатура органических соединений
Номенклатура органических соединений Силікон Корєшкова А. В. 11-М
Силікон Корєшкова А. В. 11-М  Становление органической химии как отдельной науки. (Модуль 1)
Становление органической химии как отдельной науки. (Модуль 1)