Содержание
- 2. Становление органической химии как отдельной науки 1 1. Длинные углерод-углеродные цепи 2. Изомерия
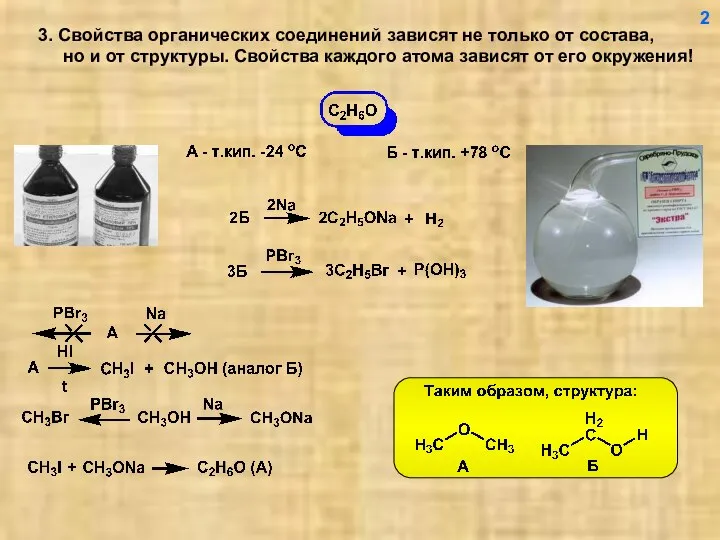
- 3. 3. Свойства органических соединений зависят не только от состава, но и от структуры. Свойства каждого атома
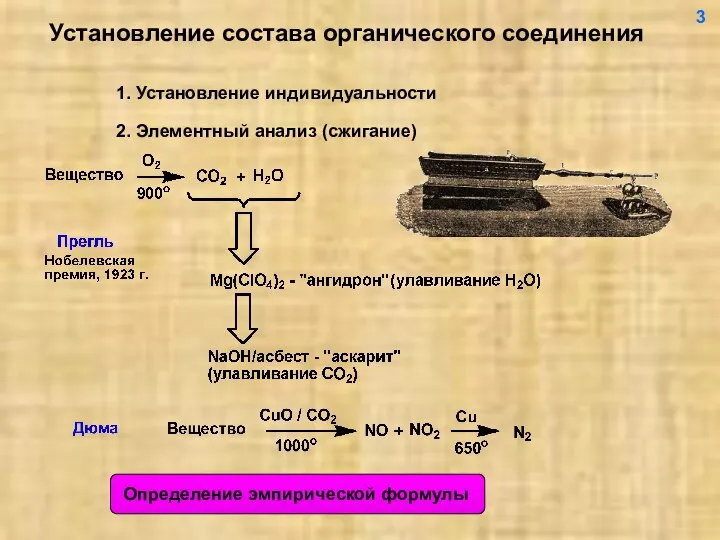
- 4. Установление состава органического соединения 1. Установление индивидуальности 2. Элементный анализ (сжигание) 3
- 5. 3. Определение молекулярной массы (эбулиоскопия или криоскопия) 4
- 6. От атомов к молекулам Химическая связь Необходимое (но недостаточное!) условие образования связи – наличие двух электронов
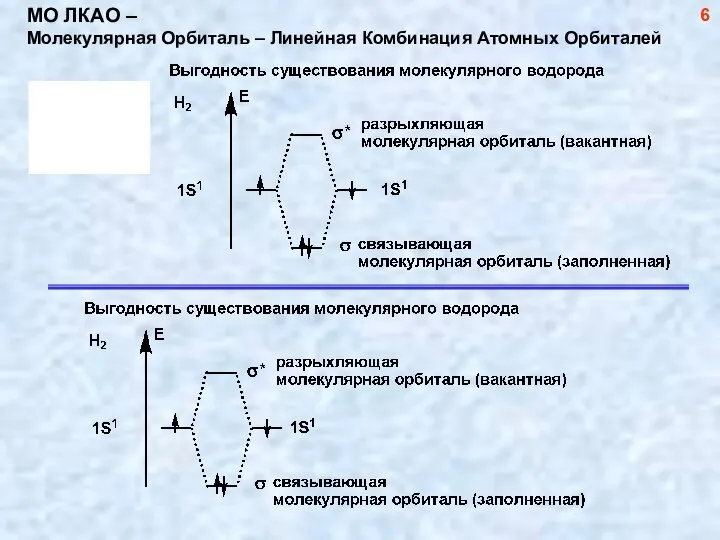
- 7. МО ЛКАО – Молекулярная Орбиталь – Линейная Комбинация Атомных Орбиталей 6
- 8. Строение молекулярного кислорода 7
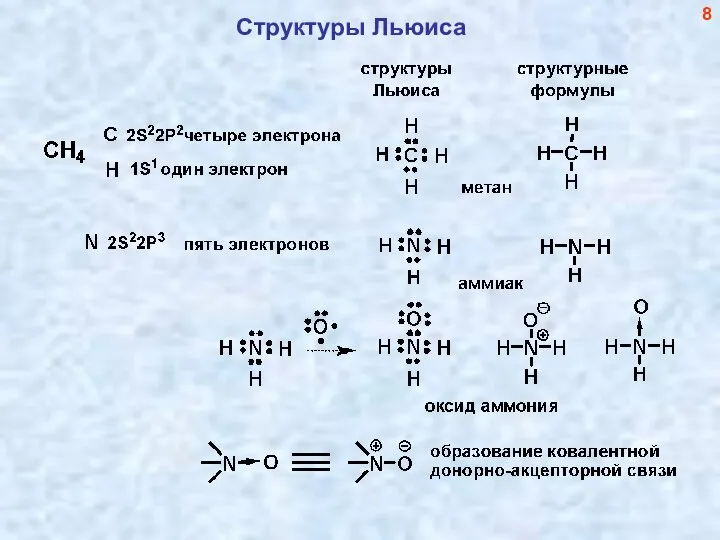
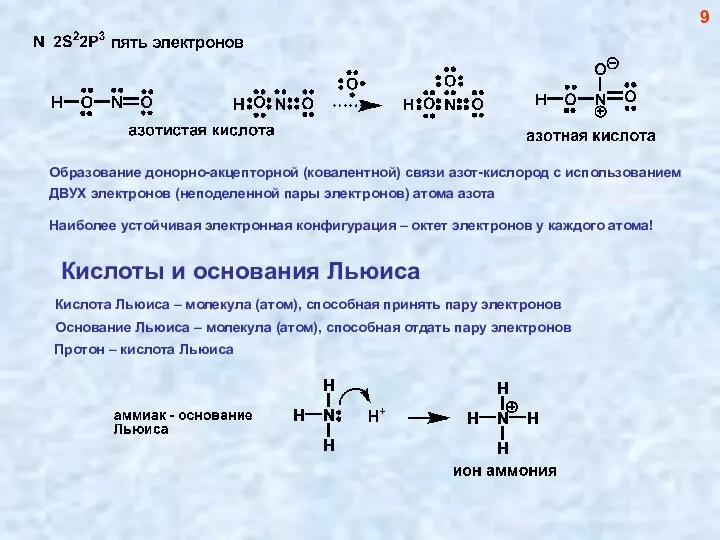
- 9. Структуры Льюиса 8
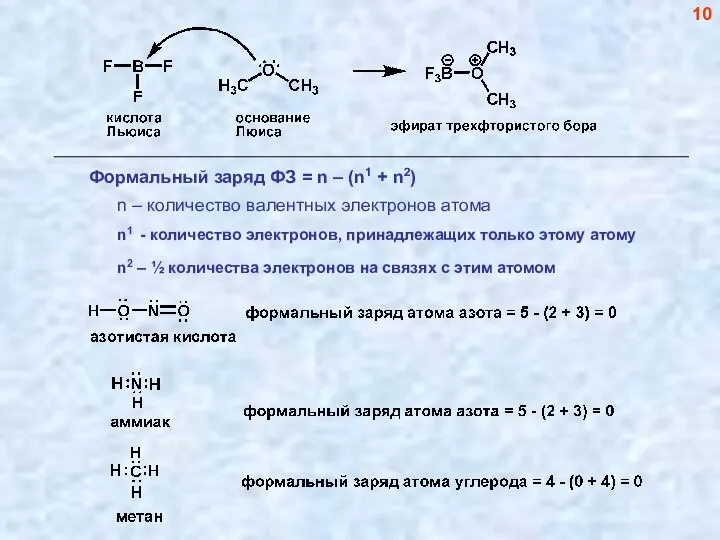
- 10. Образование донорно-акцепторной (ковалентной) связи азот-кислород с использованием ДВУХ электронов (неподеленной пары электронов) атома азота Наиболее устойчивая
- 11. 10
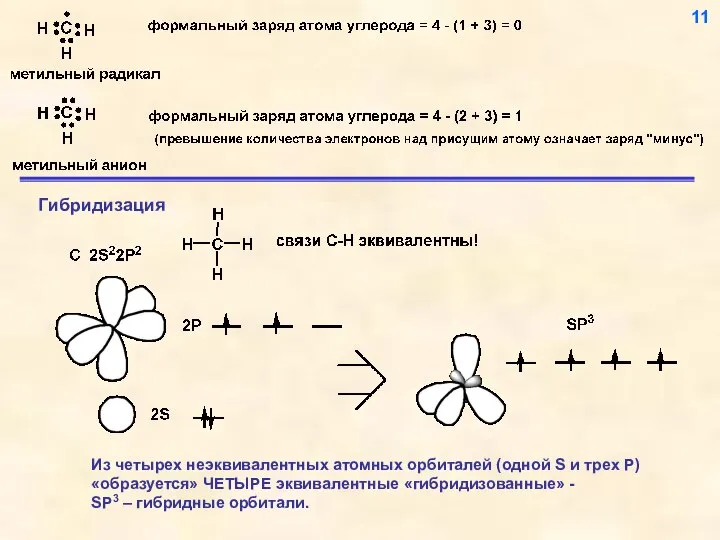
- 12. 11
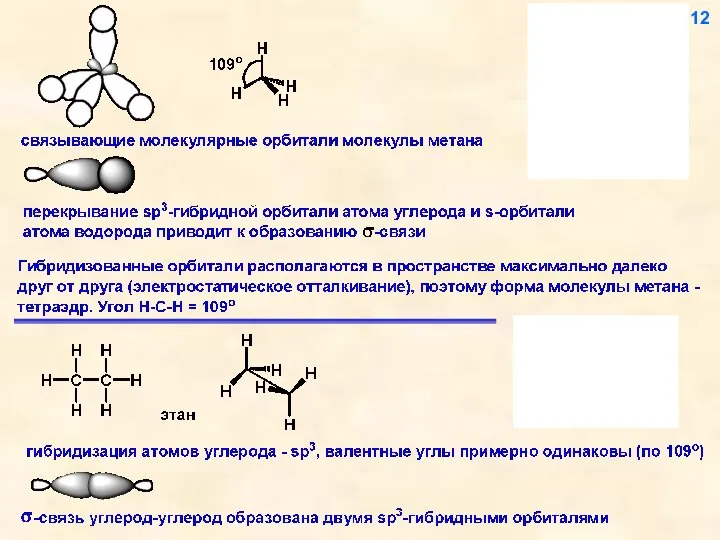
- 13. 12
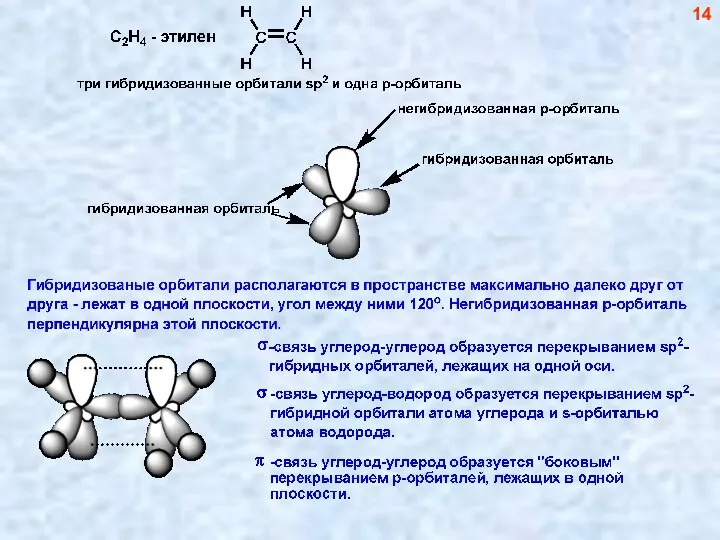
- 14. 13
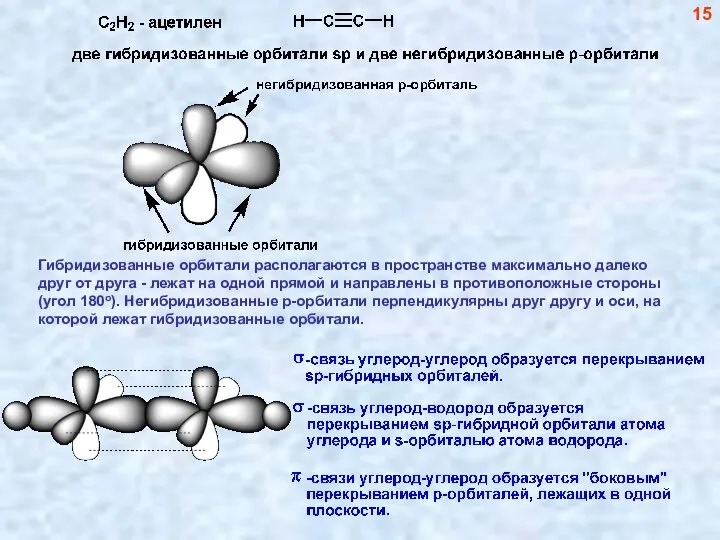
- 15. 14
- 16. Гибридизованные орбитали располагаются в пространстве максимально далеко друг от друга - лежат на одной прямой и
- 17. Распределение заряда в молекуле 1. Индуктивный эффект 16
- 18. 2. Мезомерный эффект, теория резонанса 17
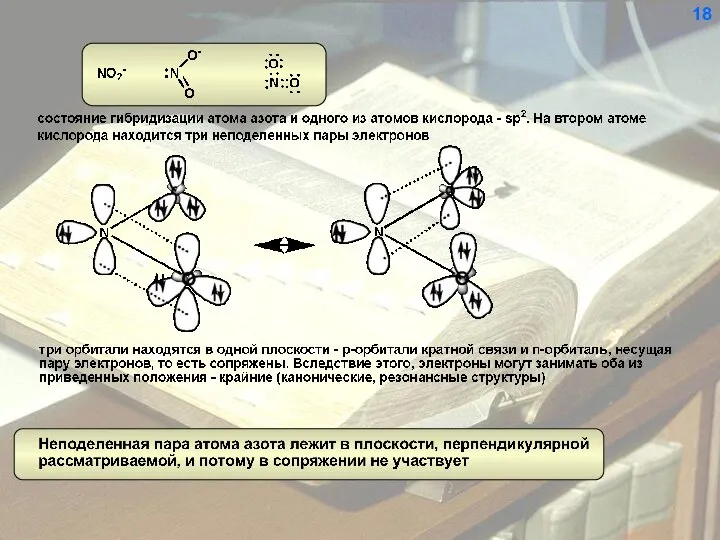
- 19. 18
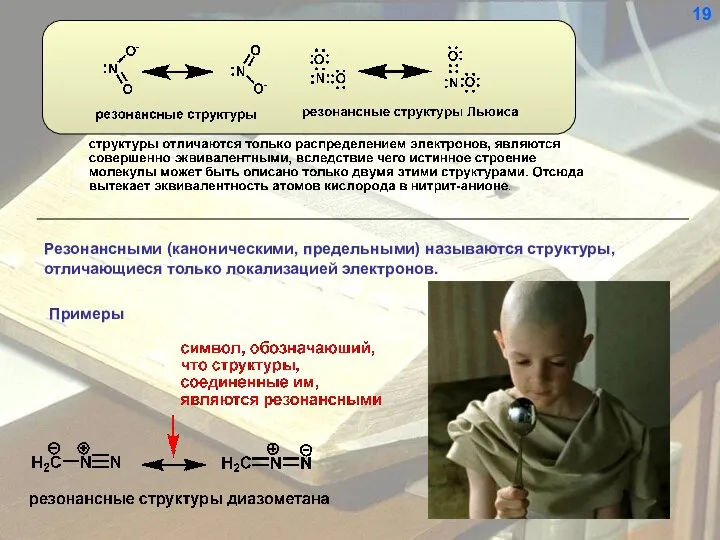
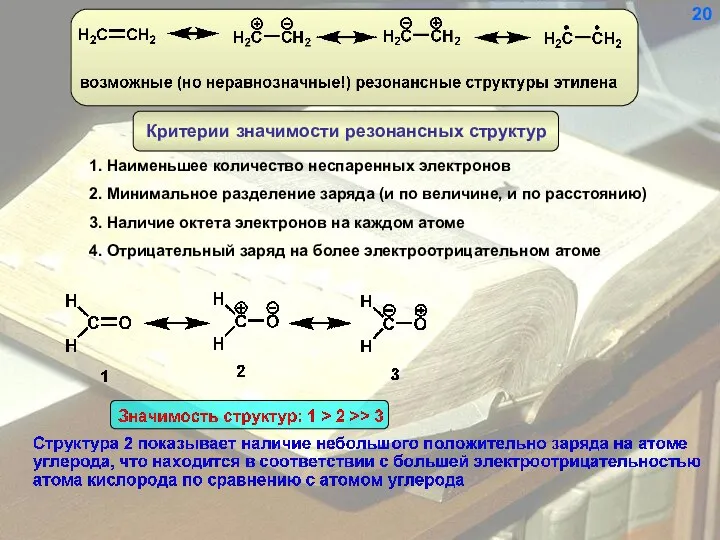
- 20. Резонансными (каноническими, предельными) называются структуры, отличающиеся только локализацией электронов. 19
- 21. 1. Наименьшее количество неспаренных электронов 2. Минимальное разделение заряда (и по величине, и по расстоянию) 3.
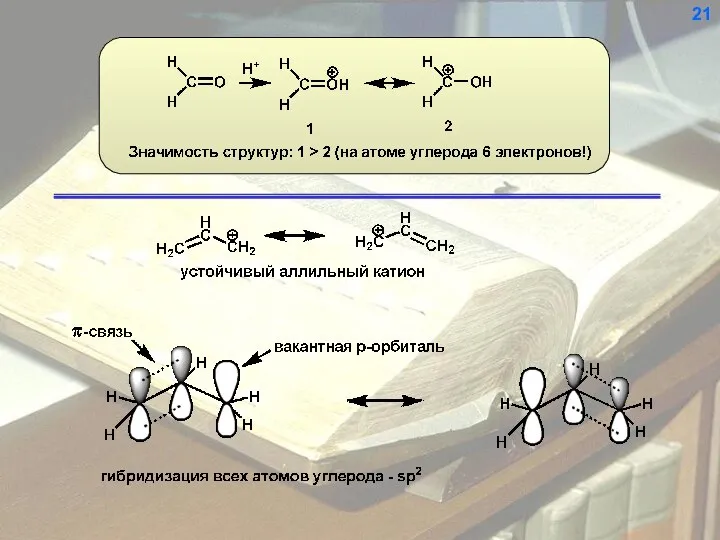
- 22. 21
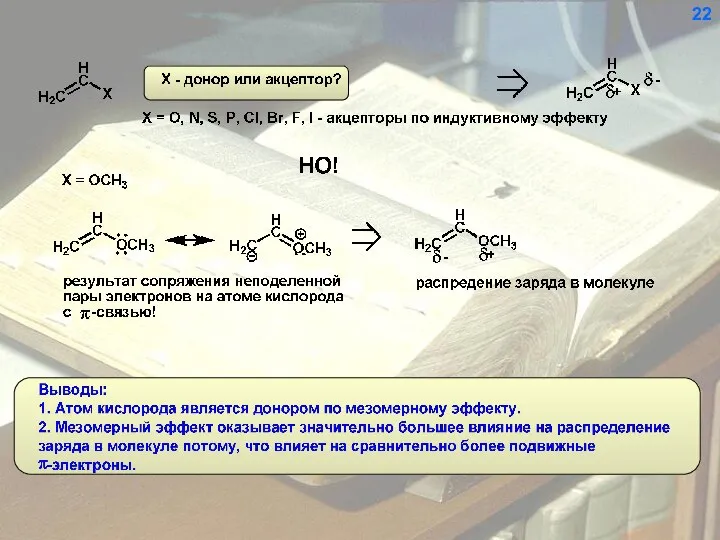
- 23. 22
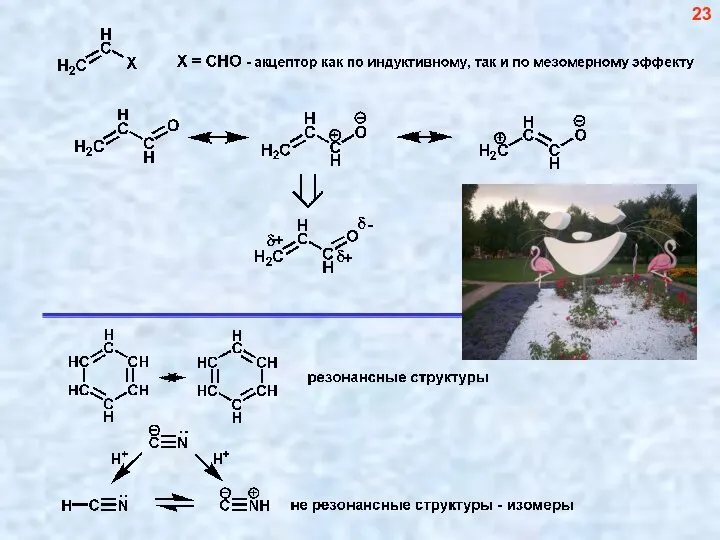
- 24. 23
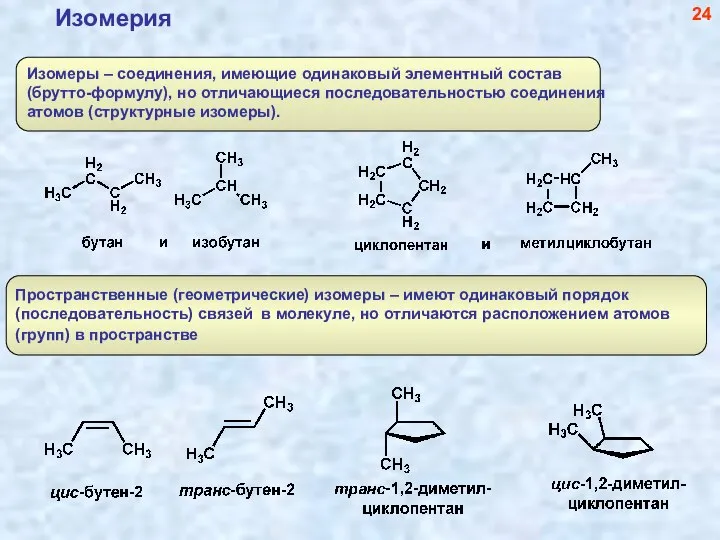
- 25. Изомерия 24
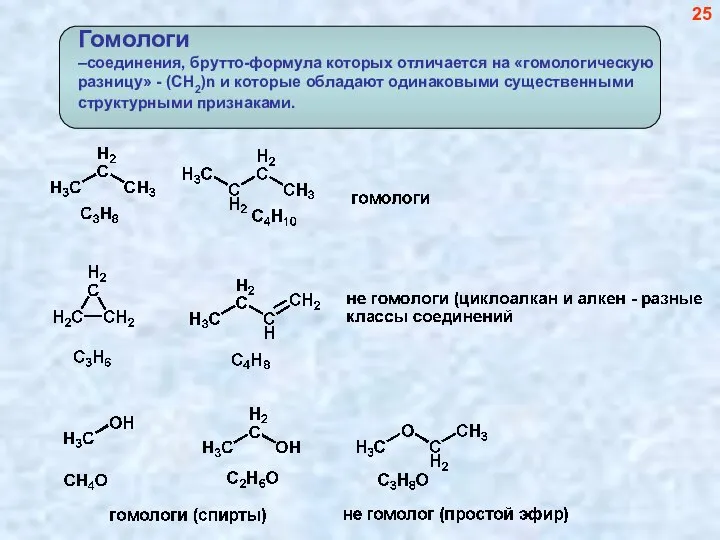
- 26. 25
- 27. Энантиомеры – зеркальные антиподы, несовпадающие друг с другом 26
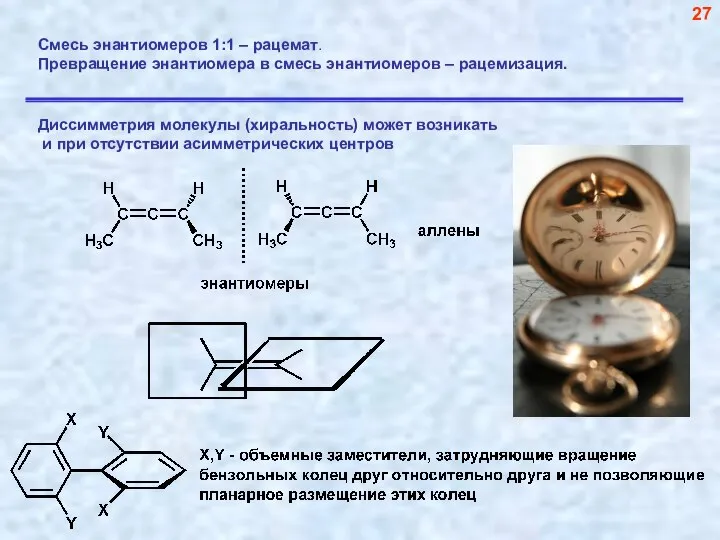
- 28. Смесь энантиомеров 1:1 – рацемат. Превращение энантиомера в смесь энантиомеров – рацемизация. 27
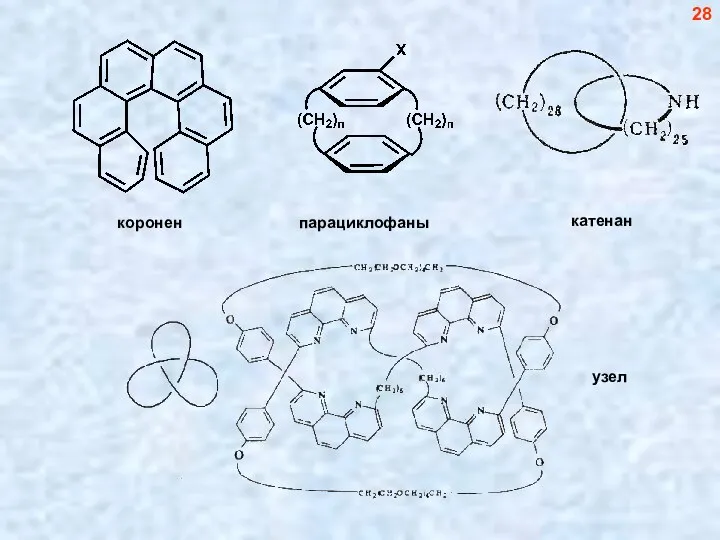
- 29. коронен парациклофаны катенан узел 28
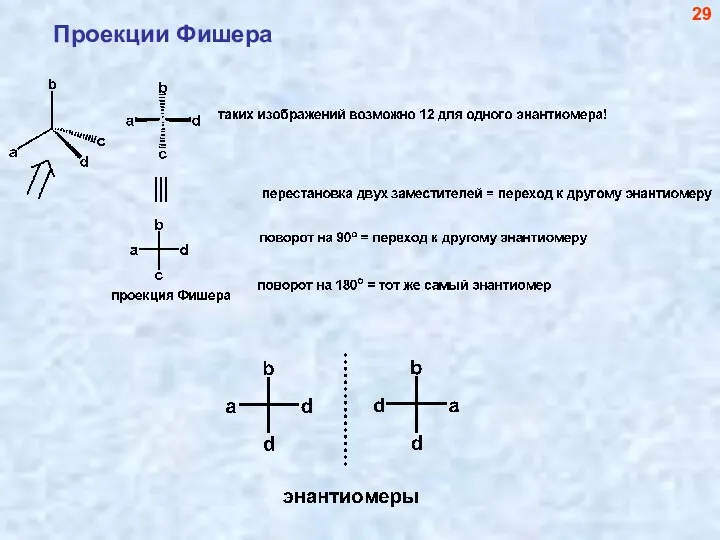
- 30. Проекции Фишера 29
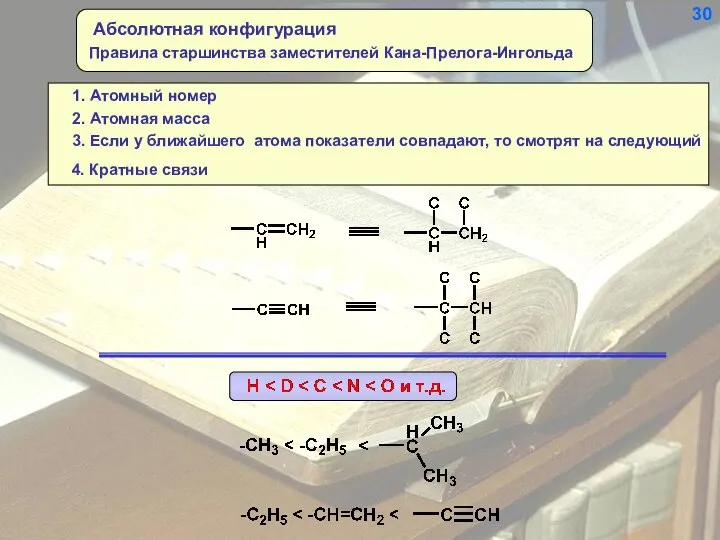
- 31. 2. Атомная масса 3. Если у ближайшего атома показатели совпадают, то смотрят на следующий 4. Кратные
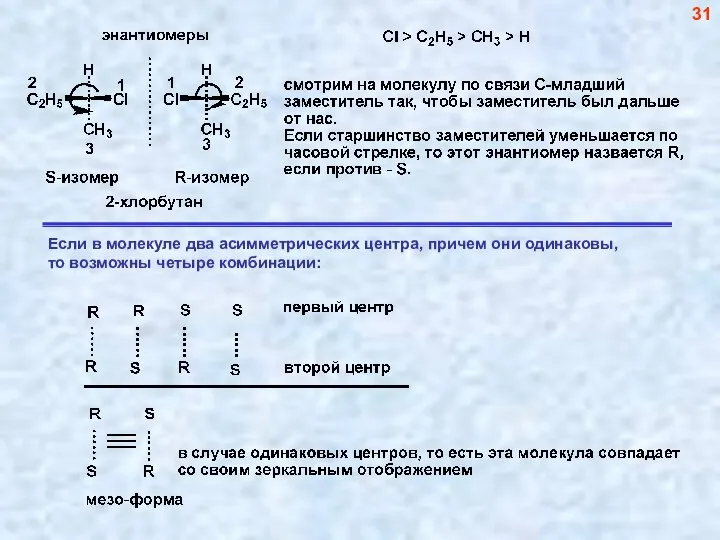
- 32. 31
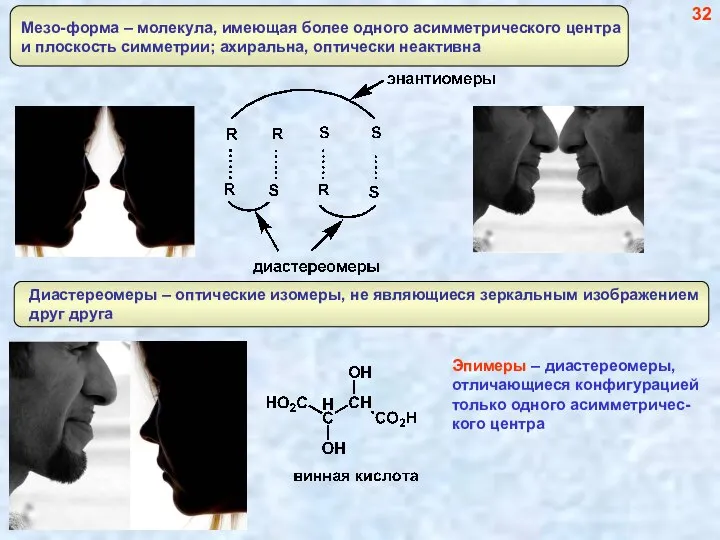
- 33. 32 Эпимеры – диастереомеры, отличающиеся конфигурацией только одного асимметричес- кого центра
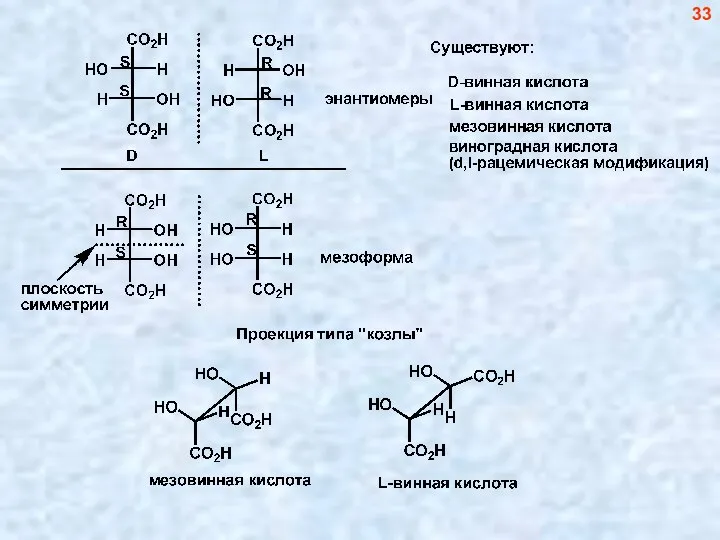
- 34. 33
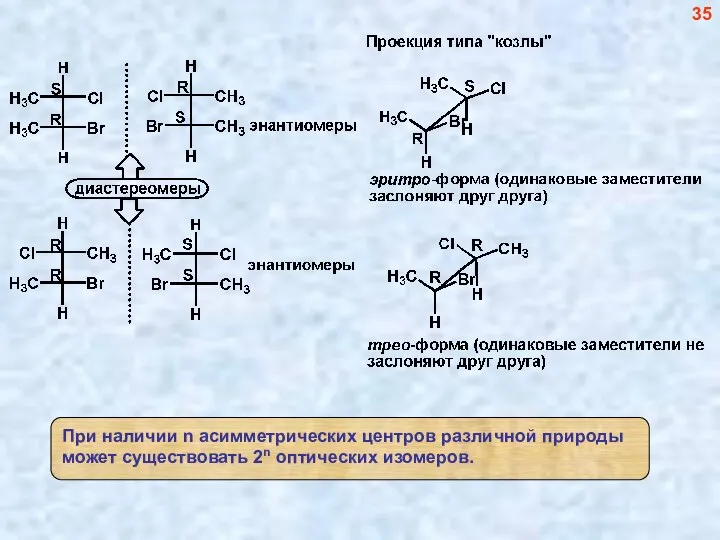
- 35. Существует две диастереомерных пары, состоящих из энантиомеров – всего четыре оптических изомера 34
- 36. 35
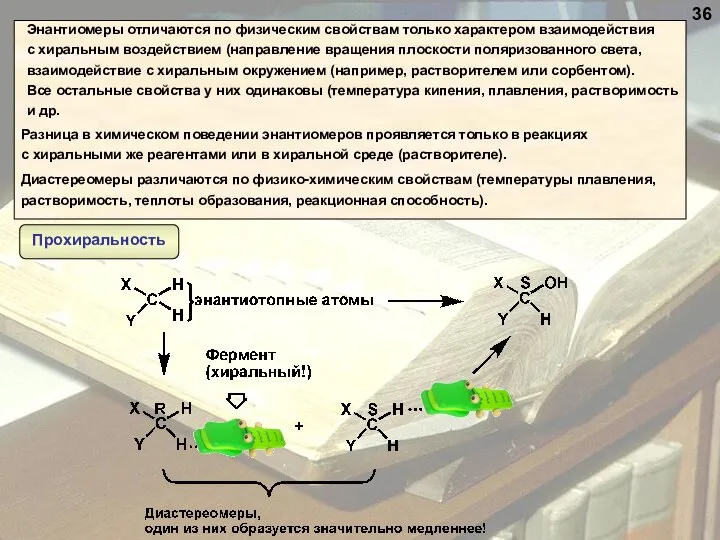
- 37. Разница в химическом поведении энантиомеров проявляется только в реакциях с хиральными же реагентами или в хиральной
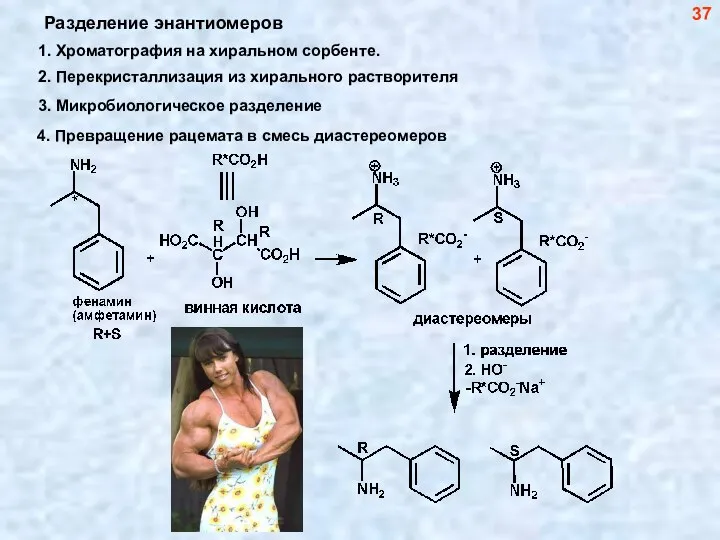
- 38. Разделение энантиомеров 37
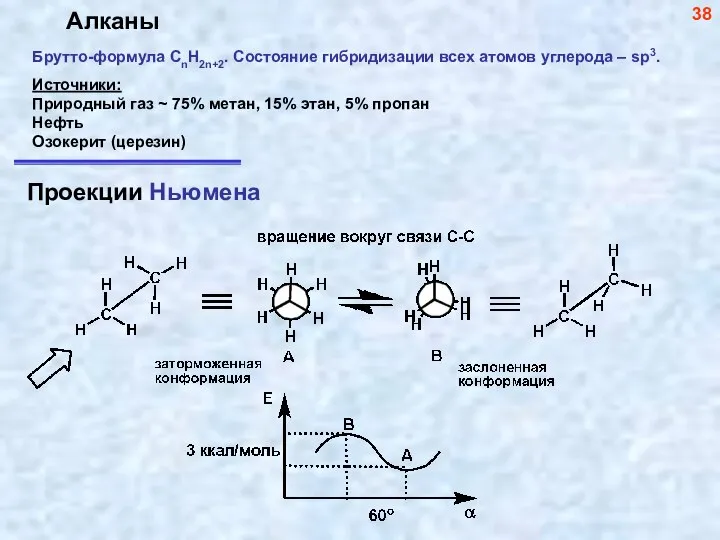
- 39. Алканы Источники: Природный газ ~ 75% метан, 15% этан, 5% пропан Нефть Озокерит (церезин) Брутто-формула СnH2n+2.
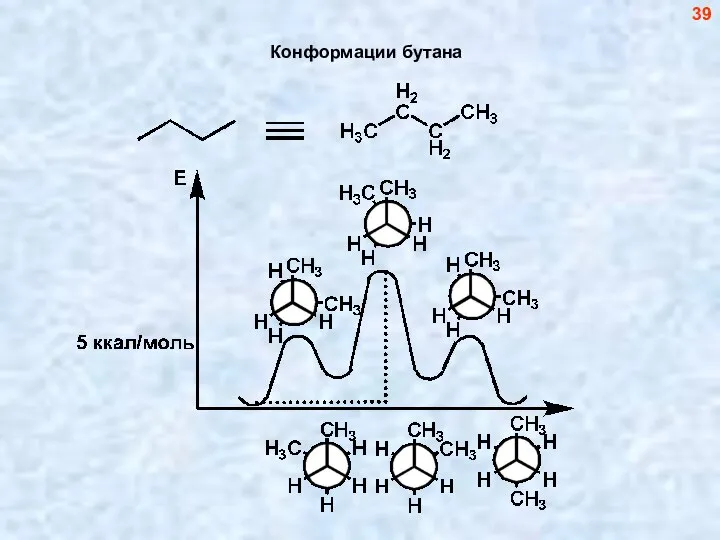
- 40. Конформации бутана 39
- 41. Методы синтеза алканов 1. Ректификация газа и нефти 40
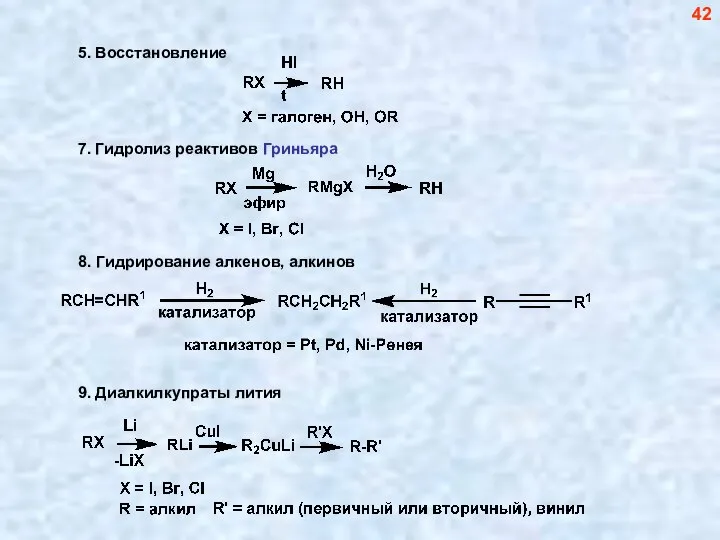
- 42. Лабораторные методы синтеза алканов 41
- 43. 42
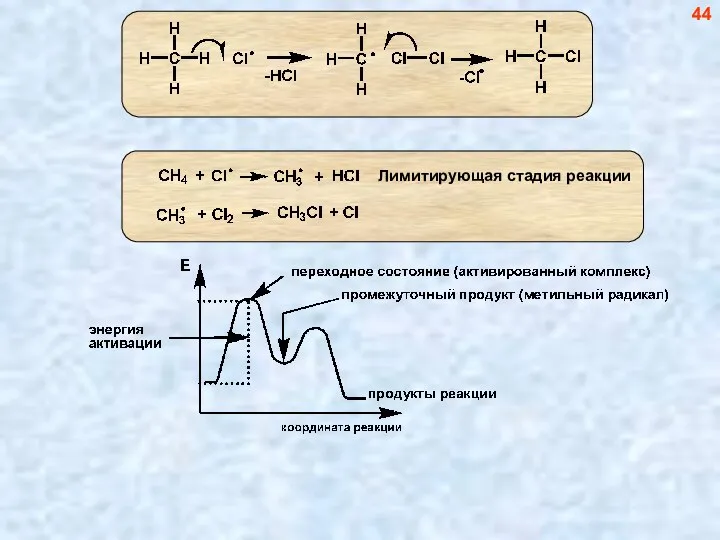
- 44. Свойства алканов 43
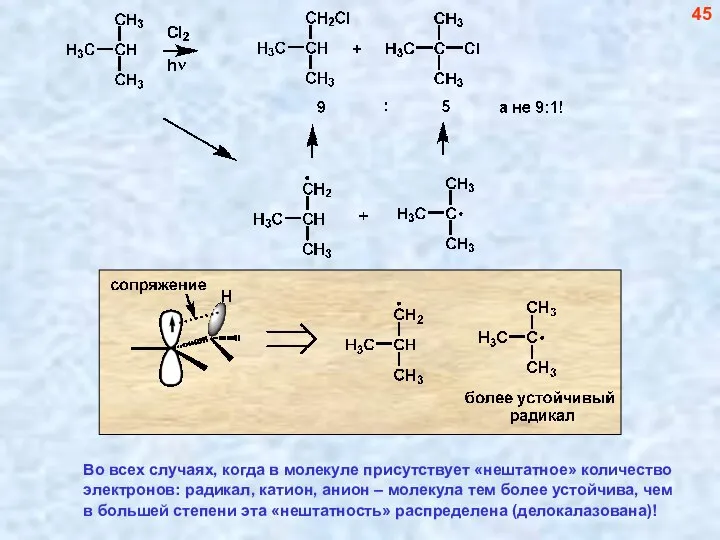
- 45. 44
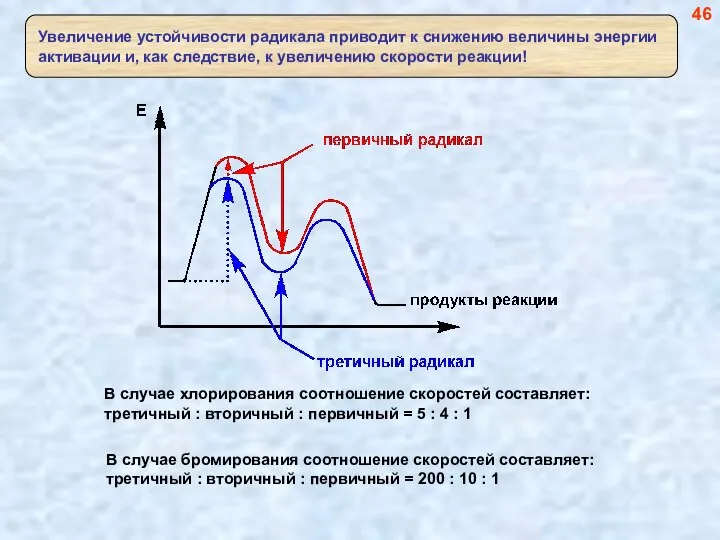
- 46. 45 Во всех случаях, когда в молекуле присутствует «нештатное» количество электронов: радикал, катион, анион – молекула
- 47. В случае хлорирования соотношение скоростей составляет: третичный : вторичный : первичный = 5 : 4 :
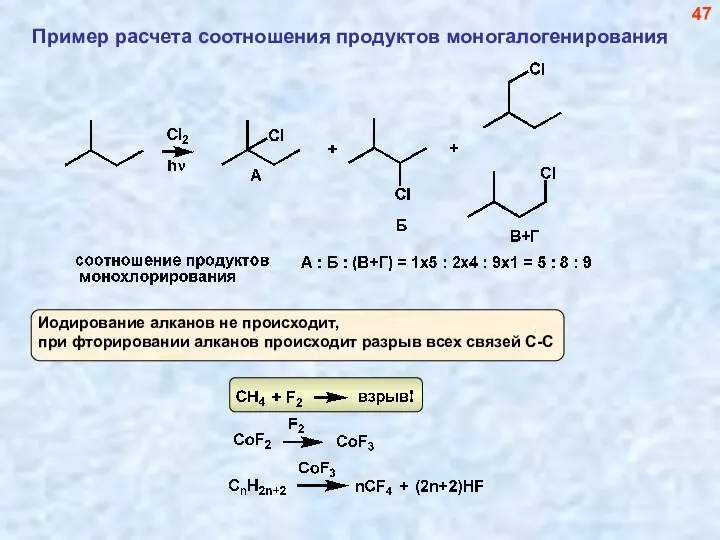
- 48. Пример расчета соотношения продуктов моногалогенирования 47
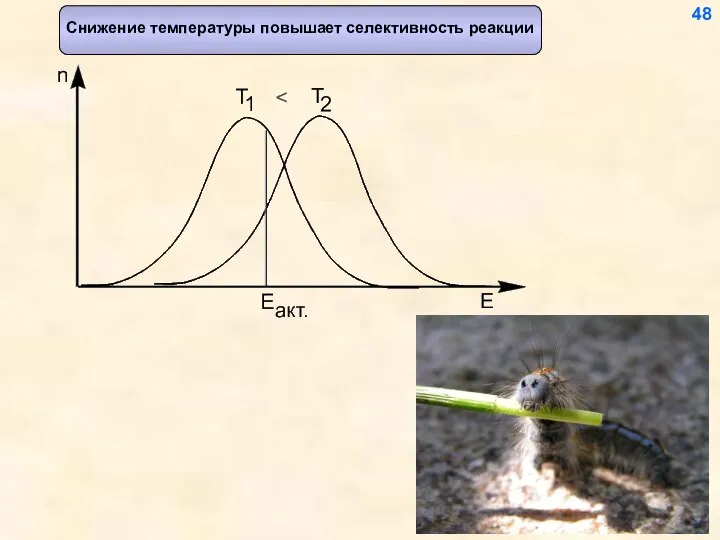
- 49. Снижение температуры повышает селективность реакции 48
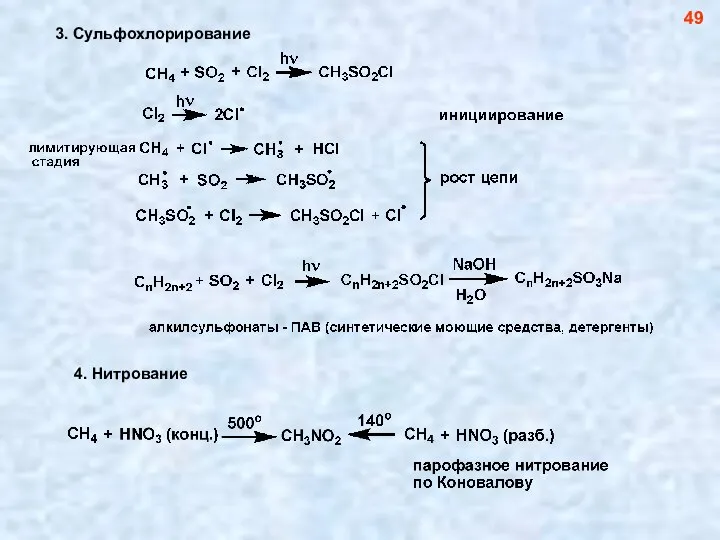
- 50. 3. Сульфохлорирование 49
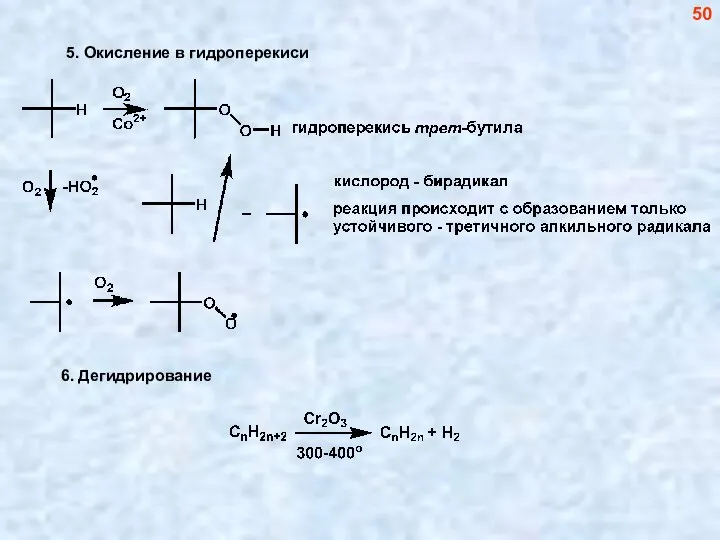
- 51. 5. Окисление в гидроперекиси 50
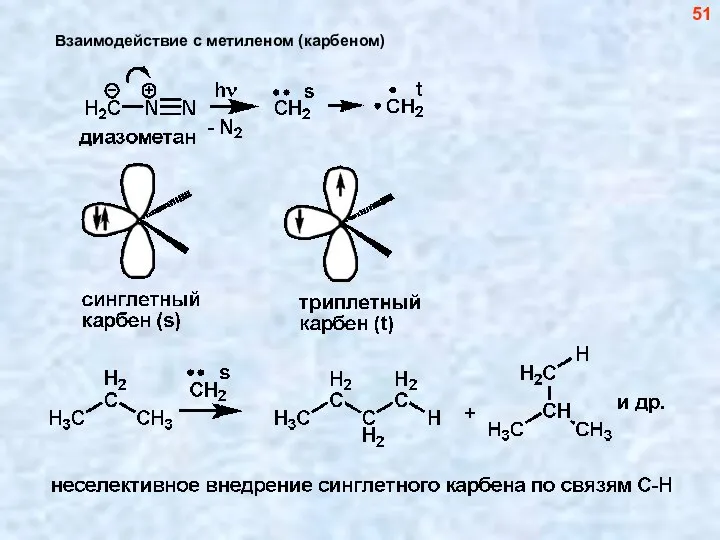
- 52. Взаимодействие с метиленом (карбеном) 51
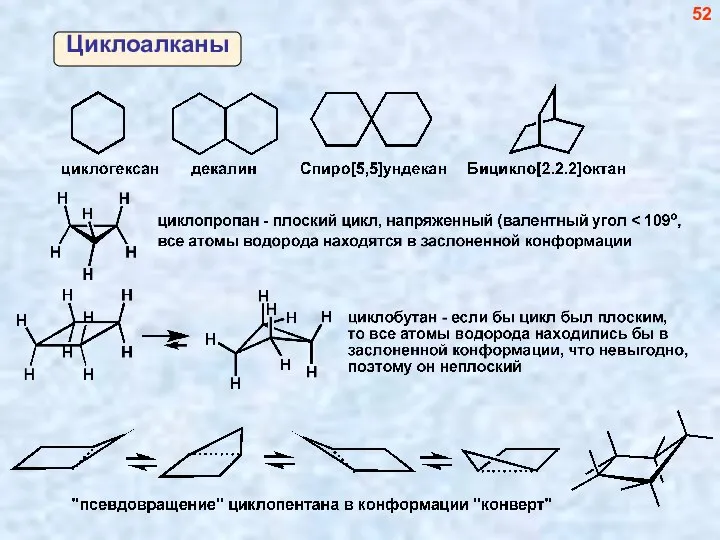
- 53. Циклоалканы 52
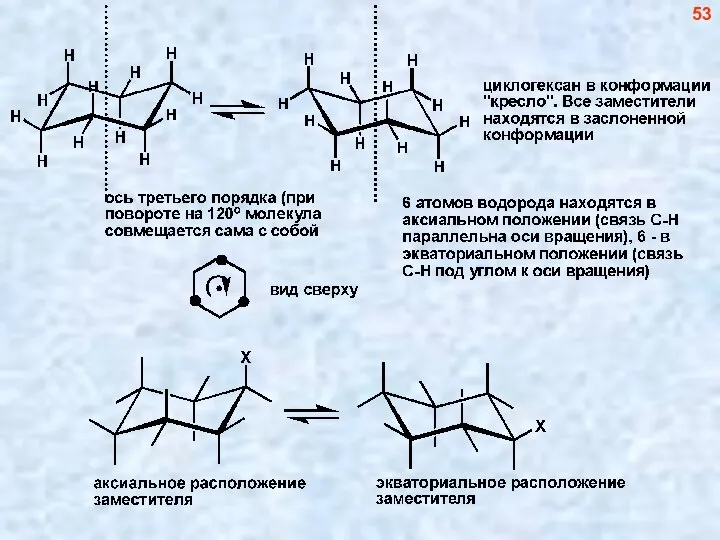
- 54. 53
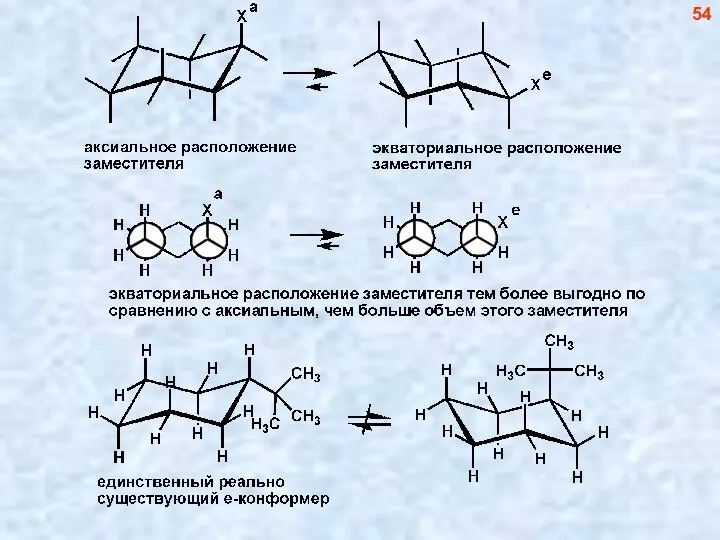
- 55. 54
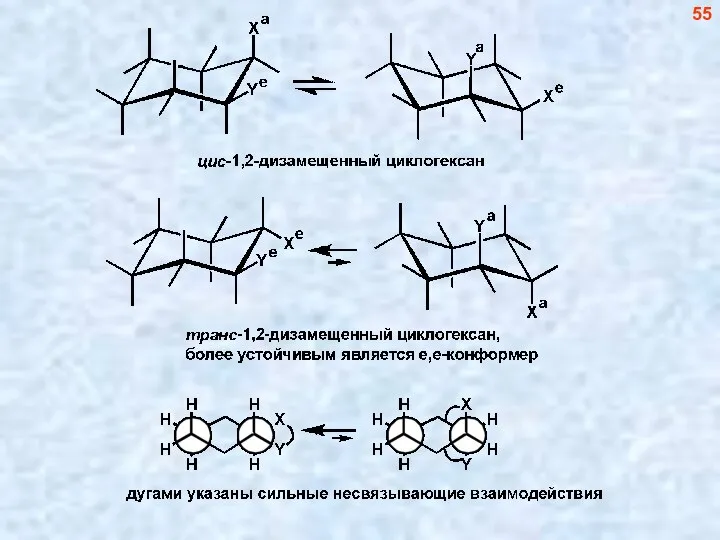
- 56. 55
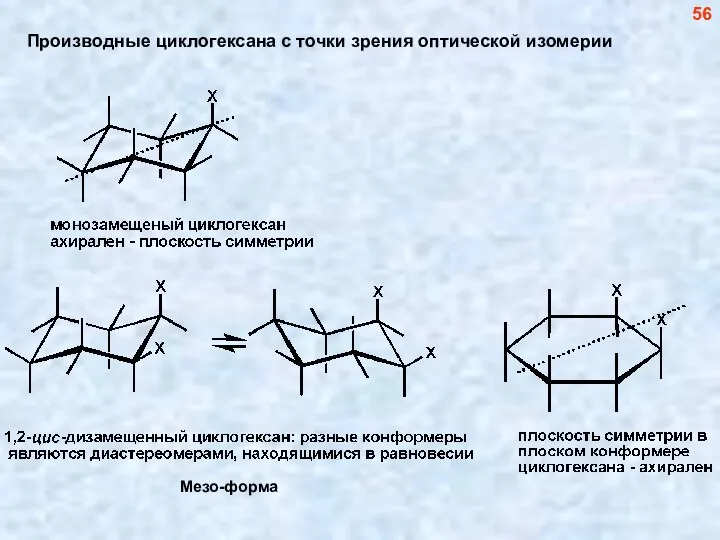
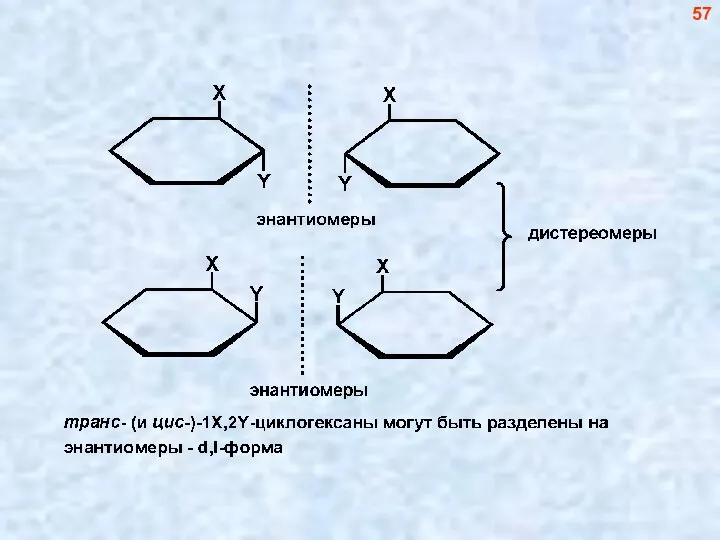
- 57. Производные циклогексана с точки зрения оптической изомерии Мезо-форма 56
- 58. 57
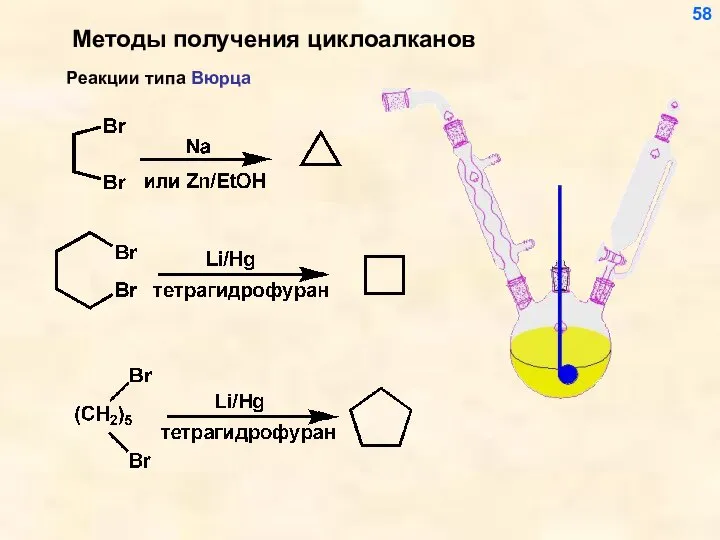
- 59. Методы получения циклоалканов 58
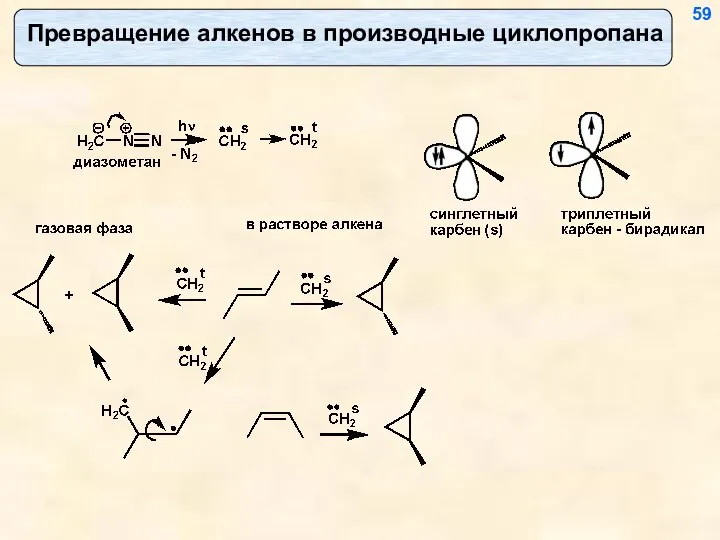
- 60. 59
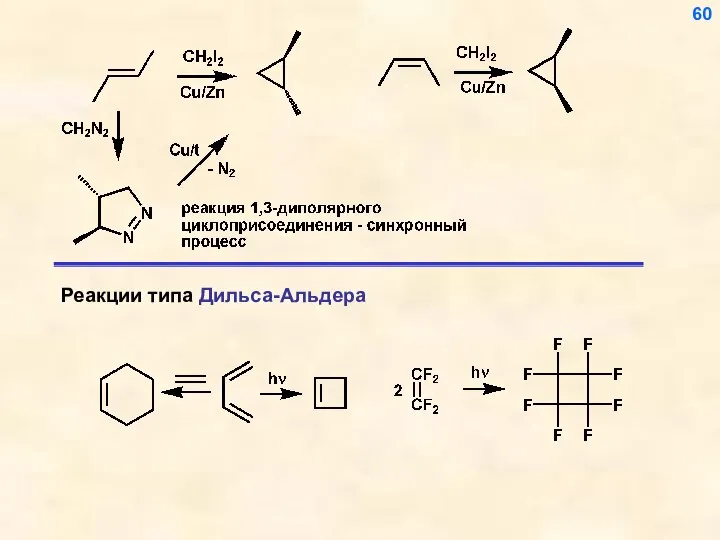
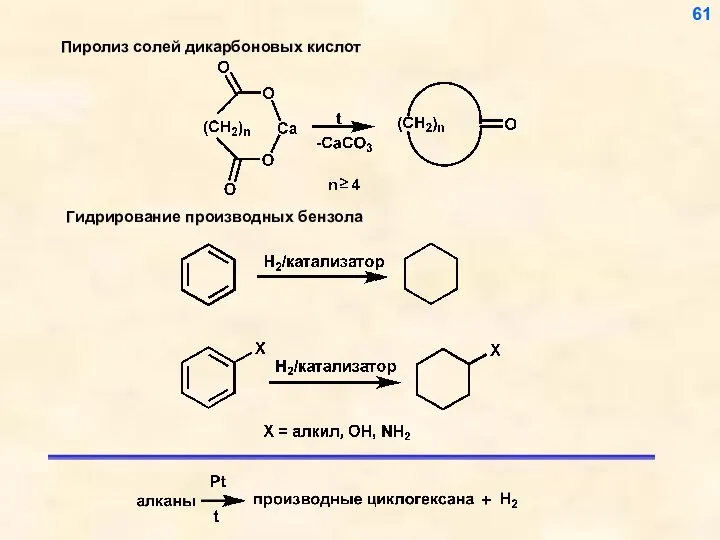
- 61. 60
- 62. 61
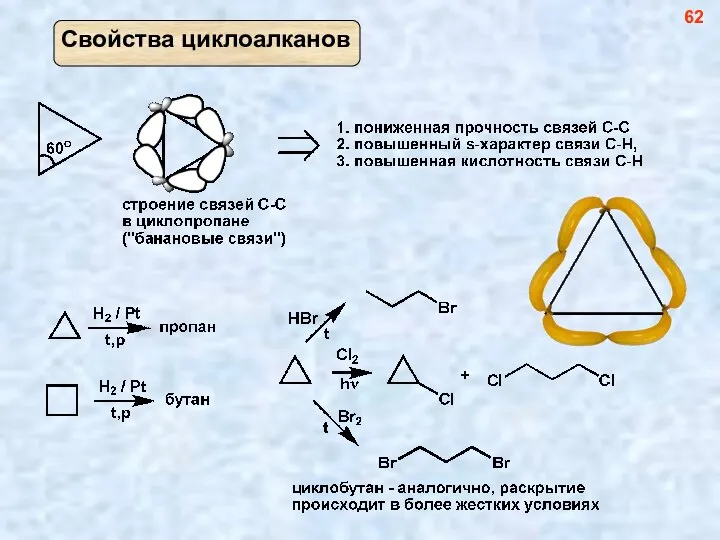
- 63. 62
- 65. Скачать презентацию












 Установка изомеризации пентан гексановой фракции
Установка изомеризации пентан гексановой фракции Структура белка
Структура белка Предельные углеводороды
Предельные углеводороды Биологическая роль макро и микроэлементов. (Лекция 17)
Биологическая роль макро и микроэлементов. (Лекция 17) pH жидкостей, необходимых для человека Выполнили: Учащиеся 11 класса МОУ «СОШ №16» Самоделкин Василий Шадрин Константин
pH жидкостей, необходимых для человека Выполнили: Учащиеся 11 класса МОУ «СОШ №16» Самоделкин Василий Шадрин Константин  Мило та його склад
Мило та його склад  Растворение. Растворимость веществ.
Растворение. Растворимость веществ. Химия морской воды
Химия морской воды Теория диаграмм состояния
Теория диаграмм состояния Углеводы. Структура
Углеводы. Структура Биогеохимические эндемии и их профилактика
Биогеохимические эндемии и их профилактика Органикалық қосылыстар
Органикалық қосылыстар Бораты и силикаты как матрицы лазеров. Свойства и методы выращивания
Бораты и силикаты как матрицы лазеров. Свойства и методы выращивания Закономерности химических реакций
Закономерности химических реакций Азотная кислота
Азотная кислота Гидролиз солей
Гидролиз солей Химические свойства кислот.
Химические свойства кислот. Презентация по Химии "Спирты" - скачать смотреть _
Презентация по Химии "Спирты" - скачать смотреть _ Основные типы химических реакций
Основные типы химических реакций Презентация по химии Применение электролиза
Презентация по химии Применение электролиза  Классификация и ассортимент клея
Классификация и ассортимент клея Фосфор, фосфор оксидтері
Фосфор, фосфор оксидтері Выполнил учениц__ 9 «___» класса __________________
Выполнил учениц__ 9 «___» класса __________________  Химические свойства алкинов
Химические свойства алкинов Воздух. Состав воздуха. Реакция горения
Воздух. Состав воздуха. Реакция горения Химический элемент сера
Химический элемент сера Ionic polymerization
Ionic polymerization Неорганическая химия
Неорганическая химия