Содержание
- 2. Цель обучения 1)Определять ионные равновесия в растворах электролитов; 2)Доказывать качественный состав растворов кислот, гидроксидов и солей
- 3. Водные растворы могут быть нейтральными, кислыми или щелочными. В кислых растворах содержится избыток ионов Н+, а
- 4. Впрочем, даже для такого слабого электролита, как вода, можно измерить константу диссоциации Кд: Эта константа настолько
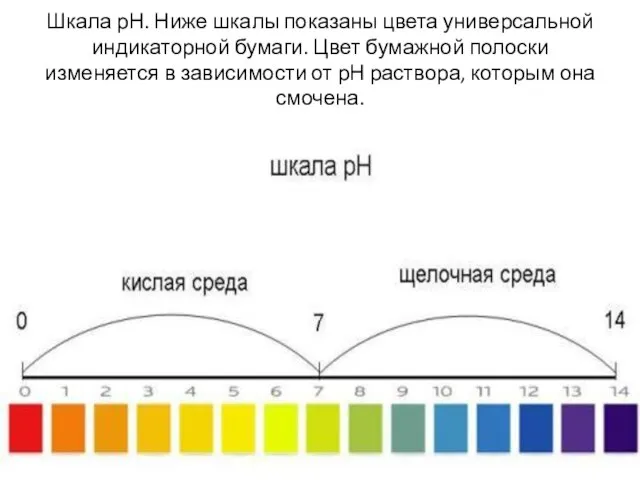
- 5. Шкала рН. Ниже шкалы показаны цвета универсальной индикаторной бумаги. Цвет бумажной полоски изменяется в зависимости от
- 6. Кислотно-основные индикаторы - это соединения, окраска которых меняется в зависимости от кислотности среды.
- 7. Алгоритм составления реакций ионного обмена Записывают молекулярное уравнение и расставляют коэффициенты. При записи химических формул продуктов
- 8. Реакции, протекающие между ионами в растворах электролитов называются реакциями ионного обмена (РИО). В ходе РИО не
- 9. Реакции ионного обмена протекают практически необратимо в случае, если один из образующихся продуктов реакции "уходит" из
- 10. Алгоритм составления уравнений ионного обмена Составим уравнение реакции между гидроксидом железа (III) и азотной кислотой. Fe(OH)3
- 11. Пример 1 а) Молекулярное уравнение реакции щелочи с кислотой: KOH (р) + HCl (р) = KCl(р)
- 12. Пример 2 Составим уравнение реакции между карбонатом натрия и нитратом магния. Na2CO3 + Mg(NO3)2 = 2NaNO3
- 13. Пример 3 Составим уравнение реакции между карбонатом натрия и азотной кислотой. Na2CO3 + 2HNO3 = 2NaNO3
- 14. Пример 4 Составим два молекулярных уравнения реакций, которым соответствует следующее сокращенное ионное уравнение: Ca2+ + CO32-
- 15. Задание для самостоятельной работы Взаимодействие оснований с кислотами. Запишите молекулярное, краткое и полное ионные уравнения взаимодействия
- 17. Скачать презентацию













 Дисперсные системы: получение и свойства. Часть 2
Дисперсные системы: получение и свойства. Часть 2 Аттестационная работа. Программа регионального компонента образовательной области Химия
Аттестационная работа. Программа регионального компонента образовательной области Химия Презентация по Химии "Родословная Д. И. Менделеева." - скачать смотреть бесплатно
Презентация по Химии "Родословная Д. И. Менделеева." - скачать смотреть бесплатно Шестичленні гетероцикли з одним гетероатомом. Піридин
Шестичленні гетероцикли з одним гетероатомом. Піридин Radical reactions. Decarboxylative alkenylations and alkynylations
Radical reactions. Decarboxylative alkenylations and alkynylations Классификация химических реакций
Классификация химических реакций Морфология тел полезных ископаемых
Морфология тел полезных ископаемых Презентация по Химии "Самородки." - скачать смотреть бесплатно_
Презентация по Химии "Самородки." - скачать смотреть бесплатно_ Периодический закон Д.И.Менделеева (1834-1907г.г.)
Периодический закон Д.И.Менделеева (1834-1907г.г.) Кислород – химический элемент и простое вещество
Кислород – химический элемент и простое вещество Мыла и синтетические моющие средства
Мыла и синтетические моющие средства Эмульсии и эмульгаторы
Эмульсии и эмульгаторы Минералы. Классификация
Минералы. Классификация Закон постоянства состава вещества
Закон постоянства состава вещества Тема урока «Важнейшие соединения серы». Цель: рассмотреть свойства важнейших соединений серы-сероводорода, оксидов серы (IV) и (V
Тема урока «Важнейшие соединения серы». Цель: рассмотреть свойства важнейших соединений серы-сероводорода, оксидов серы (IV) и (V Силикатная промышленность
Силикатная промышленность Алкіни
Алкіни  Застосування та різновиди скла Підготував учень 32 групи Матрос Кирило
Застосування та різновиди скла Підготував учень 32 групи Матрос Кирило  Электрохимические технологии неорганических веществ
Электрохимические технологии неорганических веществ Галогены. Основные химические свойства. Качественные реакции
Галогены. Основные химические свойства. Качественные реакции Физические свойства металлов: пластичность, электропроводность, теплопроводность, металлический блеск, плотность
Физические свойства металлов: пластичность, электропроводность, теплопроводность, металлический блеск, плотность Особенности сжигания жидкого топлива и топливосжигающие устройства
Особенности сжигания жидкого топлива и топливосжигающие устройства Презентация по Химии "Бериллий, магний и щелочноземельные металлы" - скачать смотреть
Презентация по Химии "Бериллий, магний и щелочноземельные металлы" - скачать смотреть  Химическая посуда
Химическая посуда карбонат кальция карбонат кальция мел мрамор известняк
карбонат кальция карбонат кальция мел мрамор известняк Химическая картина мира
Химическая картина мира Оксид серы (VI). Серная кислота
Оксид серы (VI). Серная кислота Технические средства наноэлектроники. Эпитаксиальные методы получения наноструктур
Технические средства наноэлектроники. Эпитаксиальные методы получения наноструктур