Содержание
- 2. Поняття та відомості про алкіни Алкіни – вуглеводні, що містять в молекулі один або кілька потрійних
- 3. Назви алкінів походять від назв алканів, при цьому суфікс -ан заміщається на суфікс -ін. Перший представник
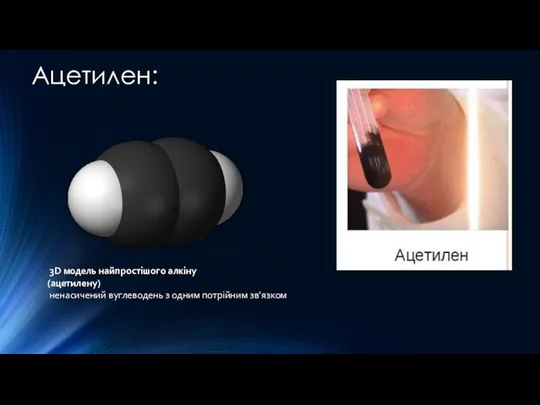
- 4. Ацетилен: 3D модель найпростішого алкіну (ацетилену) ненасичений вуглеводень з одним потрійним зв'язком
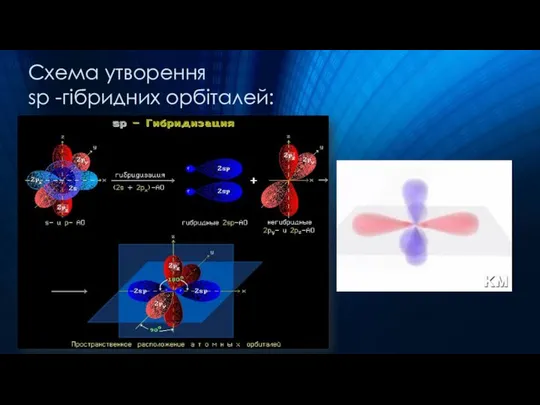
- 5. Характеристика потрійного зв’язку: Вид гібридизації – sp Валентний кут – 180° Довжина зв’язку С = С
- 6. Схема утворення sp -гібридних орбіталей:
- 7. Гомологічний ряд алкінів: C2H2 C3H4 C4H6 C5H8 C6H10 C7H12 C8H14 Етин Пропин Бутин Пентин Гексин Гептин
- 8. Структурна ізомерія алканів: 1. Ізомерія положення потрійного зв’язку (починаючи з С4Н6): СН ССН2СН3 СН3СССН3 бутин-1 бутин-2
- 9. Фізичні властивості Фізичні властивості алкінів схожі на властивості алканів та алкенів. При звичайних умовах (С2-С4) —
- 10. Хімічні властивості Хімічні властивості ацетилену і його гомологів визначаються наявністю в їх молекулах потрійного зв’язку. Найбільш
- 11. Реакції приєднання: 1. Галогенування Знебарвлення бромної води є якісною реакцією на всі ненасичені вуглеводні.
- 12. 2. Гідрогалогенування. 3. Гідрування. 4. Гідратація. HgSO4 НCCH + H2O [HC=CH] CH3CH
- 13. Окиснення Ацетилен і його гомологи окиснюються перманганатом калію з розщепленням потрійного зв’язку і утворенням карбонових кислот.
- 14. Горіння ацетилену При спалюванні (повному окисненні) ацетилену виділяється велика кількість тепла: HCCH + 2О2 2СО2
- 15. Реакція полімеризації 1. Димеризація під дією водного розчину CuCl2 і NH4Cl: НCCH + НCCH Н2C=CHCCH
- 16. Добування алкінів Ацетилен добувають в промисловості двома способами: 1. Термічний крекінг метану: 1500С 2СН4 С2Н2
- 17. Хімічні властивості ацетиленових вуглеводнів обумовлені природою потрійного зв’язку, хімічною поведінкою карбонових атомів у стані sp-гібридизації. Для
- 19. Скачать презентацию














 Этанол (этиловый спирт)
Этанол (этиловый спирт) Кометика Liv Delano - презентация_
Кометика Liv Delano - презентация_ Хемосинтез. Автотрофное питание
Хемосинтез. Автотрофное питание Сложные эфиры в жизни человека
Сложные эфиры в жизни человека Вода. Физические и химические свойства воды
Вода. Физические и химические свойства воды Углеводы. 10 класс
Углеводы. 10 класс Презентация Свойства черных и цветных металлов
Презентация Свойства черных и цветных металлов  Количество вещества. Молярная масса. Задачи
Количество вещества. Молярная масса. Задачи Растворы. Гетерогенные равновесия растворов с осадком
Растворы. Гетерогенные равновесия растворов с осадком Тема урока "Основания" - презентация_
Тема урока "Основания" - презентация_ “ КОРОЗІЯ МЕТАЛІВ. ЗАХИСТ ВІД КОРОЗІЇ ” Підготував: Учень 10-А класу ЗОШ №25 м. Луцька Матвійчук Роман
“ КОРОЗІЯ МЕТАЛІВ. ЗАХИСТ ВІД КОРОЗІЇ ” Підготував: Учень 10-А класу ЗОШ №25 м. Луцька Матвійчук Роман  Хімічні добавки. Е-числа
Хімічні добавки. Е-числа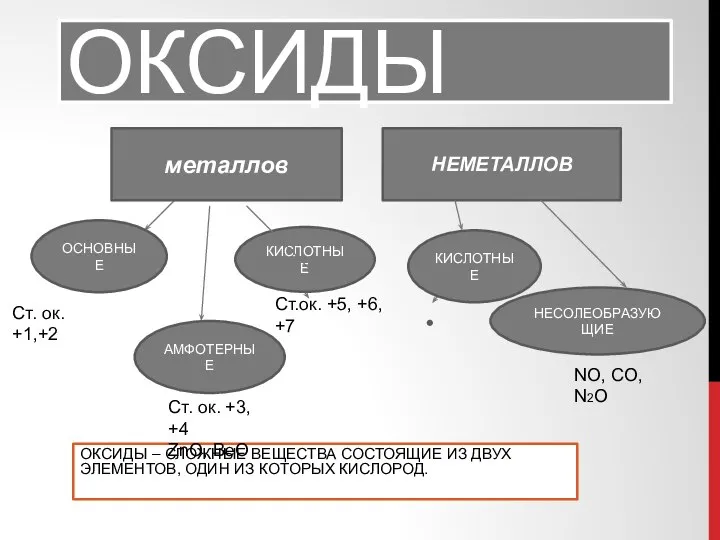 Оксиды
Оксиды Вуглеводи, як компонент їжі. Їхня роль в організмі людини
Вуглеводи, як компонент їжі. Їхня роль в організмі людини Тема: Липиды. Лекция № 2 для студентов 2 курса
Тема: Липиды. Лекция № 2 для студентов 2 курса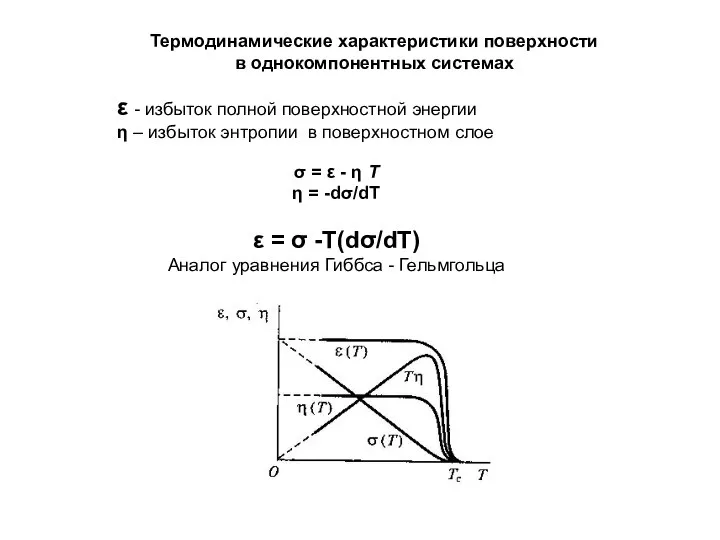 Презентация по Химии "Термодинамические характеристики поверхности" - скачать смотреть
Презентация по Химии "Термодинамические характеристики поверхности" - скачать смотреть  Строение электронных оболочек атомов
Строение электронных оболочек атомов Тотықтырғыштар
Тотықтырғыштар Производная в химии
Производная в химии Классификация кислот
Классификация кислот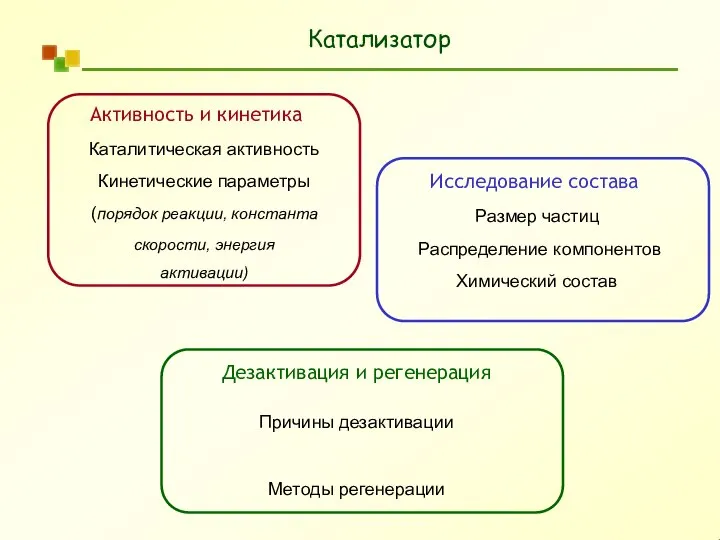 Катализатор. Анализ кинетических данных
Катализатор. Анализ кинетических данных Важнейшие классы неорганических соединений
Важнейшие классы неорганических соединений Биотрансформация чужеродных соединений в организме. (Лекция 5)
Биотрансформация чужеродных соединений в организме. (Лекция 5) Презентация по Химии "Ферменты. Роль и функции" - скачать смотреть
Презентация по Химии "Ферменты. Роль и функции" - скачать смотреть  Краткая история химии
Краткая история химии Презентация по Химии "Дмитро Менделєєв" - скачать смотреть бесплатно
Презентация по Химии "Дмитро Менделєєв" - скачать смотреть бесплатно Методы разделения и концентрирования
Методы разделения и концентрирования Л3.12 Композицитонные материалы
Л3.12 Композицитонные материалы