Содержание
- 2. Тема 6.2 Изотермический процесс в реакционном объеме Режимы идеального вытеснения и периодический идеального смешения Режим проточный
- 3. Изотермический процесс в реакционном объеме Отсутствуют тепловые изменения Происходящие явления отражаются только в состоянии материальных потоков
- 4. Математическая модель РИВ и РИС-п при τ = 0, С = С0 Переходя к конверсии, при
- 5. Характеристическое уравнение идеального режима (РИС-п или РИВ) РИВ и РИС-п
- 6. Кинетическое уравнение W(C) = kCn Модель процесса при τ = 0, С = С0 при τ
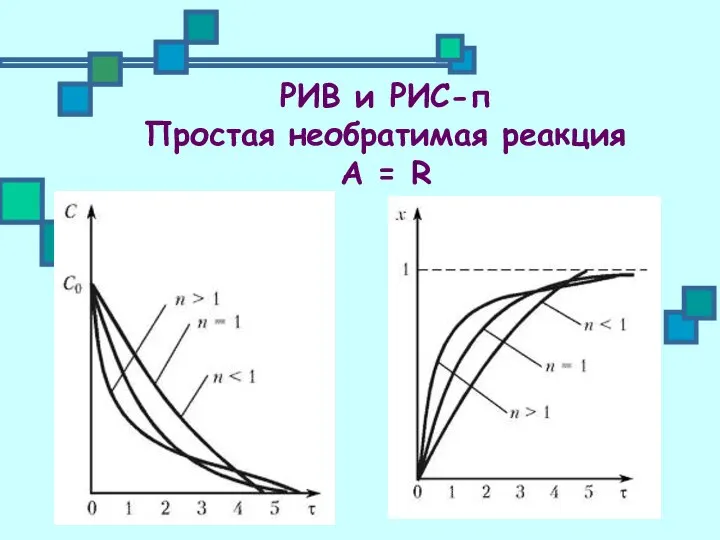
- 7. Интегрируем и получаем Получаем зависимость С(τ) и РИВ и РИС-п Простая необратимая реакция А = R
- 8. Вводим конверсию вместо концентрации Получаем зависимость х(τ) и РИВ и РИС-п Простая необратимая реакция А =
- 9. РИВ и РИС-п Простая необратимая реакция А = R
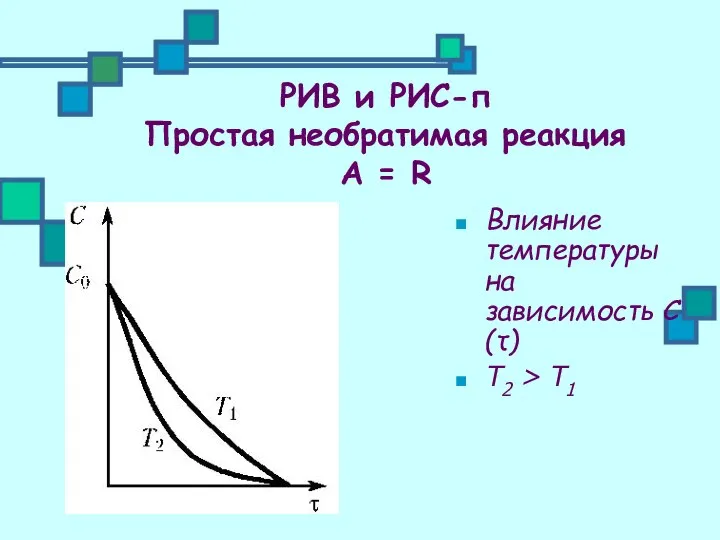
- 10. Влияние температуры на зависимость С(τ) Т2 > Т1 РИВ и РИС-п Простая необратимая реакция А =
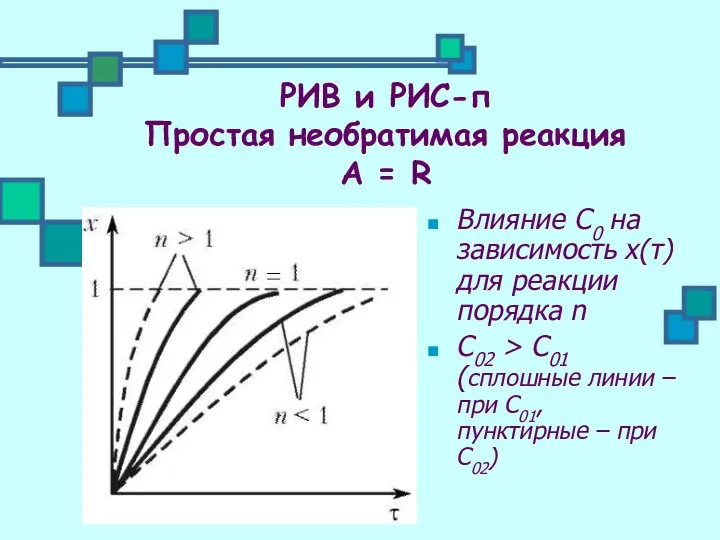
- 11. Влияние С0 на зависимость х(τ) для реакции порядка n С02 > С01 (сплошные линии – при
- 12. Анализ зависимости С(τ) и х(τ) показывает: - в РИС-п - влияние условий процесса на изменение С
- 13. Кинетическое уравнение (для реакций 1-го порядка в обоих направлениях) W(C) = k1CА – k2CR Модель процесса
- 14. РИС-н Простая обратимая реакция А ↔ R Интегрируем и получаем или При τ→∞ достигается равновесие и
- 15. РИВ и РИС-п Простая обратимая реакция А ↔ R Анализ С0: Начальная концентрация реагента не влияет
- 16. РИВ и РИС-п Простая обратимая реакция А ↔ R Зависимость х(τ) для обратимых реакций при Т1
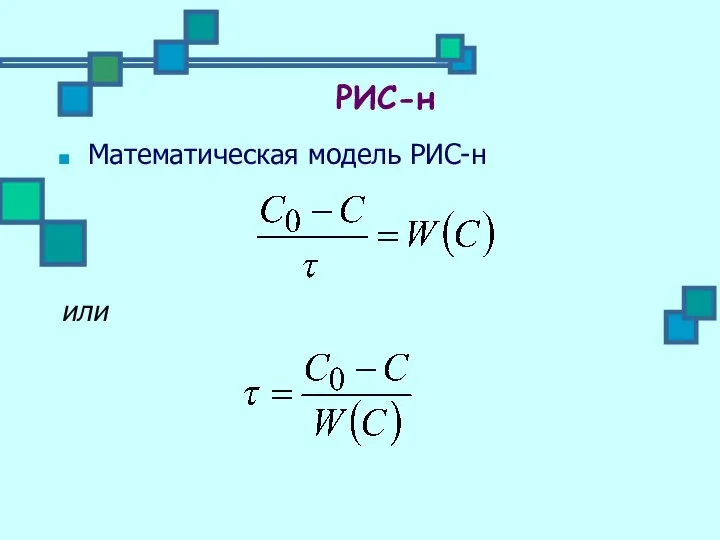
- 17. Математическая модель РИС-н или РИС-н
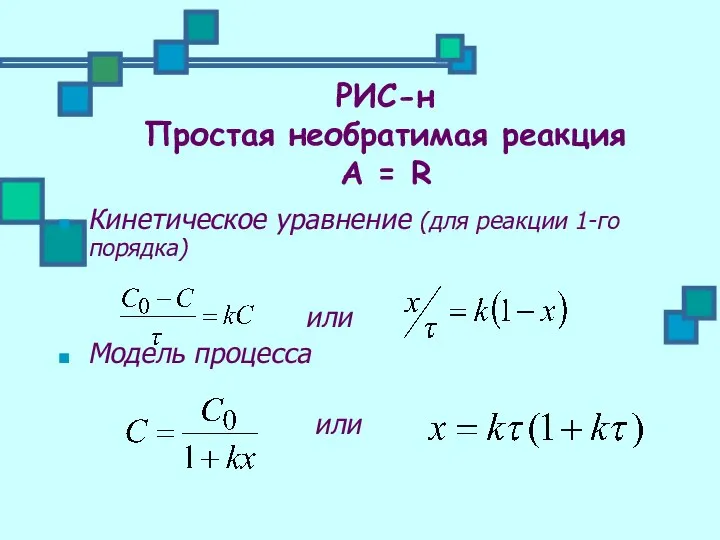
- 18. Кинетическое уравнение (для реакции 1-го порядка) или Модель процесса или РИС-н Простая необратимая реакция А =
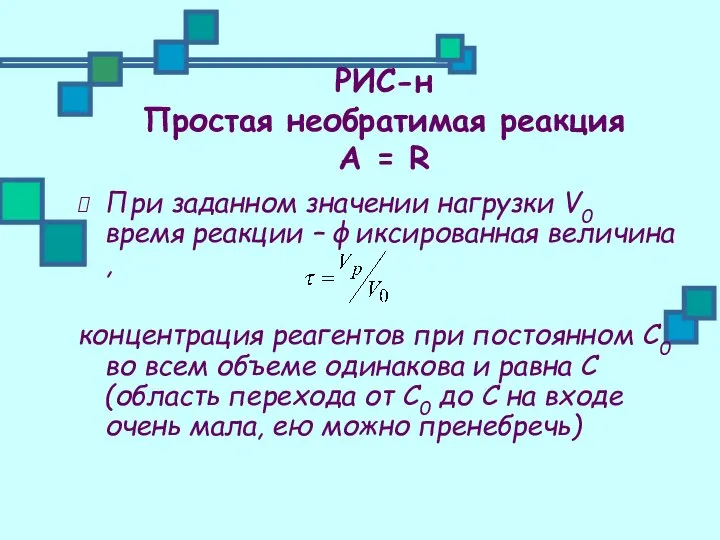
- 19. РИС-н Простая необратимая реакция А = R При заданном значении нагрузки V0 время реакции – фиксированная
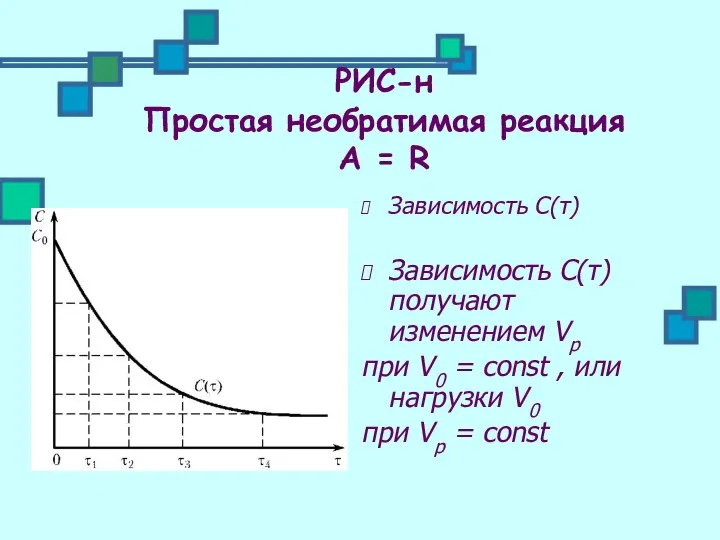
- 20. РИС-н Простая необратимая реакция А = R Зависимость С(τ) Зависимость С(τ) получают изменением Vр при V0
- 21. РИС-н Простая обратимая реакция А = R Кинетическое уравнение (для реакций 1-го порядка в обоих направлениях)
- 22. РИС-н Простая обратимая реакция А ↔ R При τ→∞ достигается равновесие и конверсия равна Равновесная конверсия
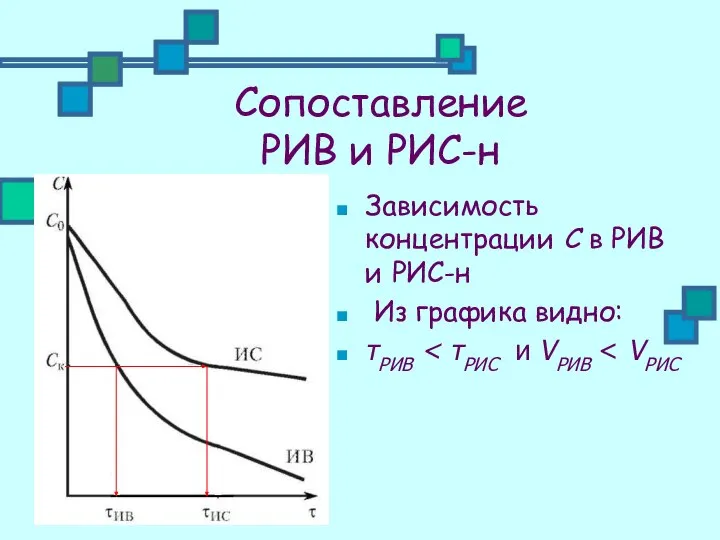
- 23. Сопоставление РИВ и РИС-н Зависимость концентрации С в РИВ и РИС-н Из графика видно: τРИВ
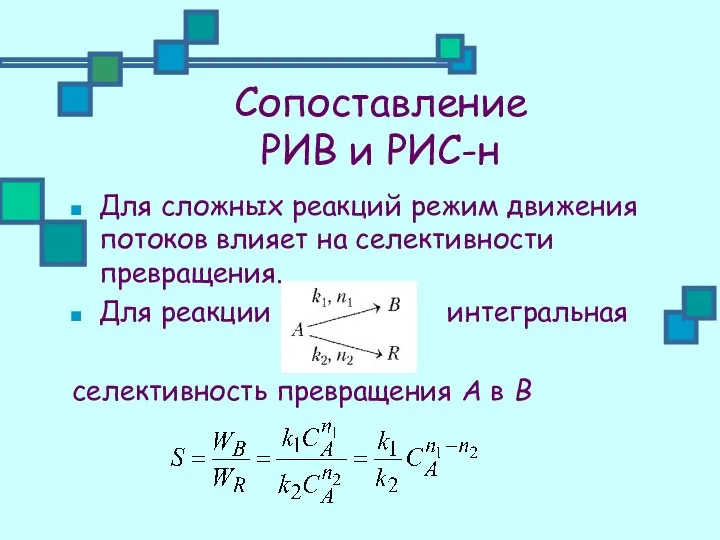
- 24. Сопоставление РИВ и РИС-н Для сложных реакций режим движения потоков влияет на селективности превращения. Для реакции
- 25. Сопоставление РИВ и РИС-н Следовательно, при проведении процесса в РИВ и РИС возможны три варианта: SРИВ
- 27. Скачать презентацию















 синтетичні мийні засоби
синтетичні мийні засоби  Көмірсу. Көмірсулардың қасиеттері. Көмірсудың метаболизмі
Көмірсу. Көмірсулардың қасиеттері. Көмірсудың метаболизмі Лужні метали Підготувала: Анна Сідорова
Лужні метали Підготувала: Анна Сідорова  Карбоновые кислоты. (10 класс)
Карбоновые кислоты. (10 класс) Адсорбция
Адсорбция Массовая доля вещества в растворе
Массовая доля вещества в растворе Виды парфюмерно-косметической косметики
Виды парфюмерно-косметической косметики Классификация органических соединений
Классификация органических соединений Эксперимент. Выращивание солевых кристаллов
Эксперимент. Выращивание солевых кристаллов Атомы и молекулы
Атомы и молекулы Рибонуклеиновая кислота
Рибонуклеиновая кислота Распределение электронов в атомах. Энергетические уровни
Распределение электронов в атомах. Энергетические уровни Химия в пищевой промышленности
Химия в пищевой промышленности Коррозия металлов в контакте
Коррозия металлов в контакте Оружие массового поражения. Биологическое оружие
Оружие массового поражения. Биологическое оружие  Абразивные материалы
Абразивные материалы Условия проведения реакции дегидратации
Условия проведения реакции дегидратации Интоксикации сельскохозяйственными ядохимикатами (пестицидами)
Интоксикации сельскохозяйственными ядохимикатами (пестицидами) Неорганическая химия Сероводород
Неорганическая химия Сероводород  Практична робота з хімії “Металічні елементи та їхні сполуки” Виконала учениця 10-А класу Ковальова Анастасія
Практична робота з хімії “Металічні елементи та їхні сполуки” Виконала учениця 10-А класу Ковальова Анастасія  Корень как часть слова
Корень как часть слова  Синтез наночастиц неорганических веществ. (Лекция 7)
Синтез наночастиц неорганических веществ. (Лекция 7) 3 Стехиометрические законы
3 Стехиометрические законы Спирты Предельные одноатомные спирты
Спирты Предельные одноатомные спирты Ступенчатые процессы получения полимеров: полиприсоединение, поликонденсация
Ступенчатые процессы получения полимеров: полиприсоединение, поликонденсация Презентация по Химии "Цветная металлургия" - скачать смотреть
Презентация по Химии "Цветная металлургия" - скачать смотреть  Химические свойства карбоновых кислот
Химические свойства карбоновых кислот Основы коррозии и защиты металлов
Основы коррозии и защиты металлов