Содержание
- 2. Содержание Открытие и начало производства Формы нахождения в природе Производство Структура и свойства
- 3. Открытие и начало производства О ранних, несистематических и часто непризнанных синтезах карбида кремния сообщали Деспретз (1849),
- 4. Формы нахождения в природе Хоть карбид кремния и является редким веществом на Земле, однако, он широко
- 5. Производство Чистый карбид кремния можно получить с помощью так называемого процесса Лели[13], в котором порошкообразный SiC
- 6. Структура и свойства Известно примерно 250 кристаллических форм карбида кремния[20]. Полиморфизм SiC характеризуется большим количеством схожих
- 7. Бета-модификация (β-SiC), с кристаллической структурой типа цинковой обманки (аналог структуры алмаза), образуется при температурах ниже 1700
- 8. Существует большой интерес в использовании данного вещества в качестве полупроводникового материала в электронике, где его высокая
- 10. Скачать презентацию
Содержание
Открытие и начало производства
Формы нахождения в природе
Производство
Структура и свойства
Содержание
Открытие и начало производства
Формы нахождения в природе
Производство
Структура и свойства
Открытие и начало производства
О ранних, несистематических и часто непризнанных синтезах карбида кремния сообщали
Открытие и начало производства
О ранних, несистематических и часто непризнанных синтезах карбида кремния сообщали
Исторически первым способом использования карбида кремния было использование в качестве абразива. За этим последовало применение и в электронных устройствах. В начале XX века карбид кремния использовался в качестве детектора в первых радиоприемниках[6]. В 1907 году Генри Джозеф Раунд создал первый светодиод, подавая напряжение на кристаллы SiC и наблюдая за желтым, зеленым и оранжевым излучением на катоде. Эти эксперименты были позже повторены О. В. Лосевым в СССР в 1923 году[7].
Формы нахождения в природе
Хоть карбид кремния и является редким веществом на
Формы нахождения в природе
Хоть карбид кремния и является редким веществом на
Природный карбид кремния — муассанит можно найти только в ничтожно малых количествах в некоторых типах метеоритов и в месторождениях корунда и кимберлита. Практически любой карбид кремния, продаваемый в мире, в том числе и в виде муассанитового украшения, является синтетическим. Природный муассанит был впервые обнаружен в 1893 году в качестве небольшого включения в метеорите Каньон Диабло в Аризоне Фердинандом Анри Муассаном, в честь которого и был названминерал в 1905 году[8]. Исследование Муассана о естественном происхождении карбида кремния было изначально спорным, потому что его образец мог быть загрязнён крошкой карбида кремния от пилы (в то время пилы уже содержали данное вещество)[9].
Производство
Чистый карбид кремния можно получить с помощью так называемого процесса Лели[13],
Производство
Чистый карбид кремния можно получить с помощью так называемого процесса Лели[13],
Из-за редкости нахождения в природе муассанита, карбид кремния, как правило, имеет искусственное происхождение. Простейшим способом производства является спекание кремнезема с углеродом в графитовой электропечи Ачесона при высокой температуре 1600—2500 °C:
Синтетические кристаллы SiC ~ 3 мм в диаметре
Чистота карбида кремния, образующегося в печи Ачесона, зависит от расстояния до графитового резистора в ТЭНе.
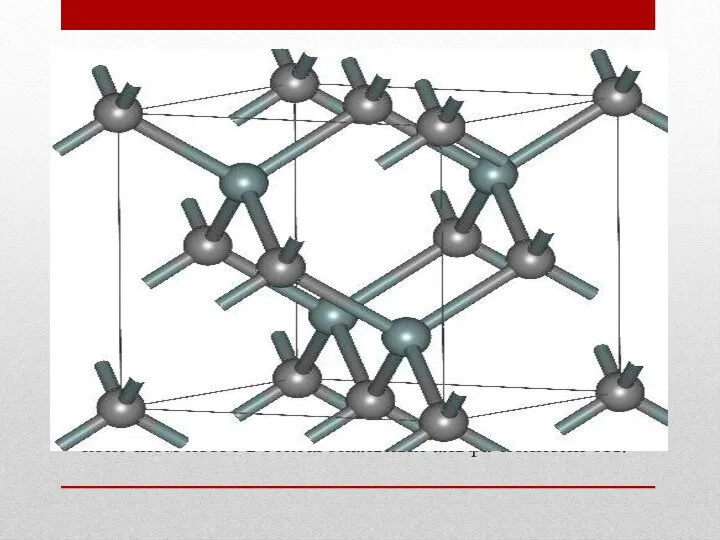
Структура и свойства
Известно примерно 250 кристаллических форм карбида кремния[20]. Полиморфизм SiC
Структура и свойства
Известно примерно 250 кристаллических форм карбида кремния[20]. Полиморфизм SiC
Альфа карбид кремния (α-SiC) является наиболее часто встречающимся полиморфом. Эта модификация образуется при температуре свыше 1700 °C и имеетгексагональную решётку, кристаллическая структура типа вюрцита.
Бета-модификация (β-SiC), с кристаллической структурой типа цинковой обманки (аналог структуры алмаза), образуется
Бета-модификация (β-SiC), с кристаллической структурой типа цинковой обманки (аналог структуры алмаза), образуется
Существует большой интерес в использовании данного вещества в качестве полупроводникового материала в электронике,
Существует большой интерес в использовании данного вещества в качестве полупроводникового материала в электронике,




![Структура и свойства Известно примерно 250 кристаллических форм карбида кремния[20]. Полиморфизм](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1348224/slide-5.jpg)

 Многоатомные спирты
Многоатомные спирты Энергетика химических реакций
Энергетика химических реакций Резиновая краска
Резиновая краска Перемешивание в жидких средах
Перемешивание в жидких средах «Уксусная кислота»
«Уксусная кислота»  Інтенсивні технології вирощування дрібнокісточкових культур
Інтенсивні технології вирощування дрібнокісточкових культур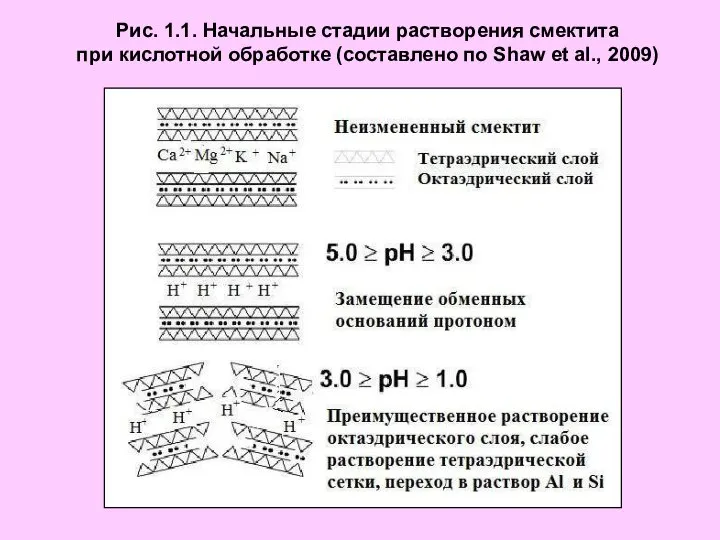 Начальные стадии растворения смектита при кислотной обработке
Начальные стадии растворения смектита при кислотной обработке Пифарнин (ribavirin)
Пифарнин (ribavirin) Динамический характер адсорбции. Лекция 2
Динамический характер адсорбции. Лекция 2 Физические и фазовые состояния полимеров
Физические и фазовые состояния полимеров Минеральные вещества
Минеральные вещества Вода: фізичні та хімічні властивості. Поширеність в природі
Вода: фізичні та хімічні властивості. Поширеність в природі Использование кислот природой и человеком
Использование кислот природой и человеком Электролиз. Задание № 20
Электролиз. Задание № 20 Магний. Электронное строение атома Mg
Магний. Электронное строение атома Mg Количество вещества
Количество вещества Газохимия. Абсорбционно-газофракционирующая установка. (Лекция 5.2)
Газохимия. Абсорбционно-газофракционирующая установка. (Лекция 5.2) Химическая кинетика. Лекция 2
Химическая кинетика. Лекция 2 Генетическая связь
Генетическая связь Группа рассеянных химических элементов
Группа рассеянных химических элементов Влияние условий хранения на качество лекарственных средств
Влияние условий хранения на качество лекарственных средств Презентация Биологическое действие радиации
Презентация Биологическое действие радиации  Органическая химия. Лекция. Стероиды
Органическая химия. Лекция. Стероиды Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Задача №9. Глицерин. Команда «Карбораны»
Задача №9. Глицерин. Команда «Карбораны» Нерівноважна термодинаміка та хімічна кінетика. Лекція 1
Нерівноважна термодинаміка та хімічна кінетика. Лекція 1 Физиология и биохимия бактерий. Дыхание и размножение микробов. Питание
Физиология и биохимия бактерий. Дыхание и размножение микробов. Питание Обзор основных методов исследования супрамолекулярных объектов
Обзор основных методов исследования супрамолекулярных объектов