Содержание
- 2. ПЛАН ИЗУЧЕНИЯ ТЕМЫ: Определение. Классификация карбоновых кислот. Номенклатура . Изомерия. Физические свойства.
- 3. ПЛАН ИЗУЧЕНИЯ ТЕМЫ: 6. Химические свойства. 7. Получение. 8. Применение. 9. Самостоятельная работа. 10. Домашнее задание.
- 4. Карбоновые кислоты – это органические вещества, молекулы которых содержат одну или несколько карбоксильных групп (- СООН)
- 5. КЛАССИФИКАЦИЯ КИСЛОТ: По числу карбоксильных групп делятся на одноосновные – НСООН – муравьиная кислота; двухосновные –
- 6. ИЗОМЕРИЯ ОДНООСНОВНЫХ КАРБОНОВЫХ КИСЛОТ Углеводородного радикала: СН3СН2СН2СООН – бутановая кислота СН3СНСООН СН3 2-метилпропановая кислота Межклассовая со
- 7. АЛГОРИТМ СОСТАВЛЕНИЯ НАЗВАНИЙ КАРБОНОВЫХ КИСЛОТ Найдите главную (самую длинную) цепь углеродных атомов (включая атом карбоксильной группы).
- 8. ФИЗИЧЕСКИЕ СВОЙСТВА Наличие водородных связей между молекулами обусловливает высокие температуры кипения и хорошую растворимость в воде
- 9. ХИМИЧЕСКИЕ СВОЙСТВА 1. Горение: СН3СООН +2О2=2СО2+2Н2О 2. Свойства слабых кислот: a. Mg+2CH3COOH=(CH3COO)2Mg+H2 b. CaO+2CH3COOH=(CH3COO)2Ca+H2O c. NaOH+CH3COOH=CH3COONa+H2O
- 10. ХИМИЧЕСКИЕ СВОЙСТВА 3. Этерификация (реакция со спиртами, приводящая к образованию сложного эфира): НСООН+С2Н5ОН=НСООС2Н5+Н2О Муравьиная этанол этиловый
- 11. ХИМИЧЕСКИЕ СВОЙСТВА: 4. Замещение в углеводородном радикале: СН3-СН2-СООН+Cl2=CH3-CHCl-COOH+HCL 5. Качественная реакция на муравьиную кислоту – реакция
- 12. ПОЛУЧЕНИЕ КАРБОНОВЫХ КИСЛОТ 1.Окисление альдегидов: kat, t RCHO+O2 2RCOOH (лабораторные окислители: Ag2O, Cu(OH)2, KMnO4 и др.)
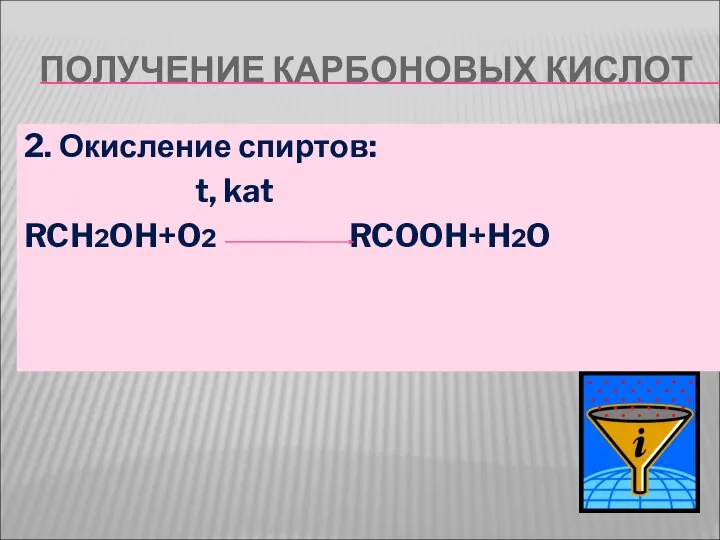
- 13. ПОЛУЧЕНИЕ КАРБОНОВЫХ КИСЛОТ 2. Окисление спиртов: t, kat RCH2OH+O2 RCOOH+H2O
- 14. ПОЛУЧЕНИЕ КАРБОНОВЫХ КИСЛОТ 3. Окисление углеводородов: t, kat 2С4Н10+5О2 4СН3СОН+2Н2О 4. Из солей (лабораторный способ): CH3COONa+H2SO4=CH3COOH
- 15. ПРИМЕНЕНИЕ КАРБОНОВЫХ КИСЛОТ:
- 16. ПРИМЕНЕНИЕ КАРБОНОВЫХ КИСЛОТ:
- 17. ПРИМЕНЕНИЕ КАРБОНОВЫХ КИСЛОТ: Высшие карбоновые кислоты ( пальмитиновая – С15Н31СООН, стеариновая – С17Н35СООН и т.д.) называются
- 18. САМОСТОЯТЕЛЬНАЯ РАБОТА: 1.Выписать формулы веществ, с которыми может вступать в реакцию уксусная кислота. (Са, СаО, СО2,
- 19. 2. Записать структурную формулу вещества - 2-метилгексановая кислота.
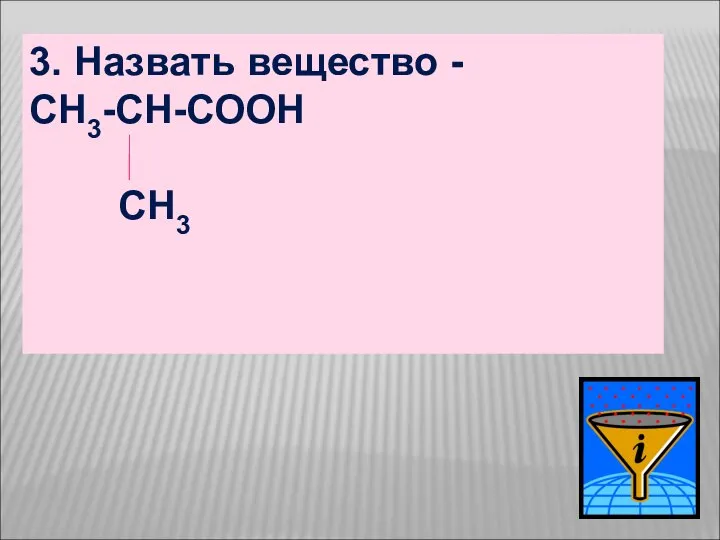
- 20. 3. Назвать вещество - СН3-СН-СООН CH3
- 21. 4. В пищевой промышленности уксусная кислота используется в качестве консерванта и регулятора кислотности под кодом Е-260.
- 22. ДОМАШНЕЕ ЗАДАНИЕ: Параграф 14 учебника. (Уровень А). Упражнения 5, 7, 8. (Уровень Б). Упражнения 6, 10.
- 24. Скачать презентацию

















 Вода. Классы неорганических соединений. 8 класс
Вода. Классы неорганических соединений. 8 класс Вакуумное фильтрование
Вакуумное фильтрование Битумы природного происхождения
Битумы природного происхождения Растворение. Растворы
Растворение. Растворы Вещества
Вещества Пропан, C3H8
Пропан, C3H8 Презентация по Химии "Соединения" - скачать смотреть бесплатно
Презентация по Химии "Соединения" - скачать смотреть бесплатно Минералы и Близнецы
Минералы и Близнецы Озоновый слой. Механизмы образования и разрушения
Озоновый слой. Механизмы образования и разрушения Химически опасные объекты (ХОО)
Химически опасные объекты (ХОО) Химические реакции (11 класс)
Химические реакции (11 класс) Диазо- и азосоединения
Диазо- и азосоединения Структура кристаллических полимеров
Структура кристаллических полимеров Положение металлов в Периодической системе Д.И. Менделеева. Особенности строения атомов, свойства
Положение металлов в Периодической системе Д.И. Менделеева. Особенности строения атомов, свойства Железо. Физические и химические свойства
Железо. Физические и химические свойства Презентация по Химии "ЖИРНЫЕ КИСЛОТЫ СОСТАВНЫЕ ЧАСТИ ЛИПИДОВ" - скачать смотреть бесплатно
Презентация по Химии "ЖИРНЫЕ КИСЛОТЫ СОСТАВНЫЕ ЧАСТИ ЛИПИДОВ" - скачать смотреть бесплатно Работу выполнила: Ученица 9 класса ГОУ Лицея № 1524 Г.Москвы Себко Екатерина Научный руководитель: Учитель химии ГОУ Лицея № 1524 К
Работу выполнила: Ученица 9 класса ГОУ Лицея № 1524 Г.Москвы Себко Екатерина Научный руководитель: Учитель химии ГОУ Лицея № 1524 К Методы светорассеяния для исследования растворов (био) полимеров и наночастиц
Методы светорассеяния для исследования растворов (био) полимеров и наночастиц Презентация по Химии "Семь доисторических металлов" - скачать смотреть
Презентация по Химии "Семь доисторических металлов" - скачать смотреть  Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Shapes of molecules
Shapes of molecules Над проектом работали ученики 6 класса: Над проектом работали ученики 6 класса: Крючков Слава Орлов Слава Старова Катя Пугачев Се
Над проектом работали ученики 6 класса: Над проектом работали ученики 6 класса: Крючков Слава Орлов Слава Старова Катя Пугачев Се Статья двумя способами. Приготовление катализатора
Статья двумя способами. Приготовление катализатора Кислотно-основные взаимодействия. Принцип ЖМКО Пирсона
Кислотно-основные взаимодействия. Принцип ЖМКО Пирсона Оксиды азота
Оксиды азота Тест по теме «Альдегиды и кетоны»
Тест по теме «Альдегиды и кетоны» Тұздар. Құрамы және химиялық қасиеттері
Тұздар. Құрамы және химиялық қасиеттері Химическая очистка воды
Химическая очистка воды