Содержание
- 2. Содержание: Карбоновые кислоты Сложные эфиры Жиры Тестовая работа
- 3. План изучения: Классификация карбоновых кислот Номенклатура Изомерия Строение Физические свойства Химические свойства Получение Применение
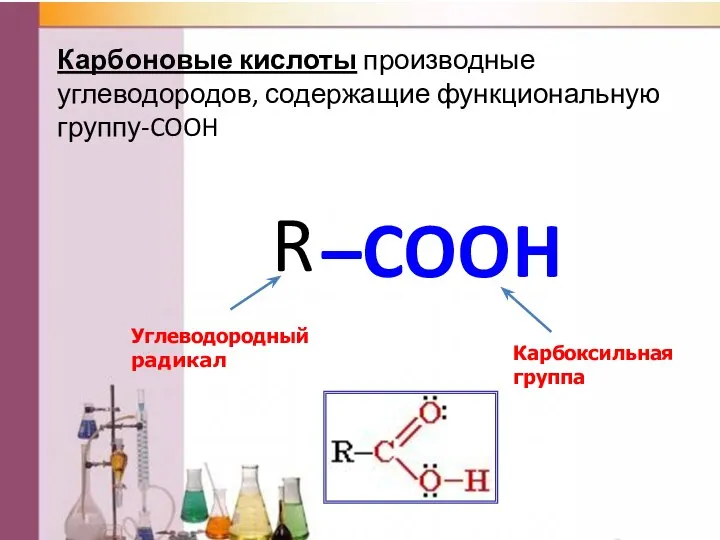
- 4. Карбоновые кислоты производные углеводородов, содержащие функциональную группу-COOH –COOH Карбоксильная группа R Углеводородный радикал
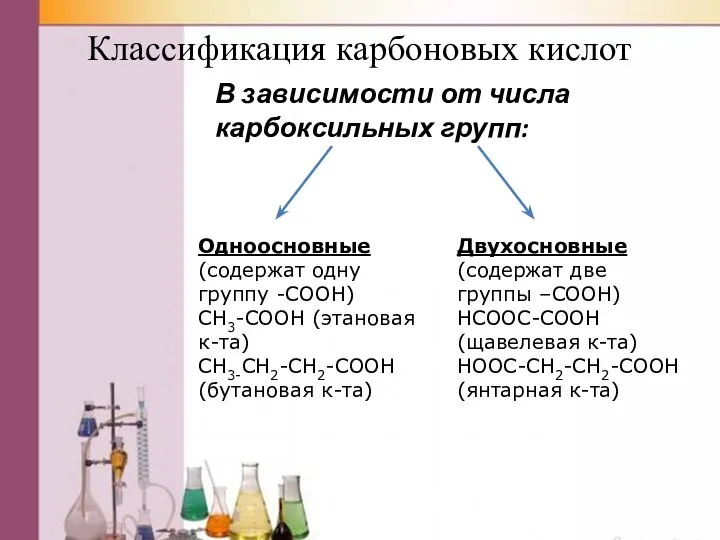
- 5. Классификация карбоновых кислот В зависимости от числа карбоксильных групп: Одноосновные (содержат одну группу -COOH) CH3-COOH (этановая
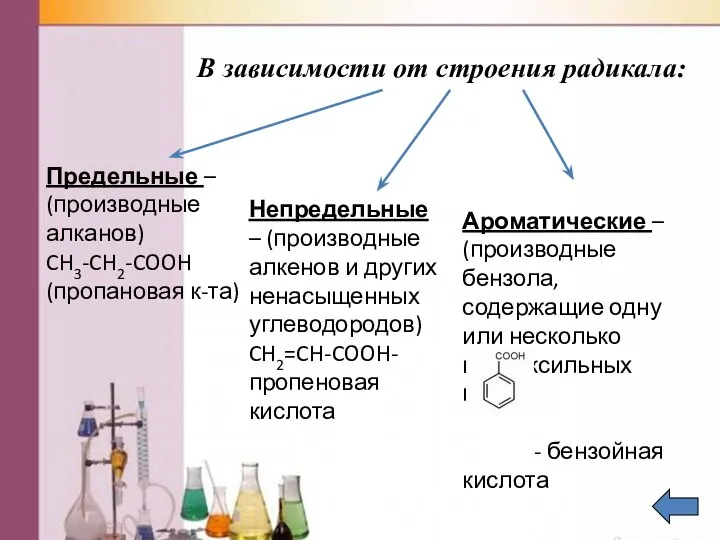
- 6. В зависимости от строения радикала: Предельные – (производные алканов) CH3-CH2-COOH (пропановая к-та) Непредельные – (производные алкенов
- 7. Номенклатура По систематической номенклатуре название кислоты образуют от названия соответствующего алкана с добавлением окончания –овая и
- 8. Виды изомерии 1. Изомерия углеродного скелета(начиная с C3H7COOH) CH3-CH2-CH2-COOH CH3 – CH - COOH | CH3
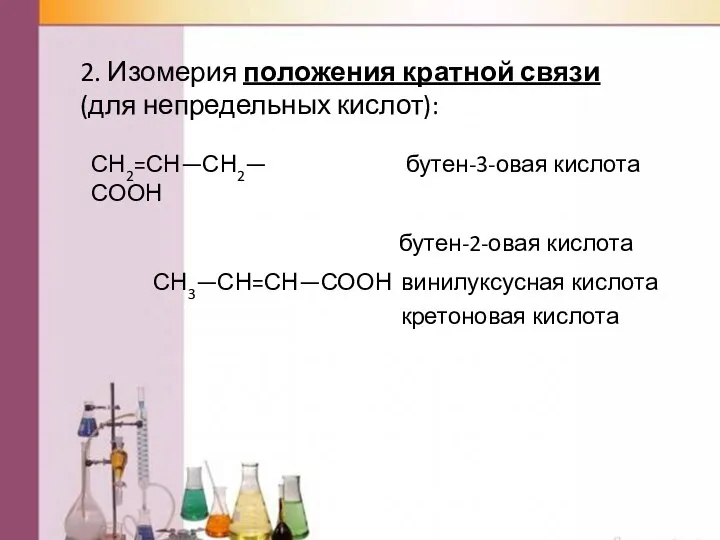
- 9. 2. Изомерия положения кратной связи (для непредельных кислот): СН2=СН—СН2—СООН бутен-3-овая кислота СН3—СН=СН—СООН бутен-2-овая кислота винилуксусная кислота
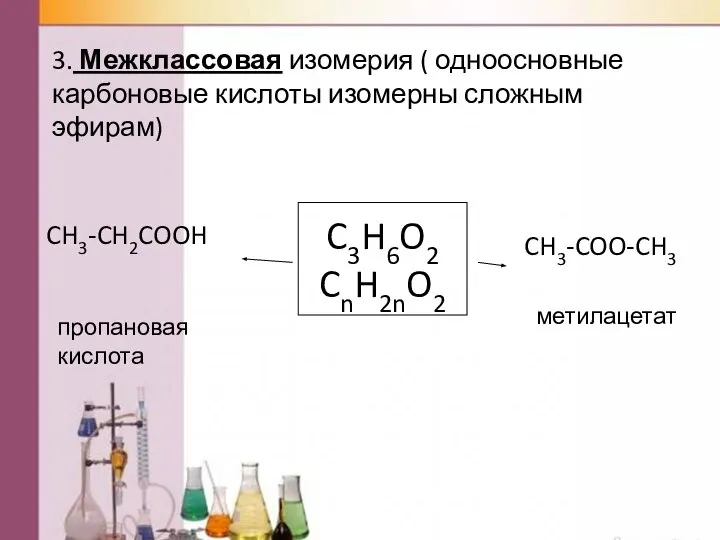
- 10. C3H6O2 CnH2nO2 3. Межклассовая изомерия ( одноосновные карбоновые кислоты изомерны сложным эфирам) CH3-CH2COOH CH3-COO-CH3 пропановая кислота
- 11. Составьте формулы веществ 2,3-диметилмасляная кислота Бутен-3-овая кислота 3,3,4- триметил-2-этилгептановая кислота 2-метилпропеновая кислота (метакриловая кислота) 2,3 –
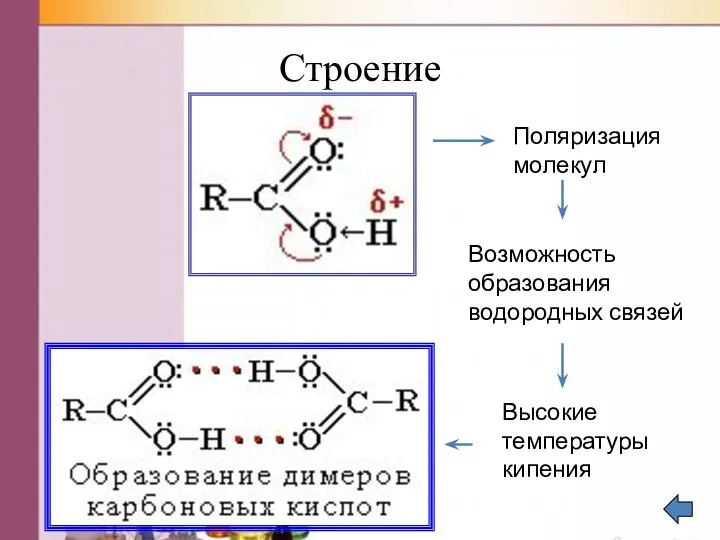
- 12. Строение Поляризация молекул Возможность образования водородных связей Высокие температуры кипения
- 13. Физические свойства
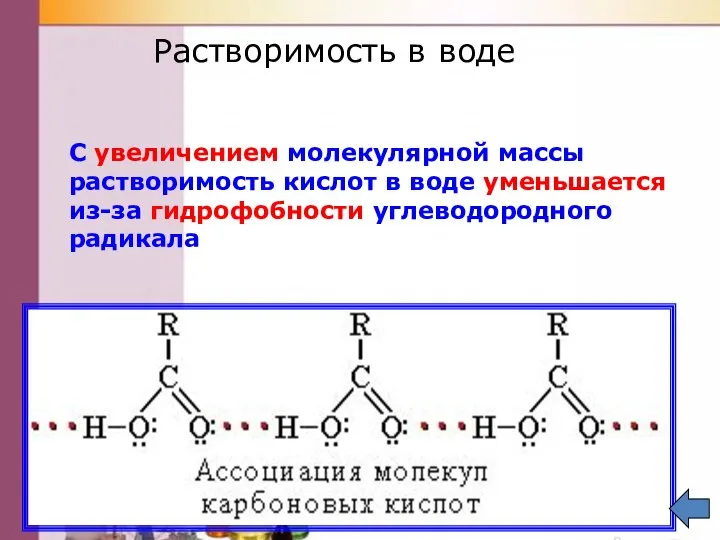
- 14. Растворимость в воде С увеличением молекулярной массы растворимость кислот в воде уменьшается из-за гидрофобности углеводородного радикала
- 15. Химические свойства RCOOH = RCOO- + H+ Проявляют общие свойства кислот Являются более сильными кислотами, чем
- 16. Общие свойства кислот (лабораторные опыты) В две пробирки налейте по 5 мл соляной и уксусной кислоты.
- 17. Опыт 1: HCl = H+ + Cl- CH3COOH = CH3COO- + H + Окраска индикатора в
- 18. Насыпьте в две пробирки немного оксида меди (II) и прилейте в обе пробирки по 5 мл
- 19. Опыт 3: CuO + 2HCl = CuCl2 + H2O CuO + 2H+ = Cu2+ + H2O
- 20. Опыт 4: K2CO3 + 2HCl = 2KCl + CO2 + H2O CO32- + 2H+ = CO2
- 21. Реакции с разрывом связи O-H: 2HCOOH+Mg (HCOO)2Mg+ H2 C2H5COOH+ NaOH C2H5COONa+ H2O 2CH3COOH +CuO (CH3COO )2Cu+H2O
- 22. Специфические свойства карбоновых кислот В пробирку налейте 2 мл концентрированной уксусной кислоты, столько же этанола и
- 23. Опыт 5: CH3COOH+C2H5OH=CH3COOC2H5+H2O В ходе реакции образуется сложный эфир – этилацетат (этиловый эфир уксусной кислоты), бесцветная
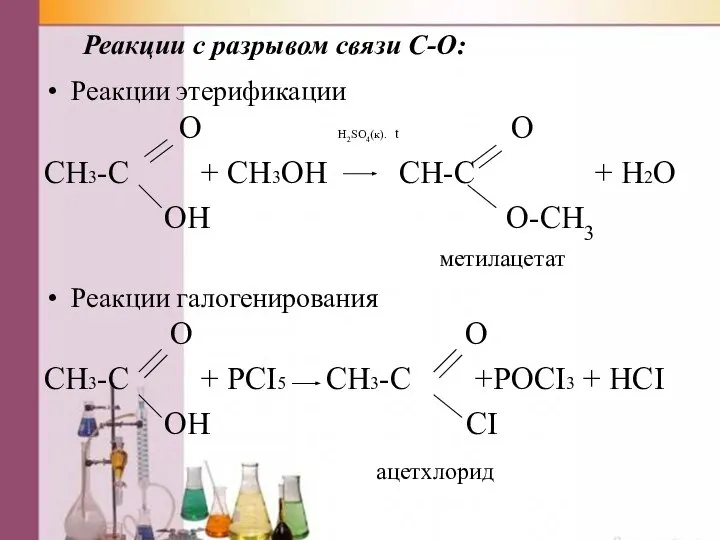
- 24. Реакции с разрывом связи C-O: Реакции этерификации O H2SO4(к). t O CH3-C + CH3OH CH-C +
- 25. Реакции с участием двойной связи C=O Кислоты восстанавливаются до альдегидов или первичных спиртов под действием сильных
- 26. Реакции с участием углеводородного радикала P кр. CH3COOH+Br2 = CH2BrCOOH + HBr Атомы водорода при соседнем
- 27. O H-C OH -муравьиная кислота-альдегидокислота Как альдегид: HCOOH+2[Ag(NH3)2]OH Аg+NH4HCO3+3NH3+H2O (реакция «серебряного зеркала») t HCOOH + 2Cu(OH)2
- 28. Как кислота: проявляет все свойства кислот Специфические свойства : H2SO4(конц) HCOOH CO + H2O
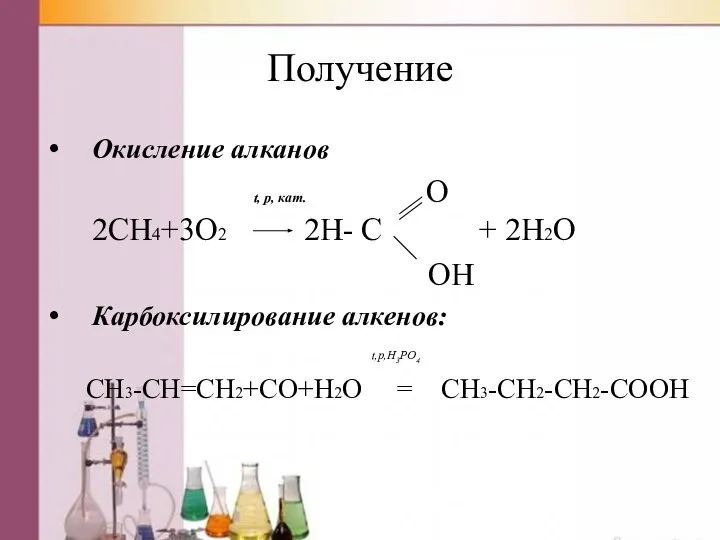
- 29. Получение Окисление алканов t, p, кат. O 2CH4+3O2 2H- C + 2H2O OH Карбоксилирование алкенов: t,p,H3PO4
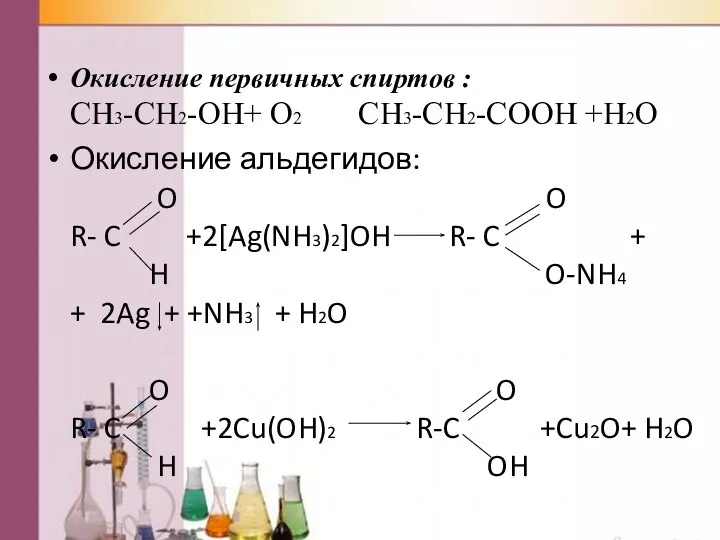
- 30. Окисление первичных спиртов : CH3-CH2-OH+ O2 CH3-CH2-COOH +H2O Окисление альдегидов: O O R- C +2[Ag(NH3)2]OH R-
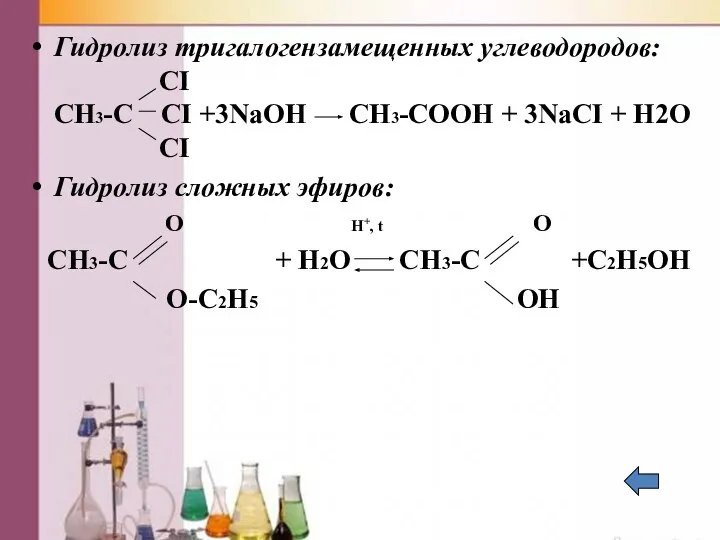
- 31. Гидролиз тригалогензамещенных углеводородов: CI CH3-C CI +3NaOH CH3-COOH + 3NaCI + H2O CI Гидролиз сложных эфиров:
- 32. Из всех карбоновых к-т уксусная к-та находит наиболее широкое применение. К-ту и ее производные широко используют
- 33. План: Номенклатура Изомерия Физические свойства Химические свойства Получение Применение
- 34. Сложные эфиры Сложные эфиры карбоновых кислот – это соединения, образующиеся при взаимодействии органических кислот со спиртами.
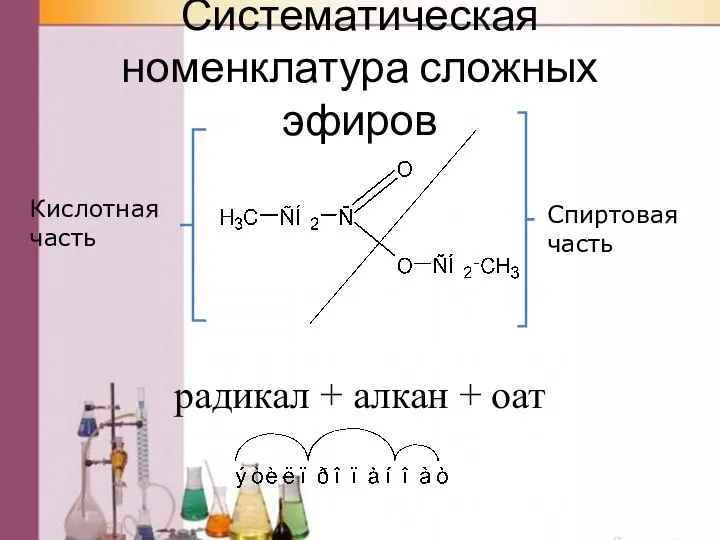
- 35. Систематическая номенклатура сложных эфиров Кислотная часть Спиртовая часть радикал + алкан + оат
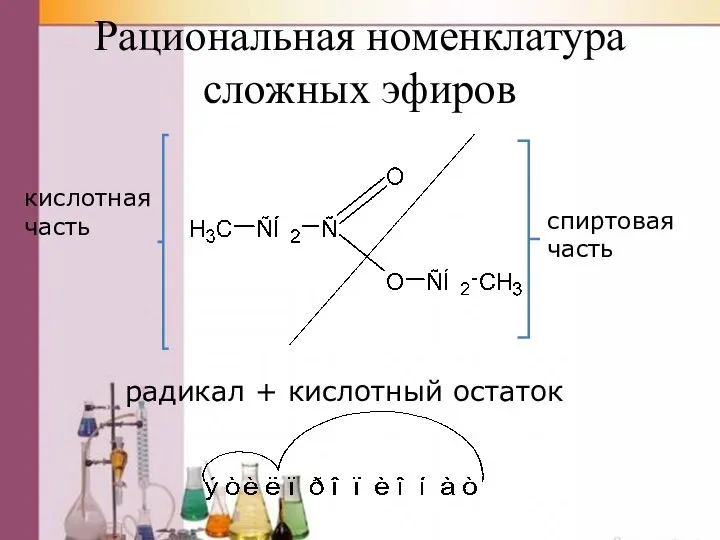
- 36. Рациональная номенклатура сложных эфиров кислотная часть спиртовая часть радикал + кислотный остаток
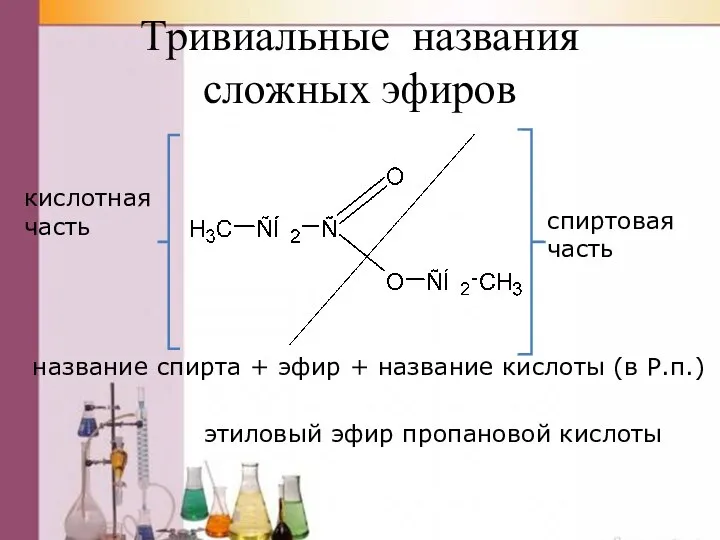
- 37. Тривиальные названия сложных эфиров кислотная часть спиртовая часть название спирта + эфир + название кислоты (в
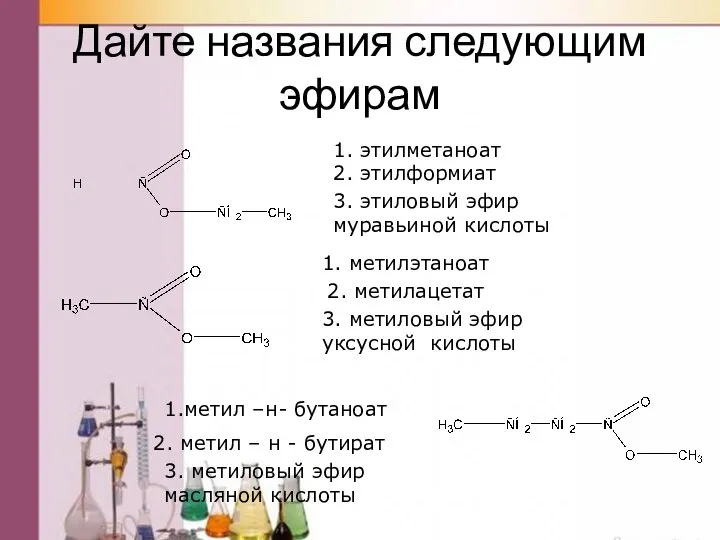
- 38. Дайте названия следующим эфирам 1.метил –н- бутаноат 2. метил – н - бутират 3. метиловый эфир
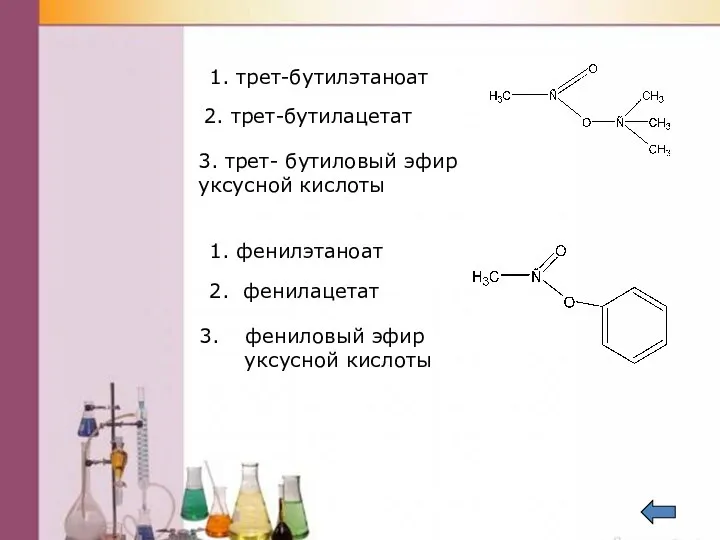
- 39. 1. трет-бутилэтаноат 2. трет-бутилацетат 3. трет- бутиловый эфир уксусной кислоты 1. фенилэтаноат 2. фенилацетат фениловый эфир
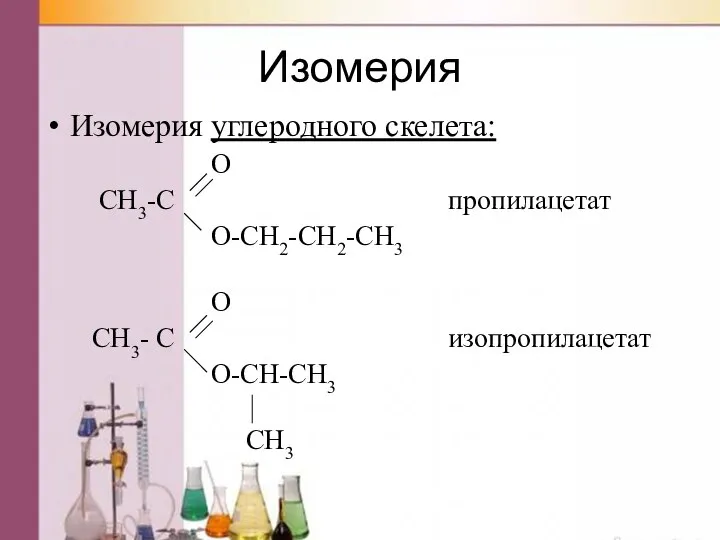
- 40. Изомерия Изомерия углеродного скелета: O CH3-C пропилацетат O-CH2-CH2-CH3 O CH3- C изопропилацетат O-CH-CH3 CH3
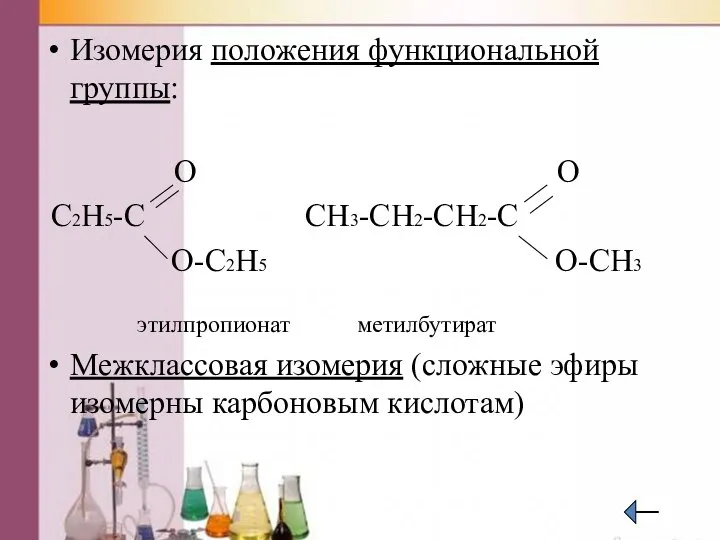
- 41. Изомерия положения функциональной группы: O O C2H5-C CH3-CH2-CH2-C O-C2H5 O-CH3 этилпропионат метилбутират Межклассовая изомерия (сложные эфиры
- 42. Физические свойства Эфиры- летучие жидкости, мало растворимы в воде, хорошие растворители, обладают приятным запахом.
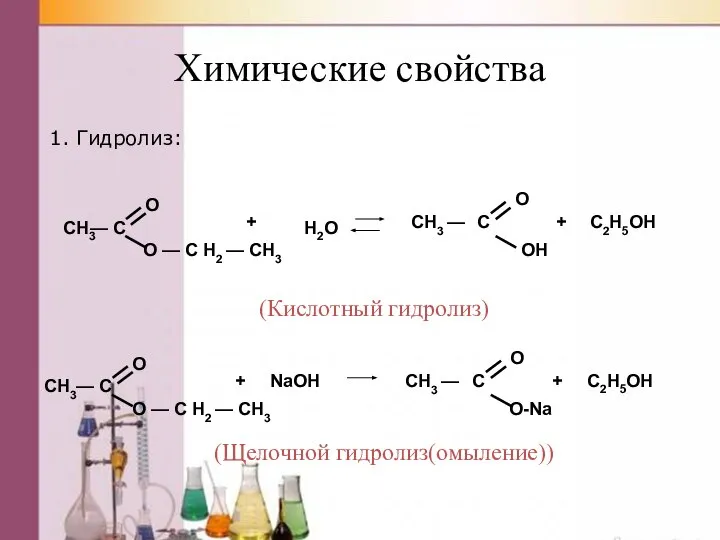
- 43. Химические свойства 1. Гидролиз: (Щелочной гидролиз(омыление)) (Кислотный гидролиз)
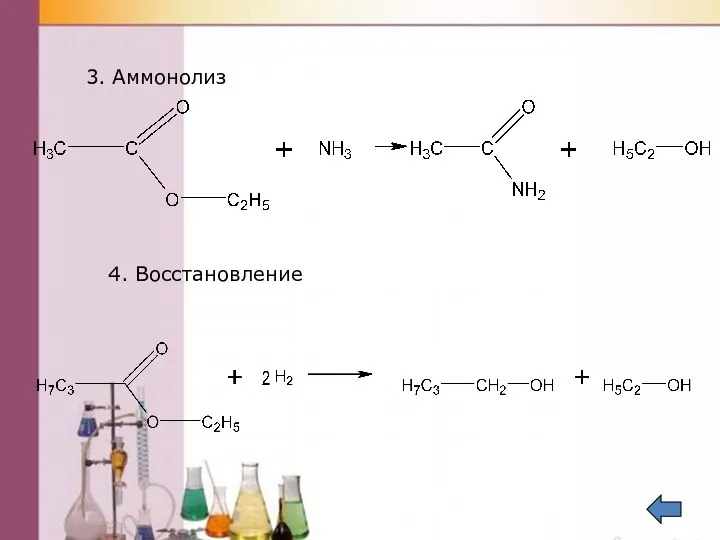
- 44. 3. Аммонолиз 4. Восстановление
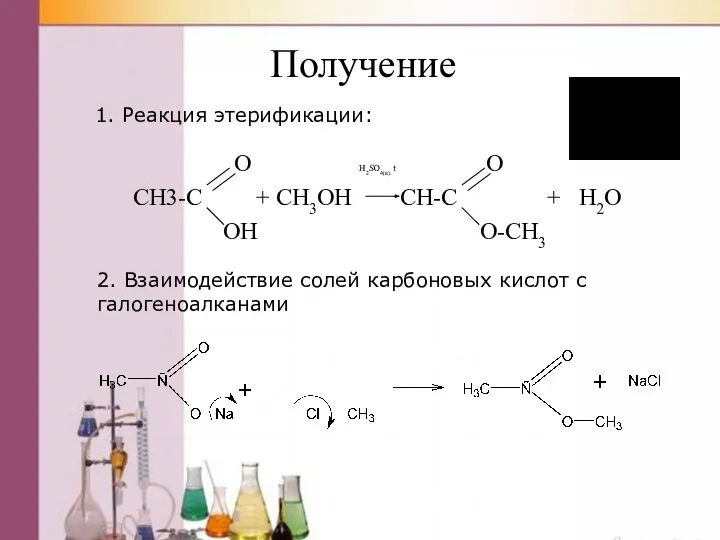
- 45. Получение O H2SO4(к). t O CH3-C + CH3OH CH-C + H2O OH O-CH3 2. Взаимодействие солей
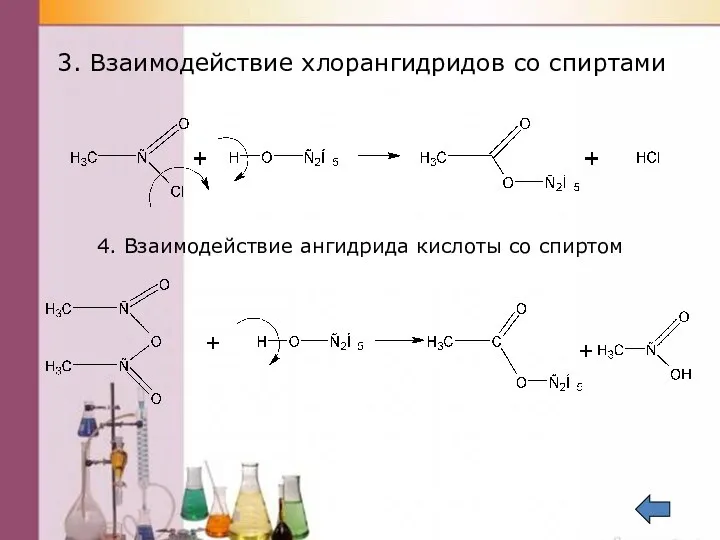
- 46. 3. Взаимодействие хлорангидридов со спиртами 4. Взаимодействие ангидрида кислоты со спиртом
- 47. Сложные эфиры используются: Как растворители, пластификаторы, ароматизаторы (этилформиат, изобутилформиат, бензилформиат, фенилэтилформиат, изоамилацетат, н-октилацетат, изоамилизовалерат) В пищевой
- 48. План изучения жиров: Номенклатура Физические свойства Химические свойства Применение Получение
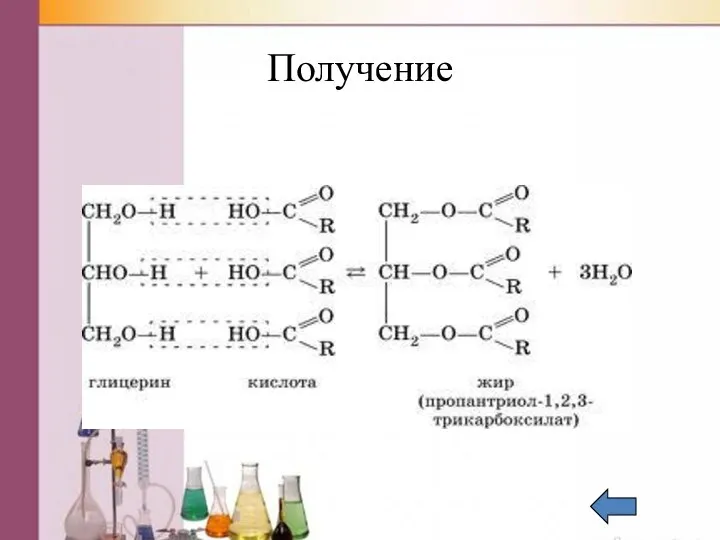
- 49. Жиры Жиры – это сложные эфиры трёхатомного спирта глицерина и высших карбоновых кислот.
- 50. Номенклатура По тривиальной номенклатуре глицериды называют, добавляя окончание -ид к сокращенному названию кислоты и приставку, показывающую,
- 51. Физические свойства Жиры не растворимы в воде Плотность их меньше 1г/см3 Если при комнатной температуре они
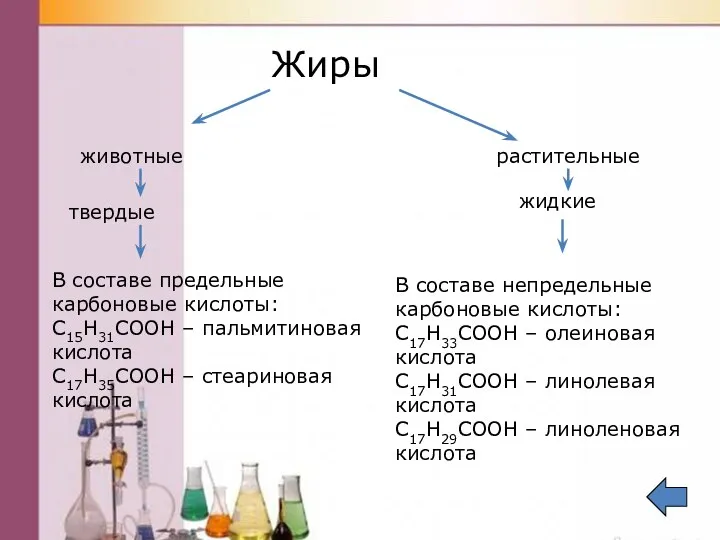
- 52. Жиры животные растительные твердые жидкие В составе предельные карбоновые кислоты: С15Н31СООН – пальмитиновая кислота С17Н35СООН –
- 53. Химические свойства жиров: 1. Водный гидролиз: С3H5(COO)3-R + 3H2O ↔ C3H5(OH)3 + 3RCOOH 2. Щелочной гидролиз(омыление):
- 54. Применение Пищевая промышленность (в частности, кондитерская). Фармацевтика Производство мыла и косметических изделий Производство смазочных материалов
- 55. Получение
- 56. Тестовые задания для самостоятельного определения уровня усвоения материала Вариант 1 «Карбоновые кислоты» Вариант 2 «Сложные эфиры»
- 57. Карбоновые кислоты Укажите наиболее сильную из перечисленных карбоновых кислот. 1) СН3СООН 2) Н2N-СН2СООН 3)Сl-СН2СООН 4) СF3СООН
- 58. Уксусная кислота не взаимодействует с 1) CuO 2) Cu(OH)2 3) Na2CO3 4) Na2SO4 Подумай! Подумай! Подумай!
- 59. Муравьиная кислота взаимодействует с 4) оксидом азота (II) 3) аммиачным раствором оксида серебра 2) гидросульфатом натрия
- 60. 9 правильных ответа – ты усвоил материал 7 - 8 правильных ответов – ты знаешь материал
- 61. Метиловый эфир уксусной кислоты и метилацетат являются Сложные эфиры 2. Продуктами гидролиза сложных эфиров состава С5Н10О2
- 62. 4. Метилацетат можно получить взаимодействием: 1) метановой кислоты и бутанола 2) метановой кислоты и пропанола 3)
- 63. 2. Твердые жиры вступают в реакцию с 1. Жидкие растительные масла не вступают в реакцию с
- 64. 3. В результате гидролиза жидкого жира образуются 1) твердые жиры и глицерин 2) глицерин и предельные
- 65. Оцени свои знания: 5 правильных ответов – ты усвоил материал 4 правильных ответа – ты знаешь
- 66. Автор работы Ахметшина Зиля Фанисовна ученица 10 а класса МБОУ «СОШ № 3 п.г.т. Кукмор» Кукморского
- 68. Скачать презентацию

















![O H-C OH -муравьиная кислота-альдегидокислота Как альдегид: HCOOH+2[Ag(NH3)2]OH Аg+NH4HCO3+3NH3+H2O (реакция «серебряного](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1407602/slide-26.jpg)























 Классификация высокомолекулярных соединений
Классификация высокомолекулярных соединений Картофельное пюре быстрого приготовления
Картофельное пюре быстрого приготовления Окисно-відновні реакції та їхнє значення
Окисно-відновні реакції та їхнє значення Основы химической кинетики
Основы химической кинетики Заттардың агрегаттық күйлері
Заттардың агрегаттық күйлері Синтез и свойства КФ - смол, модифицированных производными меламина
Синтез и свойства КФ - смол, модифицированных производными меламина Разработка препаративных методик получения фосфатсодержащих производных бетулина с улучшенной растворимостью в воде
Разработка препаративных методик получения фосфатсодержащих производных бетулина с улучшенной растворимостью в воде Основные классы неорганических веществ
Основные классы неорганических веществ Липиды. Классификация
Липиды. Классификация Физико-химия полимеров и их растворов
Физико-химия полимеров и их растворов Однолучевой спектрофотометр
Однолучевой спектрофотометр Электрондардың атомдарда орналасуы
Электрондардың атомдарда орналасуы Горно-химическое сырье
Горно-химическое сырье Структура електронної оболонки атома
Структура електронної оболонки атома Общая характеристика неметаллов
Общая характеристика неметаллов Фармакодинамика лекарственных средств
Фармакодинамика лекарственных средств Презентация по химии Кислоты 8 класс
Презентация по химии Кислоты 8 класс Поверхностные явления. Типы поверхностных явлений
Поверхностные явления. Типы поверхностных явлений Антигистаминные препараты
Антигистаминные препараты Физическая технология топлива. Требования, предъявляемые к дизельным топливам
Физическая технология топлива. Требования, предъявляемые к дизельным топливам Теория гибридизации. (Лекция 3)
Теория гибридизации. (Лекция 3) Почва. Интегрированный урок по химии и географии
Почва. Интегрированный урок по химии и географии Кислородные соединения азота
Кислородные соединения азота Оксид кремния
Оксид кремния Химия в повседневной жизни человека
Химия в повседневной жизни человека СПИРТЫ Урок химии в 9-10 классе
СПИРТЫ Урок химии в 9-10 классе Целлюлоза
Целлюлоза  Биохимические функции железа
Биохимические функции железа