Содержание
- 2. План: Классификация неорганических веществ - оксиды - гидроксиды (гидраты оксидов) - кислоты - соли 2) Общие
- 3. Оксиды Сложные вещества, состоящие из двух элементов, один из которых кислород в степени окисления -2 ЭmОn
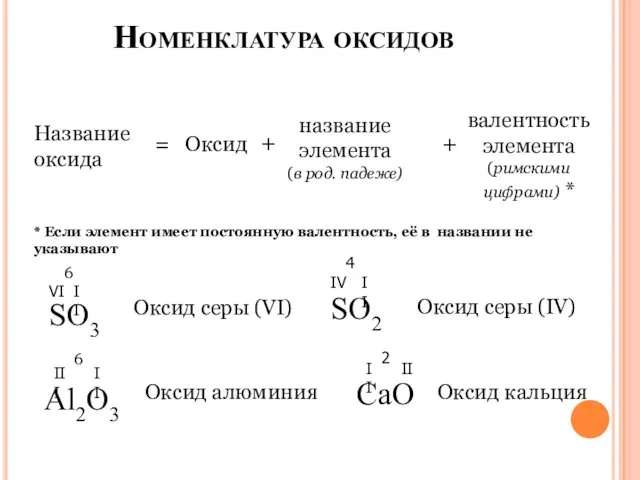
- 4. Номенклатура оксидов Название оксида = Оксид + название элемента (в род. падеже) + валентность элемента (римскими
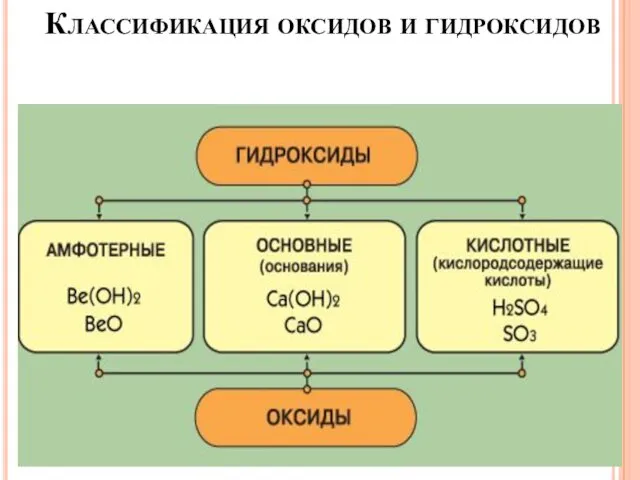
- 5. Классификация оксидов и гидроксидов
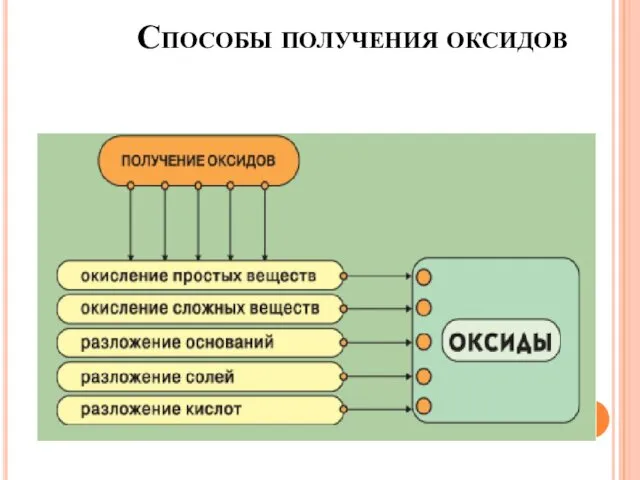
- 6. Способы получения оксидов
- 7. Способы получения оксидов Mg + O2 → 2 2 MgO CH4 + O2 CO2 + H2O
- 8. Химические свойства оксидов Химические свойства основных оксидов 1. Основный оксид + кислота = соль + Н2О
- 9. Химические свойства оксидов Химические свойства кислотных оксидов 1. Кислотный оксид + основание = соль + Н2О
- 10. Химические свойства оксидов Химические свойства амфотерных оксидов 1. Амфотерный оксид + кислота = соль + Н2О
- 11. Основания Сложные вещества, молекулы которых состоят из атома металла и одной или нескольких гидроксидных групп -
- 12. Номенклатура оснований Название основания = Гидроксид + название металла (в род. падеже) + валентность металла (римскими
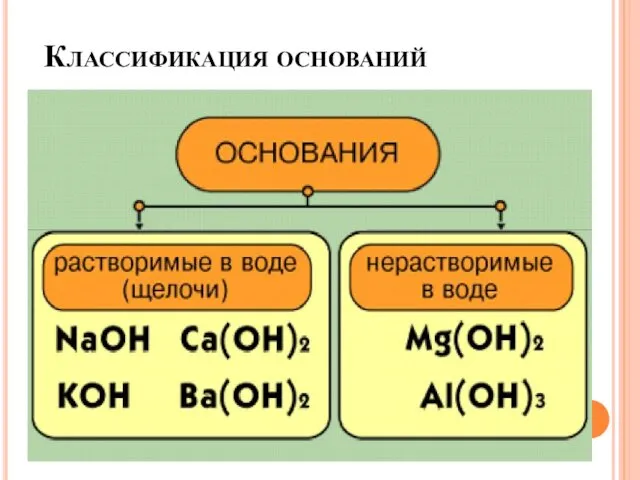
- 13. Классификация оснований
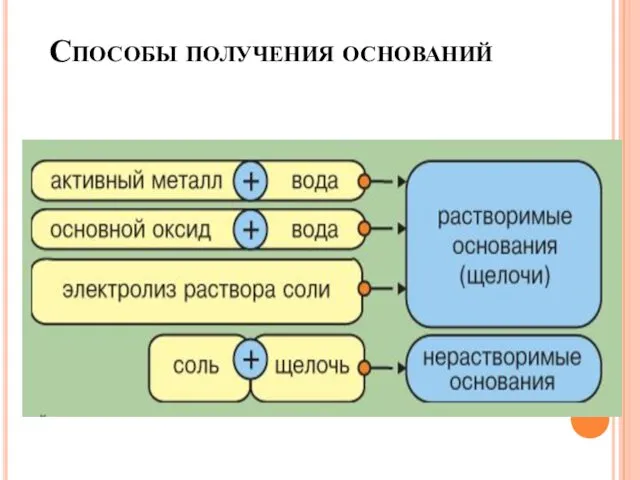
- 14. Способы получения оснований
- 15. Способы получения оснований Получение растворимых оснований (щелочей) 1. Активный металл* + Н2О = щелочь + Н2↑
- 16. Способы получения оснований Получение нерастворимых оснований 1. Соль + щелочь = соль + основание ↓ FeSO4
- 17. Химические свойства оснований Общие свойства оснований объясняются наличием в их растворах ионов ОН- Me(OH)y ↔ Mey+
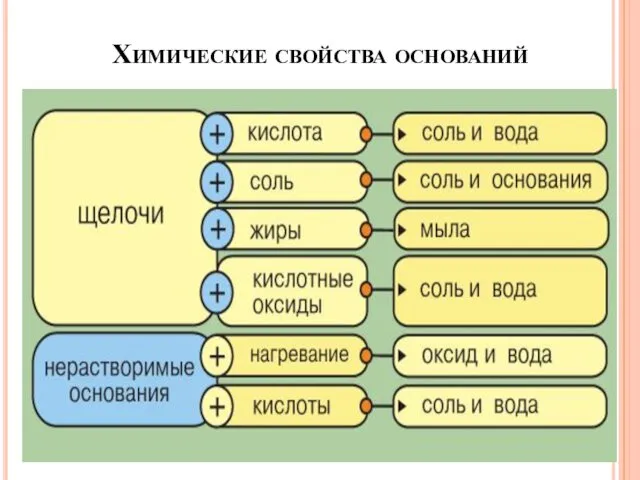
- 18. Химические свойства оснований
- 19. Химические свойства оснований Химические свойства щелочей 1. Щелочь + кислота = соль +Н2О NaOH + HCl
- 20. Химические свойства оснований Химические свойства нерастворимых оснований 1. Нерастворимое основание = оксид +Н2О t0 Cu(OH)2 =
- 21. Кислоты Сложные вещества, содержащие атомы водорода, способные замещаться атомами металла, и кислотный остаток Нx(Ас)
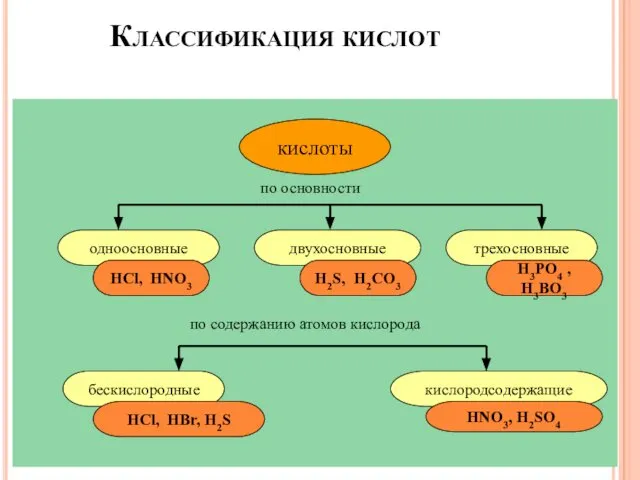
- 22. Классификация кислот кислоты по основности одноосновные двухосновные HCl, HNO3 H2S, H2CO3 трехосновные H3PO4 , H3BO3 по
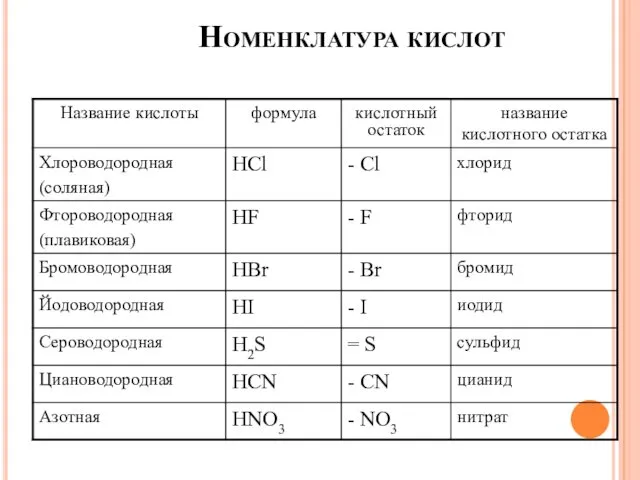
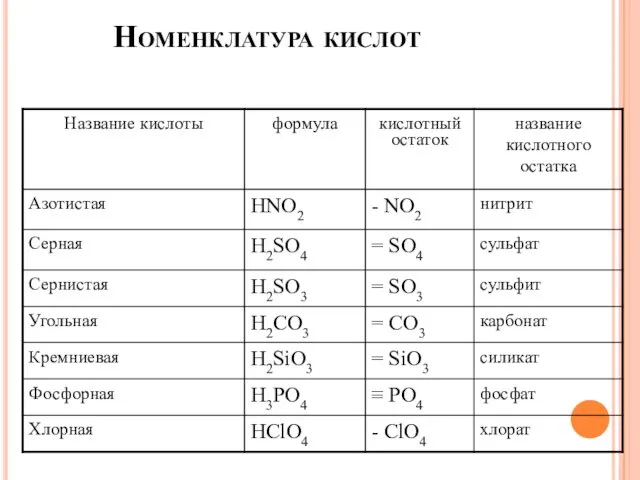
- 23. Номенклатура кислот
- 24. Номенклатура кислот
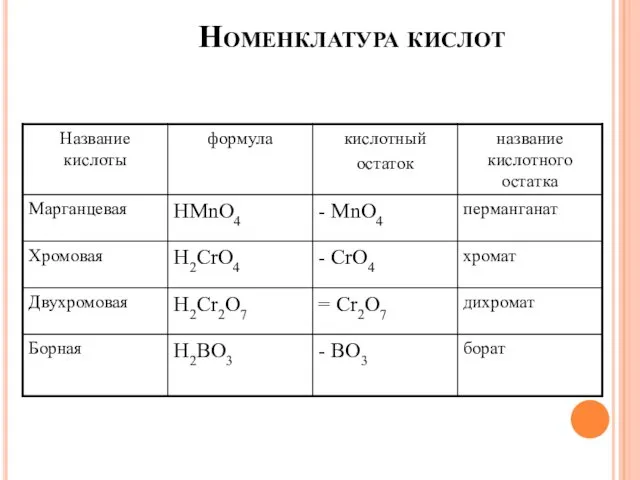
- 25. Номенклатура кислот
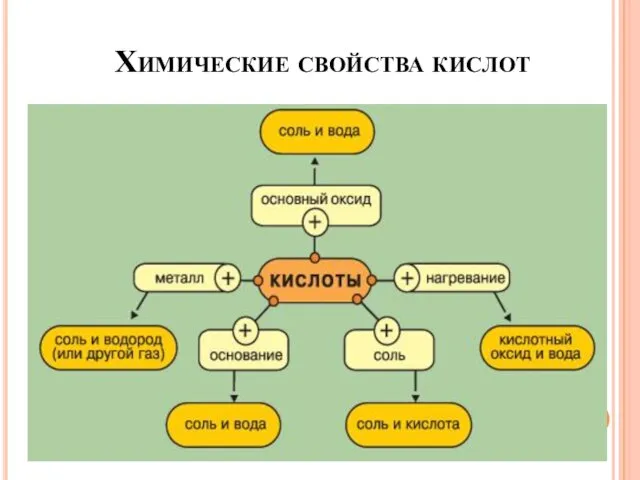
- 26. Химические свойства кислот
- 27. Химические свойства кислот Общие свойства кислот в водных растворах обусловлены присутствием ионов Н+ НАс ↔ Н+
- 28. Химические свойства кислот 1. Кислота + оксид Ме = соль + Н2О 2HCl + CaO =
- 29. Химические свойства кислот 4. Кислота* + Me** = соль + H2↑ * Не брать для реакции
- 30. Соли Сложные вещества, которые являются продуктами замещения атомов водорода в молекулах кислот атомами металла или продуктами
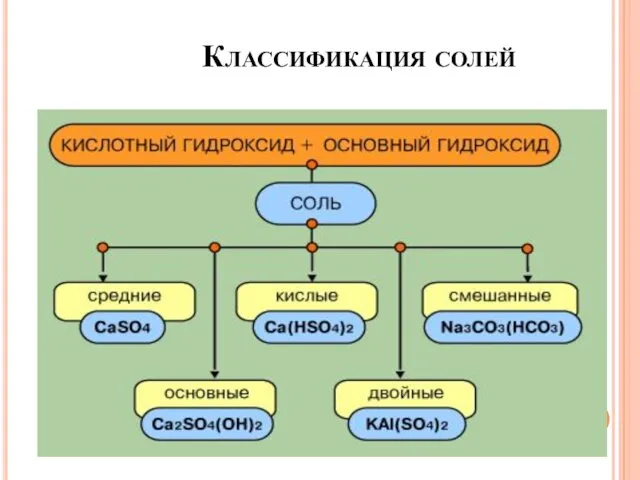
- 31. Классификация солей
- 32. Номенклатура солей Название средней соли = название кислотного остатка + название металла (в род. падеже) валентность
- 33. Номенклатура солей Название кислой соли = гидро* или дигидро + название кислотного остатка + название металла
- 34. Номенклатура солей Название основной соли = гидроксо* или дигидроксо + название кислотного остатка + название металла
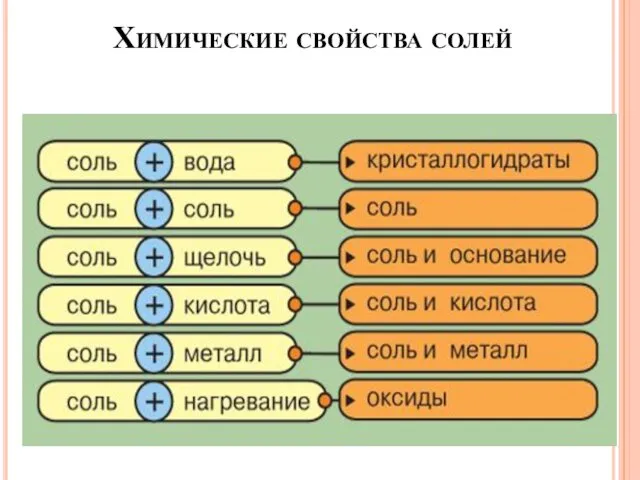
- 35. Химические свойства солей
- 36. Химические свойства солей Соль + соль → др. соль + другая соль (↓) AgNO3 + KCl
- 37. Химические свойства солей 4. Соль + Ме (I) → другая соль + другой Ме (II) *
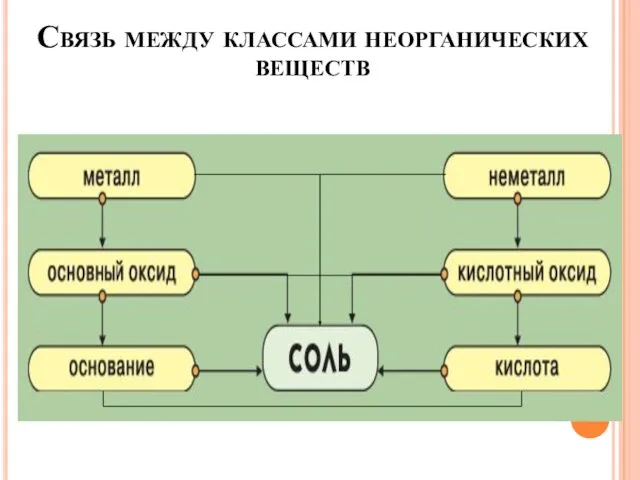
- 38. Связь между классами неорганических веществ
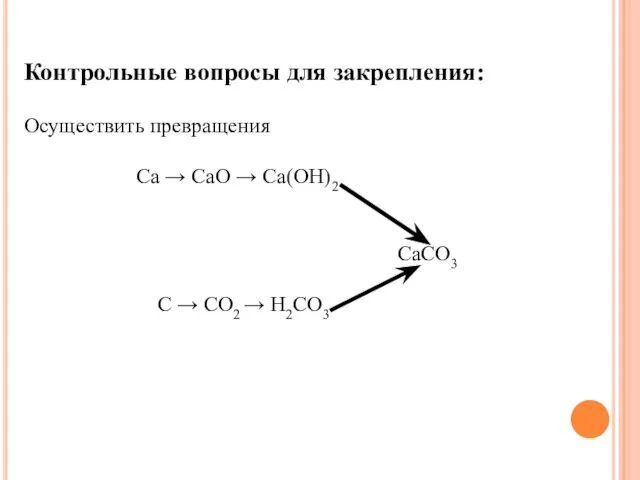
- 39. Контрольные вопросы для закрепления: Осуществить превращения Ca → CaO → Ca(OH)2 CaCO3 C → CO2 →
- 41. Скачать презентацию























 Инсектициды на основе бакуловирусов
Инсектициды на основе бакуловирусов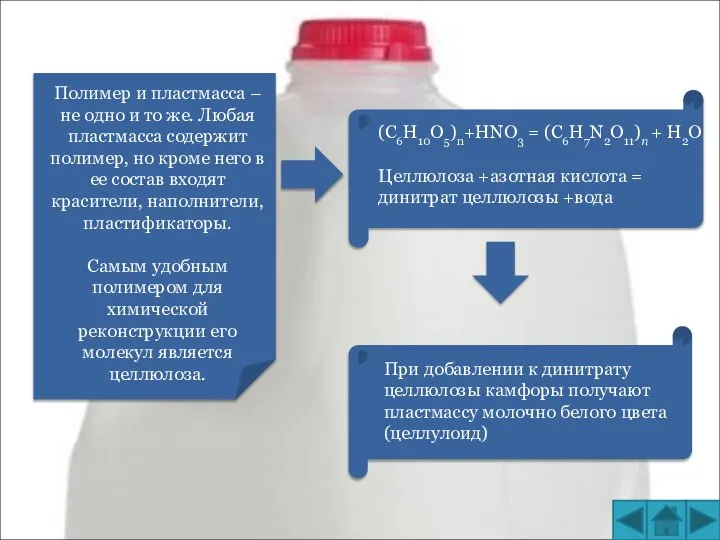 Полимер и пластмасса
Полимер и пластмасса Металлы в нашей жизни
Металлы в нашей жизни Сложные эфиры
Сложные эфиры Металлы и их соединения
Металлы и их соединения Властивості етанової (оцтової) кислоти
Властивості етанової (оцтової) кислоти Елементарний склад живих організмів
Елементарний склад живих організмів Структурно-механические свойства дисперсных систем
Структурно-механические свойства дисперсных систем Протеины: плюсы и минусы
Протеины: плюсы и минусы Излучение и поглощение света атомами. Виды спектров, спектральный анализ
Излучение и поглощение света атомами. Виды спектров, спектральный анализ Относительная атомная масса
Относительная атомная масса Биодизельное топливо
Биодизельное топливо Неметалічні елементи
Неметалічні елементи Бромды метил буының концентрациясын анықтау тәсілдемесі
Бромды метил буының концентрациясын анықтау тәсілдемесі Металлдардың кристалдық құрылымы
Металлдардың кристалдық құрылымы Поняття про лікарські препарати Підготували Стебко Марія, Бондар Аліна 11-Ф
Поняття про лікарські препарати Підготували Стебко Марія, Бондар Аліна 11-Ф  Закон постоянства состава веществ
Закон постоянства состава веществ Аргентум (Срібло)
Аргентум (Срібло) Мило. Синтетичні миючі засоби.
Мило. Синтетичні миючі засоби.  Растворы электролитов. Буферные растворы. Лекция 4
Растворы электролитов. Буферные растворы. Лекция 4 Аммиак. Физические и химические свойства. Получение и применение
Аммиак. Физические и химические свойства. Получение и применение Обмен железа и его нарушения
Обмен железа и его нарушения Презентация по Химии "Окислительно-восстановительные реакции" - скачать смотреть бесплатно
Презентация по Химии "Окислительно-восстановительные реакции" - скачать смотреть бесплатно Кетоны
Кетоны Альдегиды. Строение молекулы
Альдегиды. Строение молекулы Элементы третьего периода, периодической системы Д. И. Менделеева
Элементы третьего периода, периодической системы Д. И. Менделеева Нанохімія та нанотехнології
Нанохімія та нанотехнології Allgemeine Chemie für PharmazeutInnen
Allgemeine Chemie für PharmazeutInnen