Содержание
- 3. Положение неметаллов в ПСХЭ Строение атомов Строение простых веществ: вид химической связи и тип кристаллической решетки
- 4. Неметаллы – химические элементы, для атомов которых характерна способность принимать электроны до завершения внешнего слоя благодаря
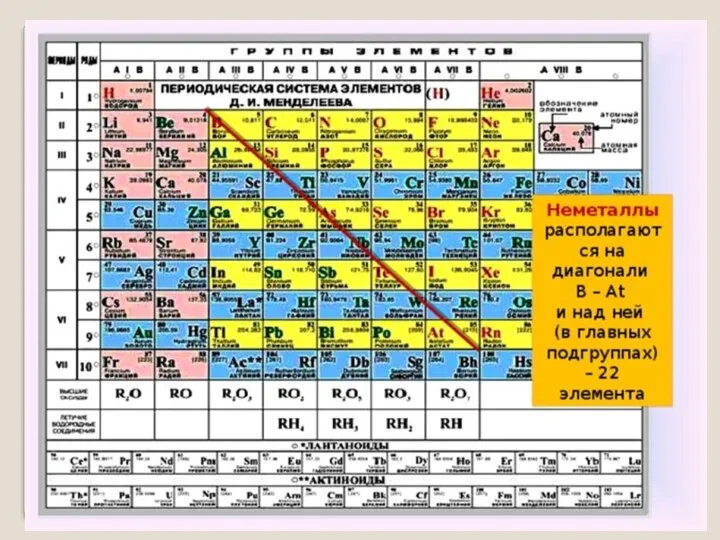
- 5. Периодическая система Д. И. Менделеева
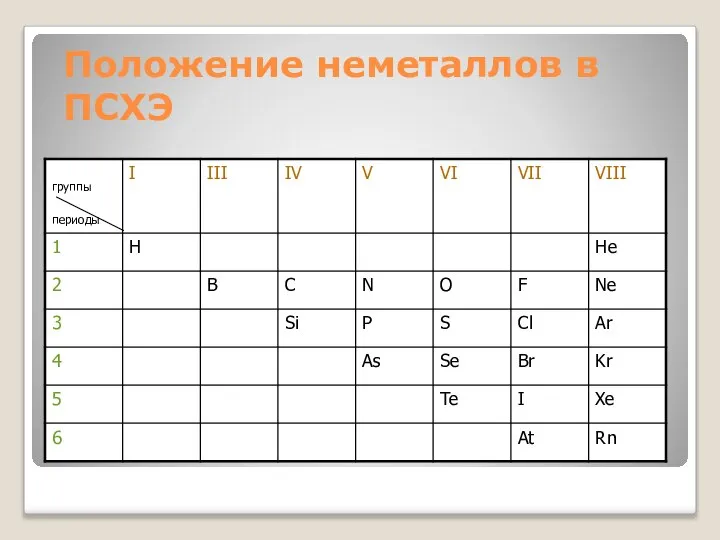
- 7. Положение неметаллов в ПСХЭ
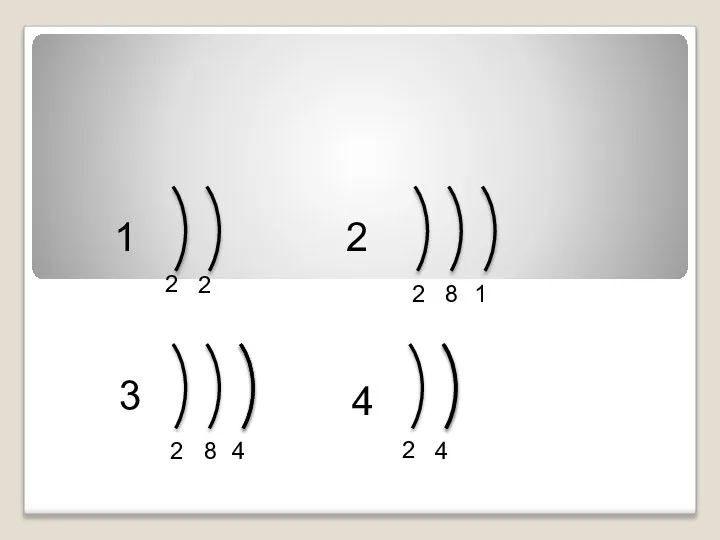
- 8. 1 2 3 4 2 2 2 8 1 2 8 4 2 4
- 9. Небольшой атомный радиус На внешнем уровне 4-8 электронов Характерно высокое значение ЭО Являются окислителями
- 10. Электронная формула атомов неметаллов
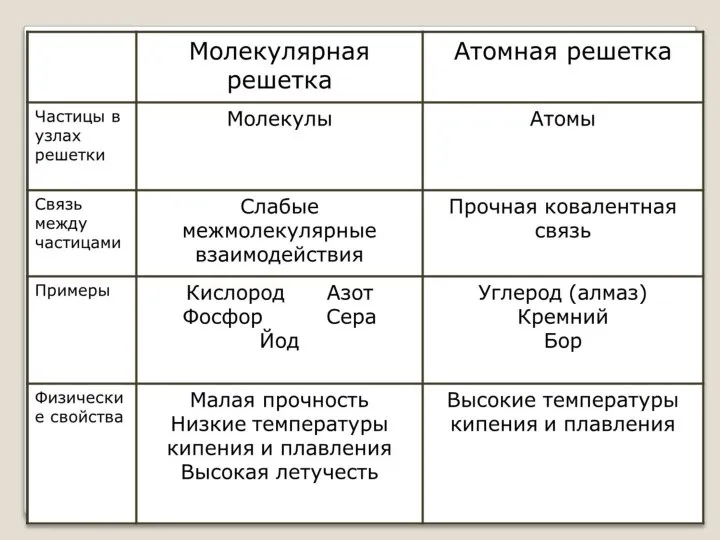
- 11. Типы кристаллических решеток
- 12. ФИЗИЧЕСКИЕ СВОЙСТВА ПРОСТЫХ ВЕЩЕСТВ
- 13. Цвет простых веществ - неметаллов
- 14. КРАСНЫЙ ЖЕЛТЫЙ ФИОЛЕТОВЫЙ ФОСФОР СЕРА ЙОД БЕСЦВЕТНЫЙ УГЛЕРОД
- 15. БЕЛЫЙ ЧЕРНЫЙ ФОСФОР ФОСФОР ГРАФИТ ЖЕЛТО-ЗЕЛЕНЫЙ ХЛОР
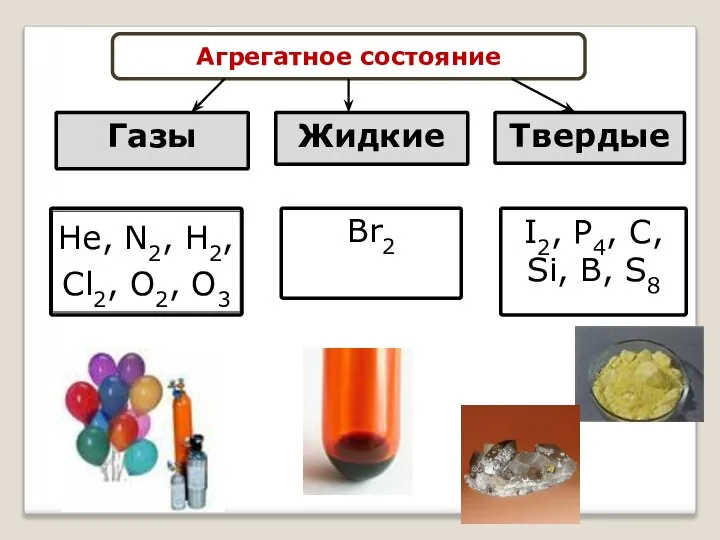
- 16. Агрегатное состояние Газы Жидкие Твердые Br2 I2, P4, C, Si, B, S8
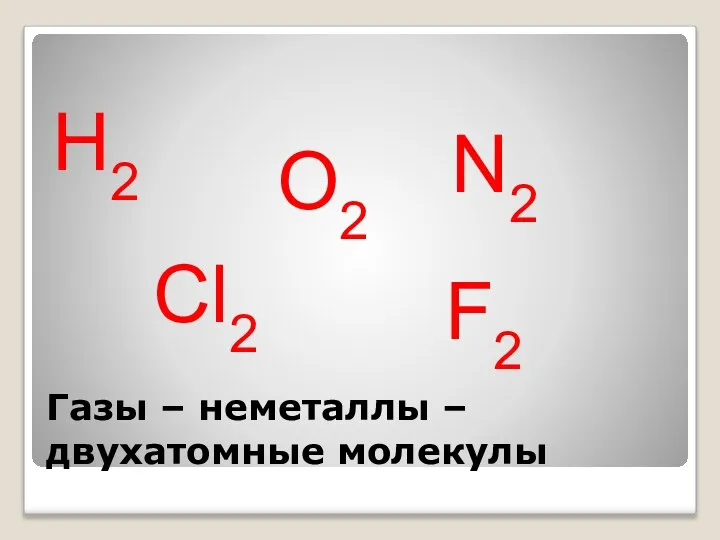
- 17. Газы – неметаллы – двухатомные молекулы Н2 О2 N2 Cl2 F2
- 18. Температура плавления 3 8000 С – у графита - 2100 С - азота
- 19. ЧЕГО БОЛЬШЕ: ХИМИЧЕСКИХ ЭЛЕМЕНТОВ ИЛИ ПРОСТЫХ ВЕЩЕСТВ
- 20. Способность атомов одного химического элемента образовывать несколько простых веществ называют аллотропией, а эти простые вещества –
- 21. Разное типы кристаллических решеток Р - фосфор Красный фосфор - атомная Белый фосфор - молекулярная
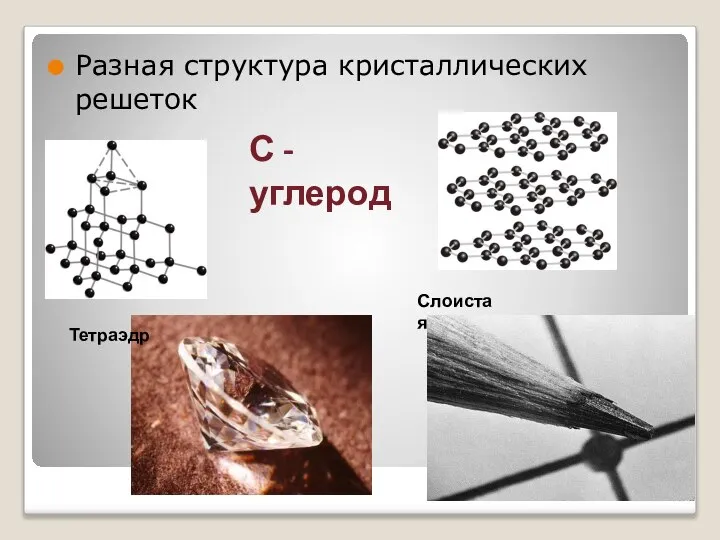
- 22. Разная структура кристаллических решеток С - углерод Тетраэдр Слоистая
- 23. Разный состав молекул О - кислород Кислород Озон
- 24. Значение озона для Земли Задерживает ультрафиолетовые лучи, которые разрушительно действуют на клетки живых организмов Озоновый слой
- 25. Озон О3 Светло - синий газ с сильным запахом Имеет запах свежести Появляется после грозы
- 26. Озон в природе Содержится в воздухе сосновых лесов и морского побережья
- 27. Получение озона в лаборатории Получают в специальных приборах – озонаторах при действии на кислород электрическим разрядом
- 28. В конце 18 века А-Л. Лавуазье установил, что воздух – не простое вещество. а смесь газов
- 29. Состав воздуха
- 30. Постоянные составные воздуха Азот Кислород Благородные газы
- 31. Переменные составные воздуха Углекислый газ Водяные пары Озон
- 32. Случайные составные воздуха Пыль Микроорганизмы Пыльца растений Оксиды серы и азота
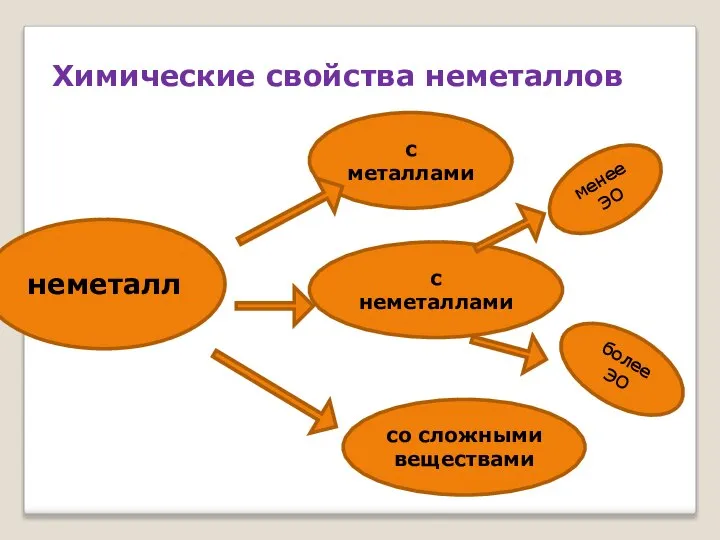
- 33. неметалл с металлами с неметаллами со сложными веществами менее ЭО более ЭО Химические свойства неметаллов
- 34. Характерными для большинства неметаллов являются окислительные свойства. Как окислители они реагируют с металлами: Ca + Cl2
- 35. с неметаллами: H2 + S = H2S P4 + 5O2 = 2P2O5 2P + 5Cl2 =
- 36. ВАРИАНТ 1 ВАРИАНТ -2 1 - А 2 - Б 3 – В 4 – Б
- 39. Скачать презентацию




























 Физико-химия поверхностных явлений. Основы адсорбционной терапии
Физико-химия поверхностных явлений. Основы адсорбционной терапии Класифікація неорганічних сполук
Класифікація неорганічних сполук Уроки зельеварения. Задача 6
Уроки зельеварения. Задача 6 Предмет, задачи, понятия, законы химии
Предмет, задачи, понятия, законы химии Термодинамические свойства газов
Термодинамические свойства газов Химическое равновесие. Необратимые и обратимые реакции
Химическое равновесие. Необратимые и обратимые реакции Морфология тел полезных ископаемых
Морфология тел полезных ископаемых Презентация по Химии "Белки" - скачать смотреть бесплатно_
Презентация по Химии "Белки" - скачать смотреть бесплатно_ Применение аммиака и солей аммония
Применение аммиака и солей аммония Кислотно-основные равновесия
Кислотно-основные равновесия Поверхностное упрочнение деталей. (Лекция 11)
Поверхностное упрочнение деталей. (Лекция 11) Презентация по химии на тему: «Применение кислорода»
Презентация по химии на тему: «Применение кислорода» Перманганат калия
Перманганат калия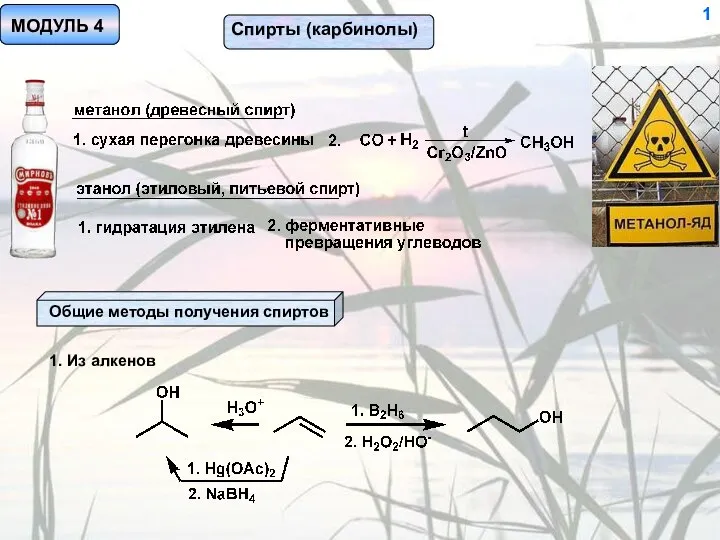 Спирты (карбинолы)
Спирты (карбинолы) Методы исследования наносистем и наноматериалов. Классификация физико-химических методов исследования
Методы исследования наносистем и наноматериалов. Классификация физико-химических методов исследования Отраслевые стандарты качества лекарственных средств: GMP, GLP, GSP, GDP, GPP, GCP и другие
Отраслевые стандарты качества лекарственных средств: GMP, GLP, GSP, GDP, GPP, GCP и другие Обмен веществ. Метаболизм и его функции
Обмен веществ. Метаболизм и его функции Идентификация органических веществ
Идентификация органических веществ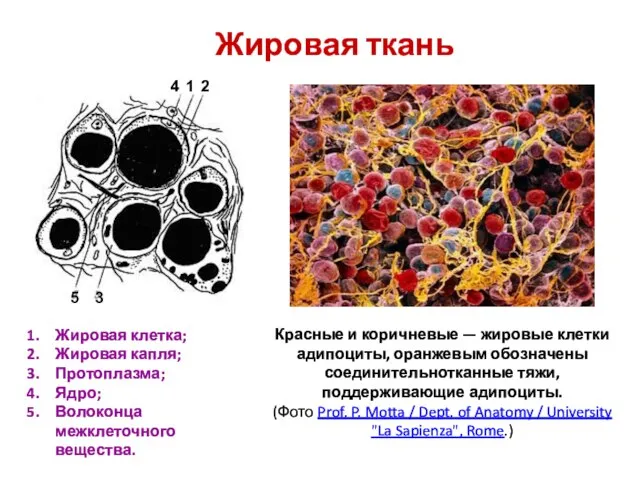 Жировая ткань
Жировая ткань Презентация по Химии "Анализ тенденций развития химии" - скачать смотреть
Презентация по Химии "Анализ тенденций развития химии" - скачать смотреть  Ауылшаруашылық дақылдарының тұқымдарын фунгецидтермен улау және химиялық қорғау тәсілдерінің биологиялық
Ауылшаруашылық дақылдарының тұқымдарын фунгецидтермен улау және химиялық қорғау тәсілдерінің биологиялық Кольорові метали
Кольорові метали 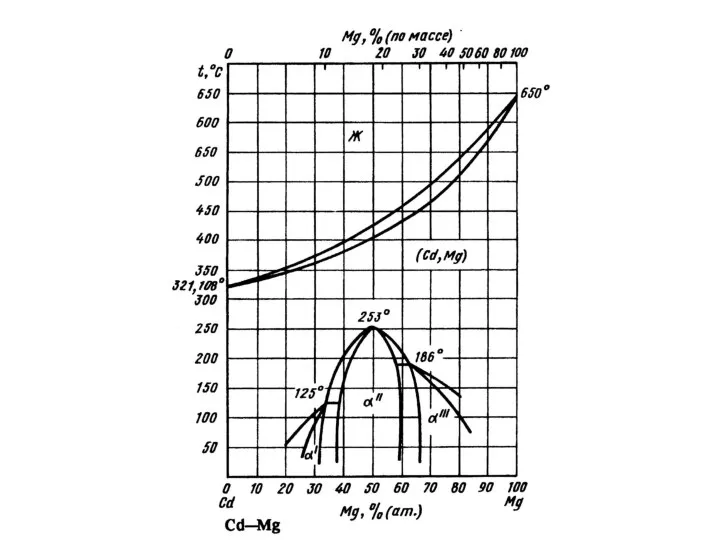 Промежуточные фазы
Промежуточные фазы Смеси и растворы
Смеси и растворы Липидтердің метаболизмі
Липидтердің метаболизмі Аттестационная работа. Образовательная программа элективного курса Химия вокруг нас
Аттестационная работа. Образовательная программа элективного курса Химия вокруг нас В таблиці я ― відомий елемент, Та літеру зміни з одного боку, Переконаєшся в один момент, Що я не елемент вже, а протока. Метаграми
В таблиці я ― відомий елемент, Та літеру зміни з одного боку, Переконаєшся в один момент, Що я не елемент вже, а протока. Метаграми  ЕГЭ по химии
ЕГЭ по химии