Разработка препаративных методик получения фосфатсодержащих производных бетулина с улучшенной растворимостью в воде
Содержание
- 2. ЛУПЕОЛ БЕТУЛИН БЕТУЛИНОВАЯ КИСЛОТА АКТУАЛЬНОСТЬ ИССЛЕДОВАТЕЛЬСКОЙ РАБОТЫ Бетулин и его производные, выделяемые из растительного сырья, обладают
- 3. Способность к образованию устойчивых ассоциатов и комплексов включения; 1 2 3 5 6 Лабильность циклической структуры
- 4. Оптимизация синтеза 3β-фосфата аллобетулина и стабильных структурных модификаций 3β,28-дифосфата бетулина с улучшенной растворимостью в воде. ФОРМУЛИРОВКА
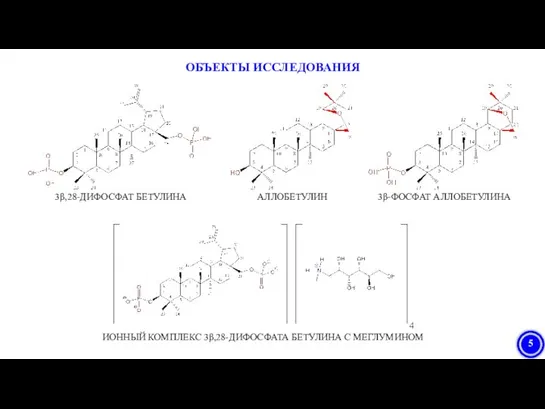
- 5. ОБЪЕКТЫ ИССЛЕДОВАНИЯ 3β,28-ДИФОСФАТ БЕТУЛИНА АЛЛОБЕТУЛИН 3β-ФОСФАТ АЛЛОБЕТУЛИНА ИОННЫЙ КОМПЛЕКС 3β,28-ДИФОСФАТА БЕТУЛИНА С МЕГЛУМИНОМ
- 6. ФОСФОРИЛИРОВАНИЕ БЕТУЛИНА В ПРИСУТСТВИИ АКЦЕПТОРА ПРОТОНОВ * 9,82; 9,79; 2,77; 2,75 – пиридиний-хлоридные комплексы ОТКУДА ВЗЯЛСЯ
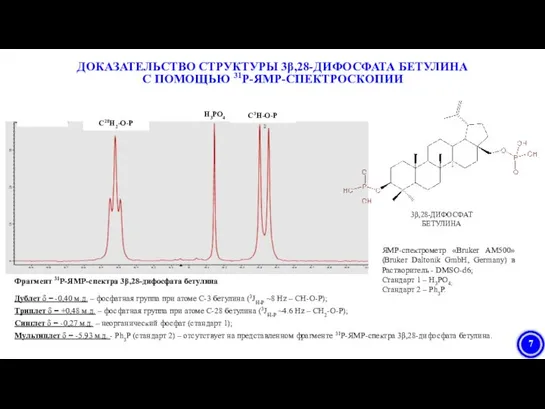
- 7. Фрагмент 31Р-ЯМР-спектра 3β,28-дифосфата бетулина Дублет δ = -0,40 м.д. – фосфатная группа при атоме С-3 бетулина
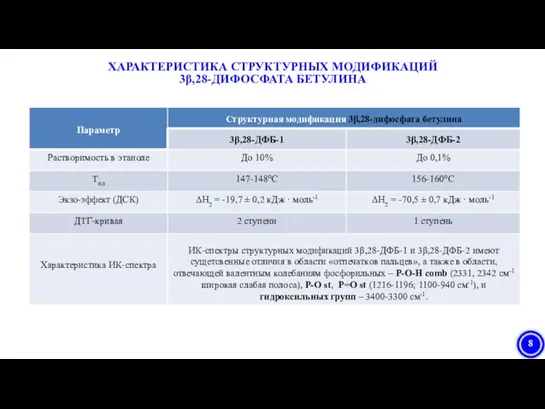
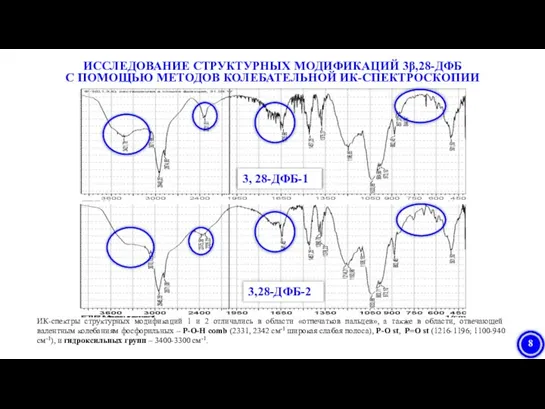
- 8. ХАРАКТЕРИСТИКА СТРУКТУРНЫХ МОДИФИКАЦИЙ 3β,28-ДИФОСФАТА БЕТУЛИНА
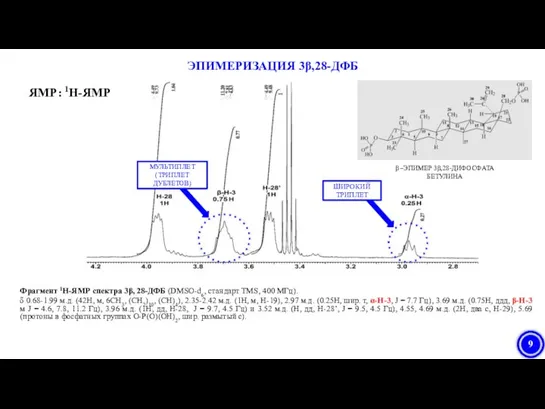
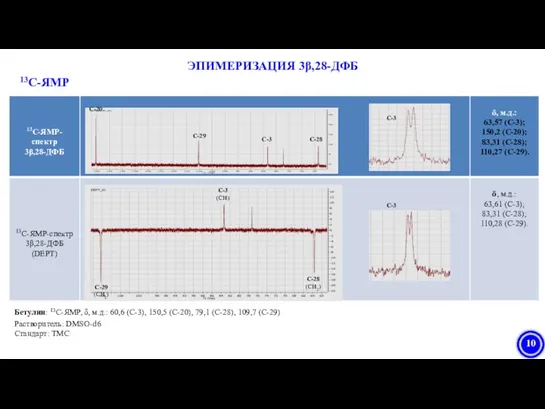
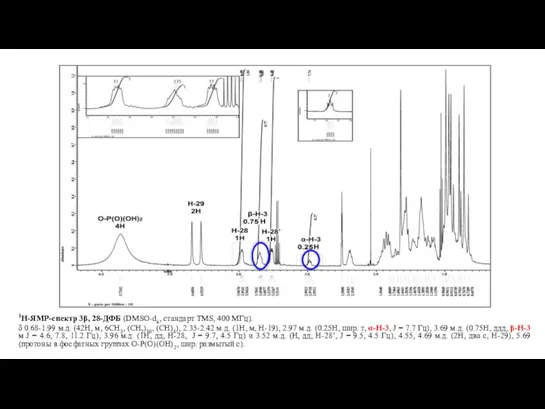
- 9. Фрагмент 1H-ЯМР спектра 3β, 28-ДФБ (DMSO-d6, стандарт TMS, 400 МГц). δ 0.68-1.99 м.д. (42H, м, 6CH3,
- 10. С-3 С-3 (СH) С-28 С-28 (CH2) С-20 С-29 С-29 (CH2) С-3 С-3 Растворитель: DMSO-d6 Стандарт: ТМС
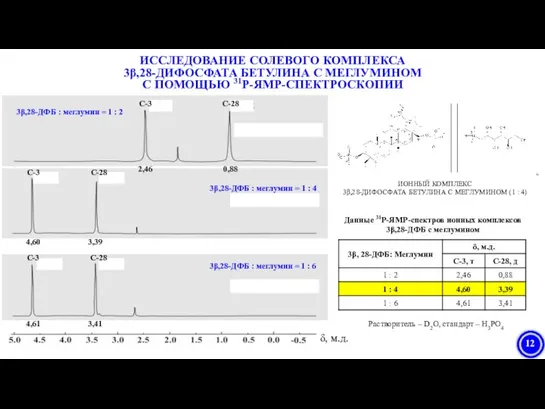
- 11. ПОЛУЧЕНИЕ СОЛЕВЫХ КОМПЛЕКСОВ 3β,28-ДИФОСФАТА БЕТУЛИНА С МЕГЛУМИНОМ И ИССЛЕДОВАНИЕ ИХ РАСТВОРИМОСТИ В ВОДЕ 3β,28-ДИФОСФАТ(V) БЕТУЛИНА ИОННЫЙ
- 12. Растворитель – D2O, стандарт – H3PO4 Данные 31Р-ЯМР-спектров ионных комплексов 3β,28-ДФБ с меглумином ИССЛЕДОВАНИЕ СОЛЕВОГО КОМПЛЕКСА
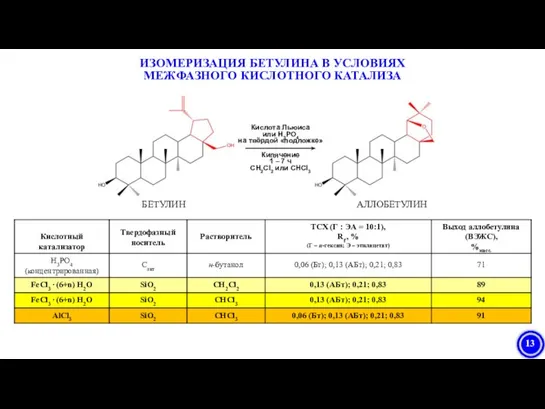
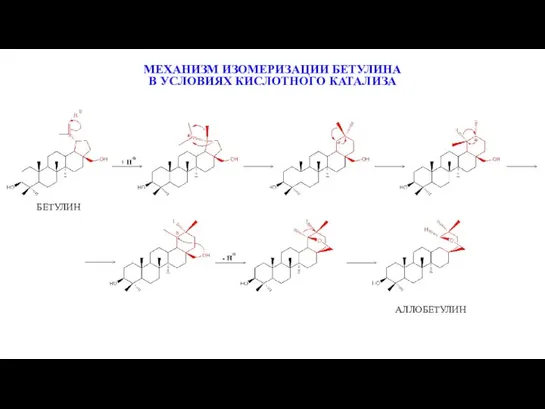
- 13. ИЗОМЕРИЗАЦИЯ БЕТУЛИНА В УСЛОВИЯХ МЕЖФАЗНОГО КИСЛОТНОГО КАТАЛИЗА
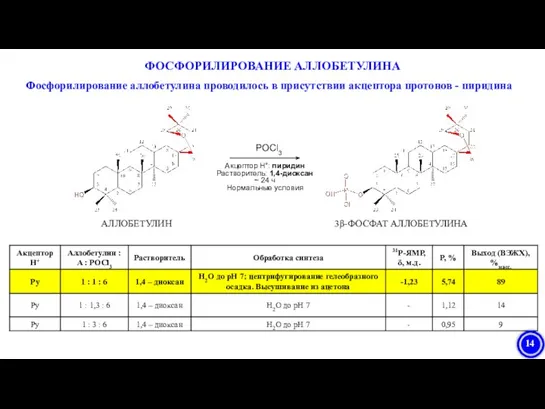
- 14. Фосфорилирование аллобетулина проводилось в присутствии акцептора протонов - пиридина АЛЛОБЕТУЛИН 3β-ФОСФАТ АЛЛОБЕТУЛИНА POCl3 Акцептор H+: пиридин
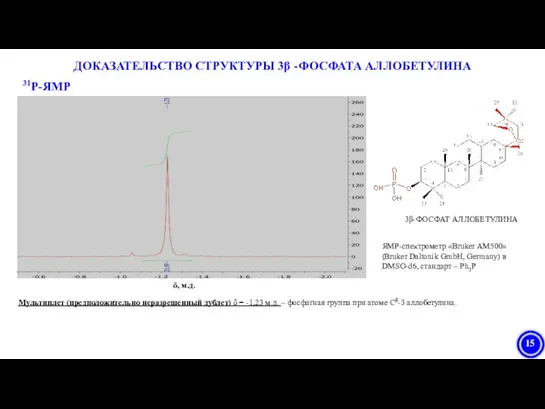
- 15. Мультиплет (предположительно неразрешенный дублет) δ = -1,23 м.д. – фосфатная группа при атоме Сβ-3 аллобетулина. ЯМР-спектрометр
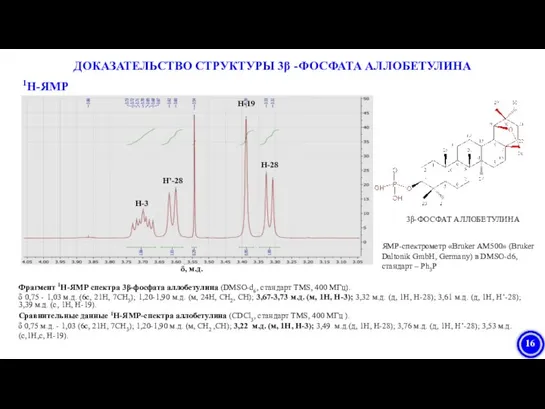
- 16. 1Н-ЯМР ДОКАЗАТЕЛЬСТВО СТРУКТУРЫ 3β -ФОСФАТА АЛЛОБЕТУЛИНА Фрагмент 1H-ЯМР спектра 3β-фосфата аллобетулина (DMSO-d6, стандарт TMS, 400 МГц).
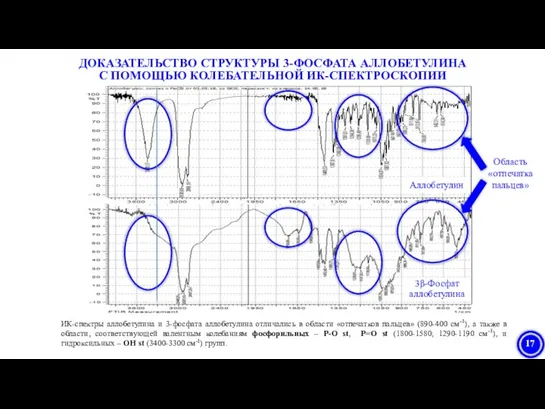
- 17. ДОКАЗАТЕЛЬСТВО СТРУКТУРЫ 3-ФОСФАТА АЛЛОБЕТУЛИНА С ПОМОЩЬЮ КОЛЕБАТЕЛЬНОЙ ИК-СПЕКТРОСКОПИИ ИК-спектры аллобетулина и 3-фосфата аллобетулина отличались в области
- 18. Предложен синтез аллобетулина изомеризацией бетулина в условиях межфазного катализа кислотой Льюиса, импрегнированной на силикагель. Разработан синтез
- 19. БЛАГОДАРЮ ЗА ВНИМАНИЕ!
- 20. БЛАГОДАРНОСТЬ
- 21. 1H-ЯМР-спектр 3β, 28-ДФБ (DMSO-d6, стандарт TMS, 400 МГц). δ 0.68-1.99 м.д. (42H, м, 6CH3, (CH2)10, (CH)4),
- 22. БЕТУЛИН АЛЛОБЕТУЛИН МЕХАНИЗМ ИЗОМЕРИЗАЦИИ БЕТУЛИНА В УСЛОВИЯХ КИСЛОТНОГО КАТАЛИЗА
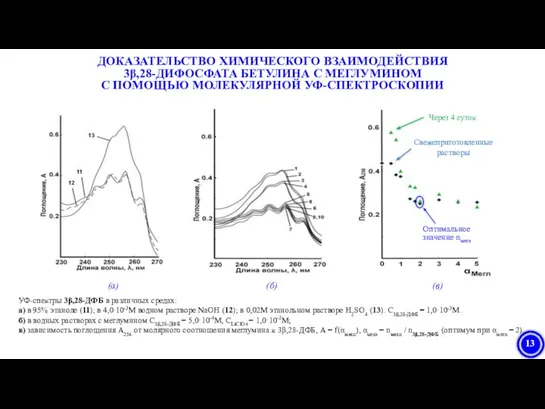
- 23. ДОКАЗАТЕЛЬСТВО ХИМИЧЕСКОГО ВЗАИМОДЕЙСТВИЯ 3β,28-ДИФОСФАТА БЕТУЛИНА С МЕГЛУМИНОМ С ПОМОЩЬЮ МОЛЕКУЛЯРНОЙ УФ-СПЕКТРОСКОПИИ УФ-спектры 3β,28-ДФБ в различных средах:
- 24. ИК-спектры структурных модификаций 1 и 2 отличались в области «отпечатков пальцев», а также в области, отвечающей
- 26. Скачать презентацию








 Определение моющего процесса
Определение моющего процесса Харчові добавки в напоях
Харчові добавки в напоях  Пестицидтердің қоршаған ортаға тигізетін әсері
Пестицидтердің қоршаған ортаға тигізетін әсері Превращения в нашей жизни: физические и химические
Превращения в нашей жизни: физические и химические Основы химической технологии
Основы химической технологии Вода
Вода Гетероциклические соединения. Лекция 19
Гетероциклические соединения. Лекция 19 Конструкционные функциональные волокнистые композиты. Углеродные волокна
Конструкционные функциональные волокнистые композиты. Углеродные волокна Азот
Азот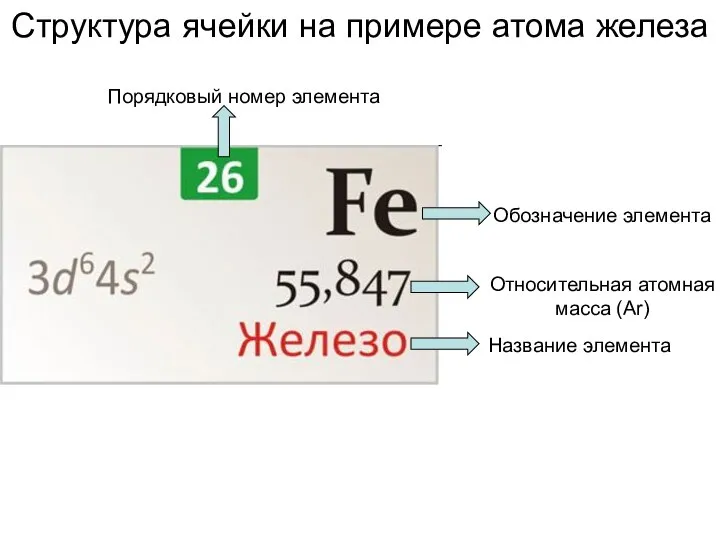 Структура ячейки на примере атома железа
Структура ячейки на примере атома железа Щелочные металлы
Щелочные металлы Аттестационная работа. Способ формирования метапредметных результатов обучения при обучении химии в условиях реализации ФГОС
Аттестационная работа. Способ формирования метапредметных результатов обучения при обучении химии в условиях реализации ФГОС Сравнение относительной эффективности предполагаемых ингибиторов коррозии методом гальванопары
Сравнение относительной эффективности предполагаемых ингибиторов коррозии методом гальванопары Гликозилирование, эффективная синтетическая стратегия для повышения биодоступности терапевтических пептидов
Гликозилирование, эффективная синтетическая стратегия для повышения биодоступности терапевтических пептидов Titration and Acid-Base Neutralization
Titration and Acid-Base Neutralization 6 КАЗ Изохинолин туынд
6 КАЗ Изохинолин туынд Соединения металлов. Оксиды и гидроксиды
Соединения металлов. Оксиды и гидроксиды Сполучна тканина
Сполучна тканина Никоти́новая кислота́ (ниацин, витамин PP)
Никоти́новая кислота́ (ниацин, витамин PP) Екологічні проблеми при переробці вуглеводнів Бондаренко Н. 11-А
Екологічні проблеми при переробці вуглеводнів Бондаренко Н. 11-А  Щелочноземельные металлы
Щелочноземельные металлы Самородные элементы. Сера, ртуть
Самородные элементы. Сера, ртуть Круговорот азота
Круговорот азота Термодинамика. Химическое равновесие. Кинетика
Термодинамика. Химическое равновесие. Кинетика Химическое сопротивление алюминий и его сплавов
Химическое сопротивление алюминий и его сплавов Презентация по Химии "Способы получения металлов" - скачать смотреть
Презентация по Химии "Способы получения металлов" - скачать смотреть  Химическая кинетика
Химическая кинетика Презентация по Химии "КОРРОЗИЯ МЕТАЛЛА" - скачать смотреть
Презентация по Химии "КОРРОЗИЯ МЕТАЛЛА" - скачать смотреть