Закономерности адсорбции ионов и адагуляции коллоидных частиц. Самосборка на поверхности. (Лекция 9)
Содержание
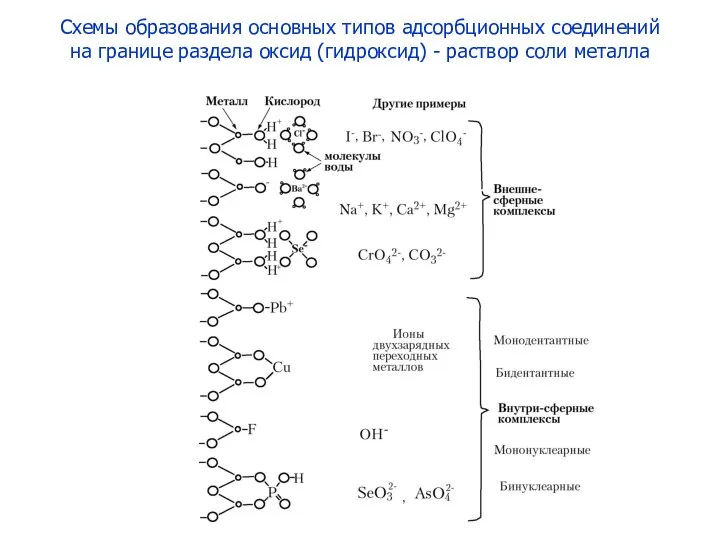
- 2. Схемы образования основных типов адсорбционных соединений на границе раздела оксид (гидроксид) - раствор соли металла
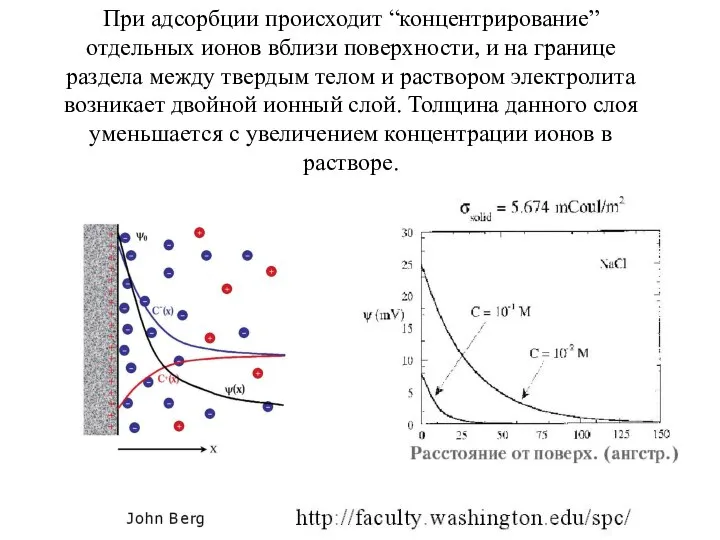
- 3. При адсорбции происходит “концентрирование” отдельных ионов вблизи поверхности, и на границе раздела между твердым телом и
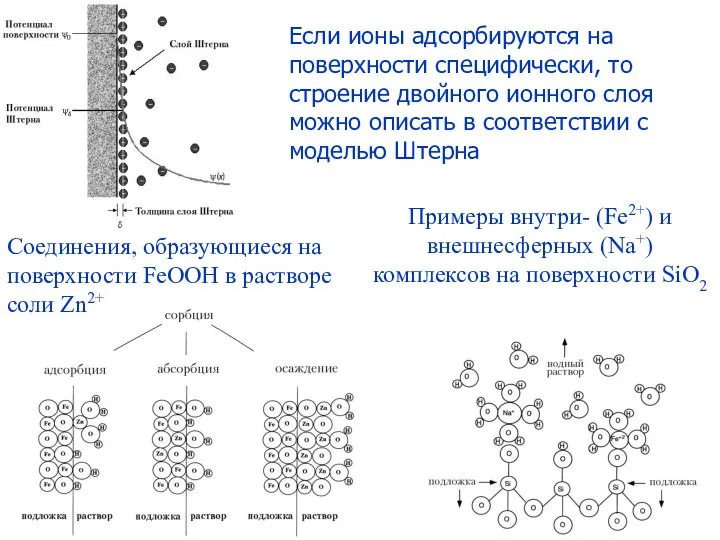
- 4. Соединения, образующиеся на поверхности FeOOH в растворе соли Zn2+ Примеры внутри- (Fe2+) и внешнесферных (Na+) комплексов
- 6. При адсорбции катионов существует общее правило - количество адсорбированных на поверхности катионов возрастает при рН, близких
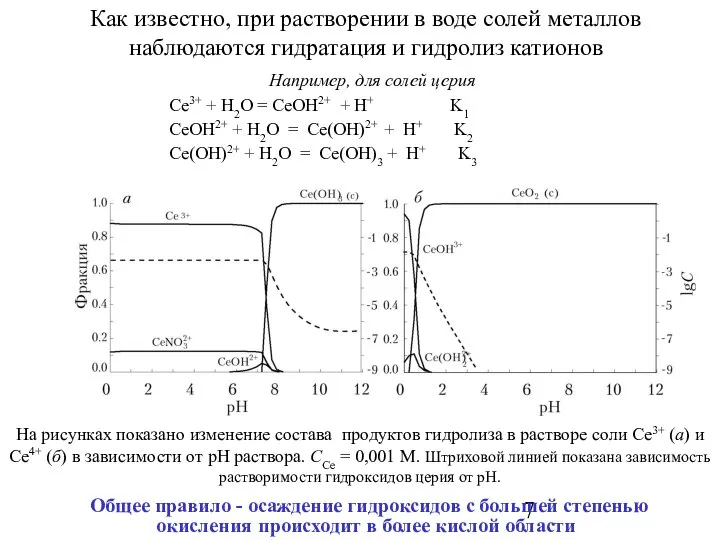
- 7. Как известно, при растворении в воде солей металлов наблюдаются гидратация и гидролиз катионов Общее правило -
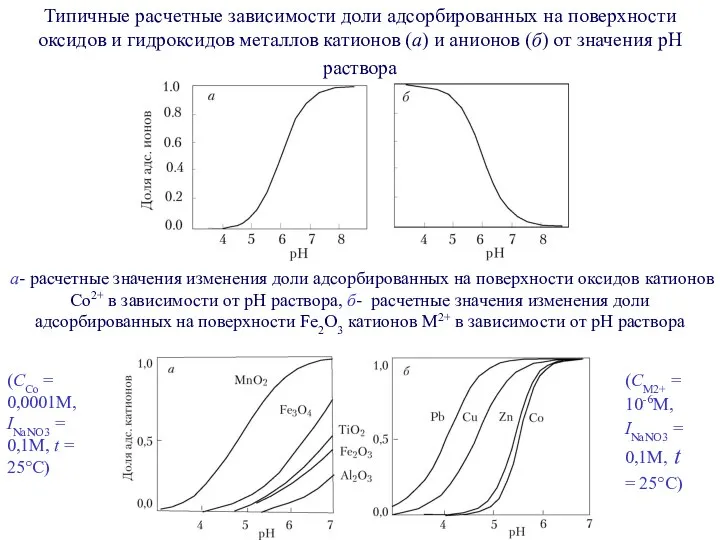
- 8. Типичные расчетные зависимости доли адсорбированных на поверхности оксидов и гидроксидов металлов катионов (а) и анионов (б)
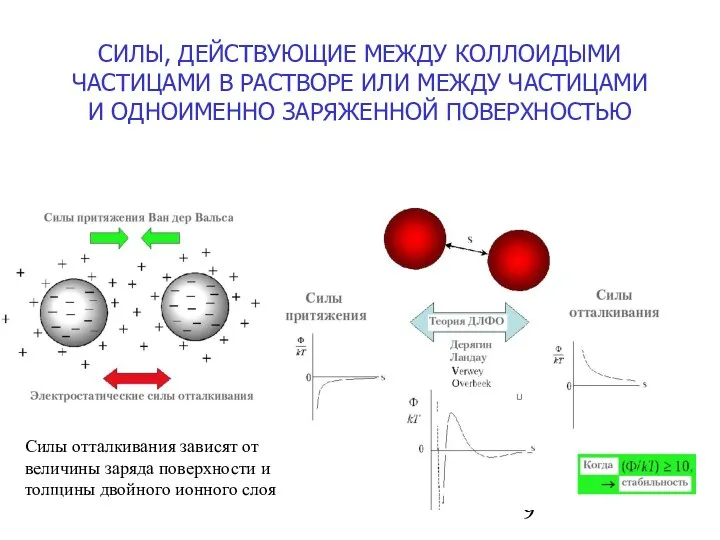
- 9. СИЛЫ, ДЕЙСТВУЮЩИЕ МЕЖДУ КОЛЛОИДЫМИ ЧАСТИЦАМИ В РАСТВОРЕ ИЛИ МЕЖДУ ЧАСТИЦАМИ И ОДНОИМЕННО ЗАРЯЖЕННОЙ ПОВЕРХНОСТЬЮ Силы отталкивания
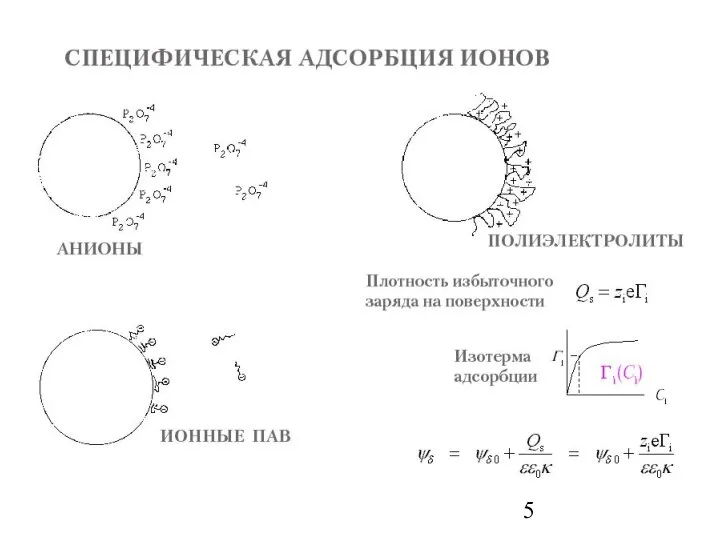
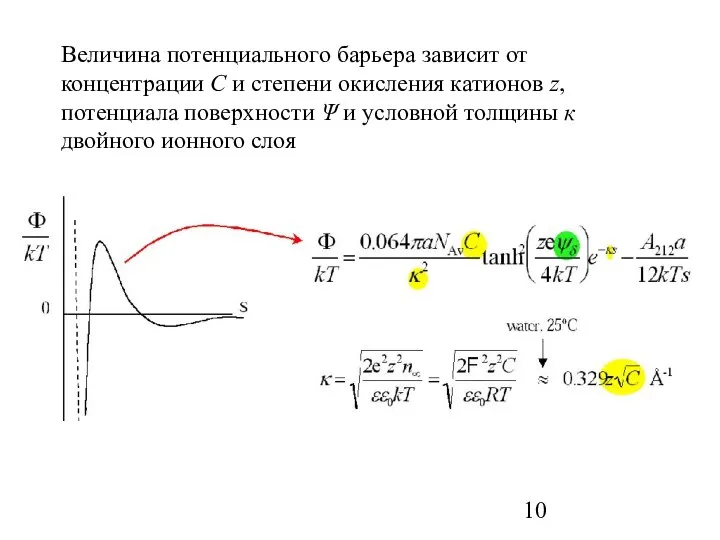
- 10. Величина потенциального барьера зависит от концентрации С и степени окисления катионов z, потенциала поверхности Ψ и
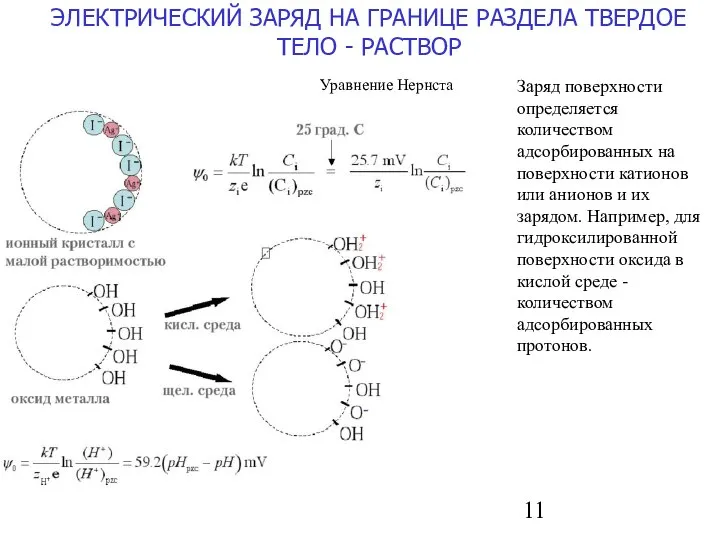
- 11. ЭЛЕКТРИЧЕСКИЙ ЗАРЯД НА ГРАНИЦЕ РАЗДЕЛА ТВЕРДОЕ ТЕЛО - РАСТВОР Уравнение Нернста Заряд поверхности определяется количеством адсорбированных
- 12. ВЛИЯНИЕ ИОННОЙ СИЛЫ РАСТВОРА НА АДАГУЛЯЦИЮ КОЛЛОИДНЫХ ЧАСТИЦ НА ПОВЕРХНОСТИ. На примере осаждения коллоидных частиц гематита
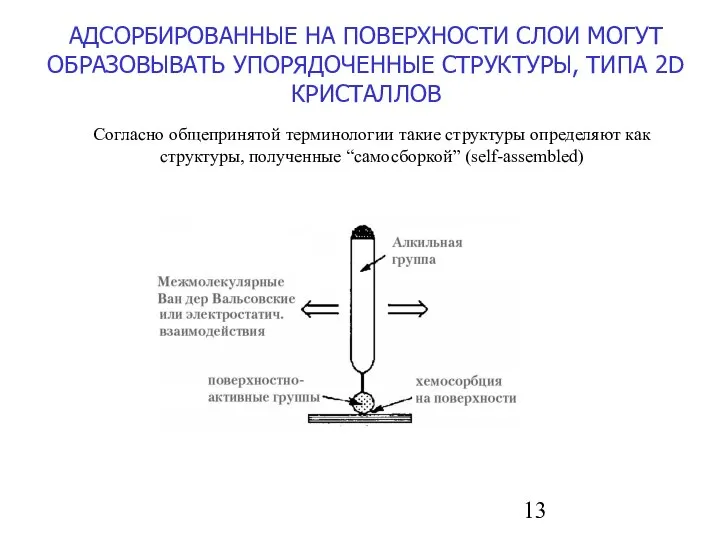
- 13. АДСОРБИРОВАННЫЕ НА ПОВЕРХНОСТИ СЛОИ МОГУТ ОБРАЗОВЫВАТЬ УПОРЯДОЧЕННЫЕ СТРУКТУРЫ, ТИПА 2D КРИСТАЛЛОВ Согласно общепринятой терминологии такие структуры
- 14. ПРИМЕР ОБРАЗОВАНИЯ МОНОСЛОЯ ТИОЛА НА ПОВЕРХНОСТИ ЗОЛОТА Тиолы на золоте адсорбируются за счет образования связей между
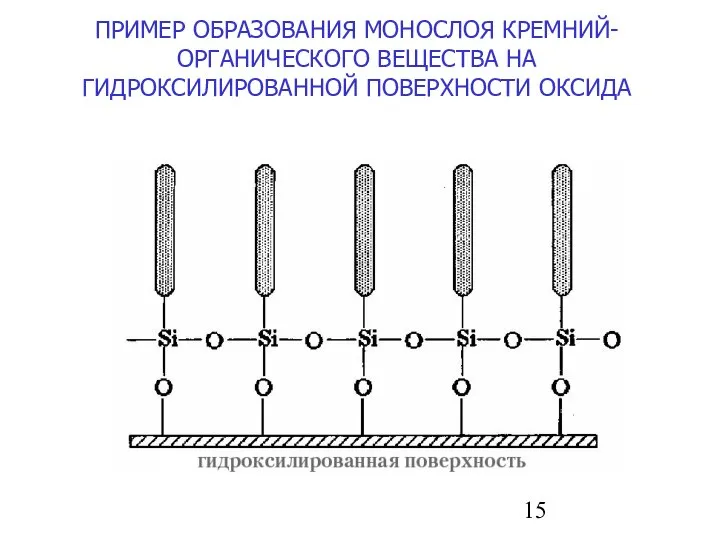
- 15. ПРИМЕР ОБРАЗОВАНИЯ МОНОСЛОЯ КРЕМНИЙ-ОРГАНИЧЕСКОГО ВЕЩЕСТВА НА ГИДРОКСИЛИРОВАННОЙ ПОВЕРХНОСТИ ОКСИДА
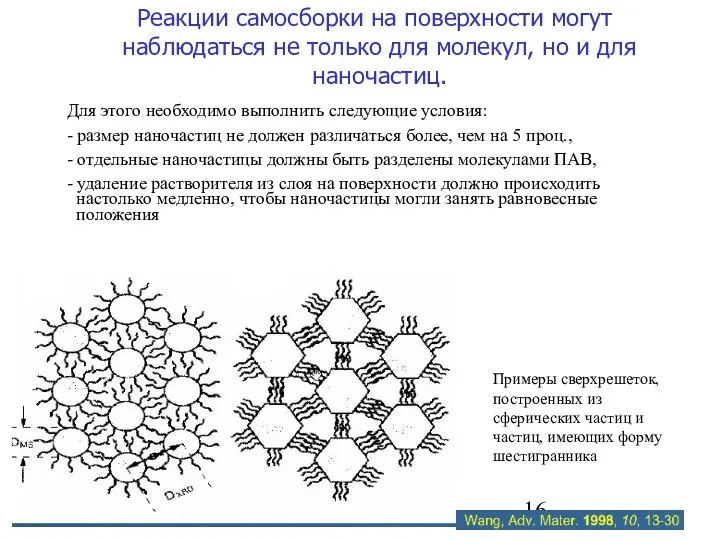
- 16. Реакции самосборки на поверхности могут наблюдаться не только для молекул, но и для наночастиц. Для этого
- 17. ПРИМЕРЫ СИНТЕЗА СВЕРХРЕШЕТОК, СОСТОЯЩИХ ИЗ НАНОЧАСТИЦ МЕТАЛЛОВ И МОЛЕКУЛ ОРГАНИЧЕСКИХ ВЕЩЕСТВ
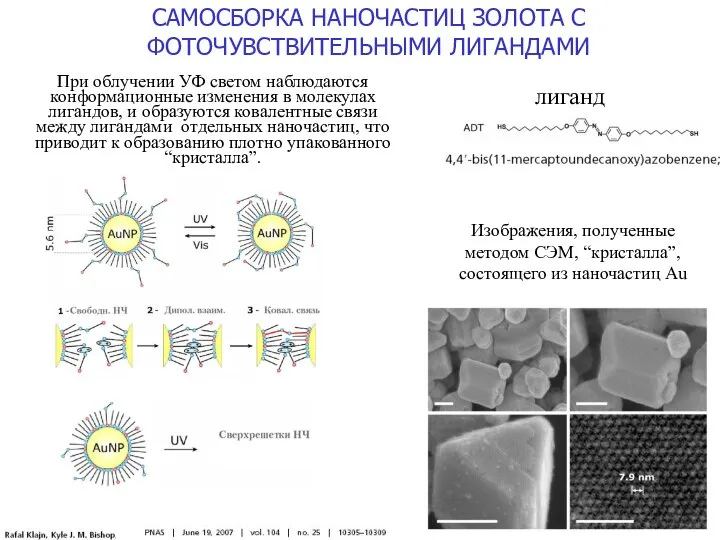
- 18. САМОСБОРКА НАНОЧАСТИЦ ЗОЛОТА С ФОТОЧУВСТВИТЕЛЬНЫМИ ЛИГАНДАМИ Изображения, полученные методом СЭМ, “кристалла”, состоящего из наночастиц Au лиганд
- 19. САМОСБОРКА МЕТАЛЛ-ОРГАНИЧЕСКИХ СУПРАМОЛЕКУЛЯРНЫХ СОЕДИНЕНИЙ, ОПРЕДЕЛЯЕМАЯ ВЗАИМОДЕЙСТВИЕМ МЕЖДУ МЕТАЛЛОМ И ОРГАНИЧЕСКИМИ ЛИГАНДАМИ Конфигурация А более вероятна, чем
- 21. Скачать презентацию





 Электролиз
Электролиз Тотығу стрестің өсімдіктерге әсері
Тотығу стрестің өсімдіктерге әсері Цветные сплавы
Цветные сплавы Химические элементы. Знаки химических элементов
Химические элементы. Знаки химических элементов Биологическая роль и строение углеводов
Биологическая роль и строение углеводов Определение содержания солей в нефти
Определение содержания солей в нефти Аммиак NH3
Аммиак NH3 Строение электронных оболочек атомов
Строение электронных оболочек атомов Обменные реакции в растворах электролитов
Обменные реакции в растворах электролитов Заседание временного творческого коллектива ОМО УГПС Технологии материалов, УГПС Химические технологии
Заседание временного творческого коллектива ОМО УГПС Технологии материалов, УГПС Химические технологии Особенности сплавов цветных металлов
Особенности сплавов цветных металлов Органічні та біологічні молекули
Органічні та біологічні молекули Металлы
Металлы  Моторные масла. Свойства, состав, классификация
Моторные масла. Свойства, состав, классификация Презентация по Химии "Природные источники углеводородов" - скачать смотреть бесплатно
Презентация по Химии "Природные источники углеводородов" - скачать смотреть бесплатно Химическая связь
Химическая связь Основания
Основания Презентация по Химии "Родословная Д. И. Менделеева." - скачать смотреть бесплатно
Презентация по Химии "Родословная Д. И. Менделеева." - скачать смотреть бесплатно Диаграммы состояния сплавов, компоненты которых имеют полиморфное превращение
Диаграммы состояния сплавов, компоненты которых имеют полиморфное превращение Алканы (Предельные углеводороды. Парафины. Насыщенные углеводороды)
Алканы (Предельные углеводороды. Парафины. Насыщенные углеводороды) Химическая связь. Лекция 2
Химическая связь. Лекция 2 Химическая технология природных энергоносителей и углеродных материалов
Химическая технология природных энергоносителей и углеродных материалов Утилизация отходов
Утилизация отходов Состав, строение и свойства белков
Состав, строение и свойства белков Хлор. Химический элемент
Хлор. Химический элемент Презентация АТОМНАЯ ЭНЕРГЕТИКА
Презентация АТОМНАЯ ЭНЕРГЕТИКА КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ КАФЕДРА ФУНДАМЕНТАЛЬНОЙ И КЛИНИЧЕСКОЙ БИОХИМИИ Лекция по теме: «Обмен белко
КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ КАФЕДРА ФУНДАМЕНТАЛЬНОЙ И КЛИНИЧЕСКОЙ БИОХИМИИ Лекция по теме: «Обмен белко Лекция 2. Физико-химические основы строения пластов
Лекция 2. Физико-химические основы строения пластов