Содержание
- 2. Тема 6.1 Кинетическая модель химического процесса в реакционном объеме
- 3. Кинетическая модель химического процесса на уровне элементарного объема учитывает все параметры, влияющие на процесс, и предоставляет
- 4. Цель исследования химического процесса на уровне реакционного объема дополнение полученной на втором уровне кинетической модели закономерностями
- 5. Концентрационное и температурное поля в реакционном объеме реактора формируются как следствие конвективных потоков вещества и тепла,
- 6. Гидродинамический режим в реакционном объеме определяется типом и конструкционными особенностями реактора в целом (конфигурации вводного и
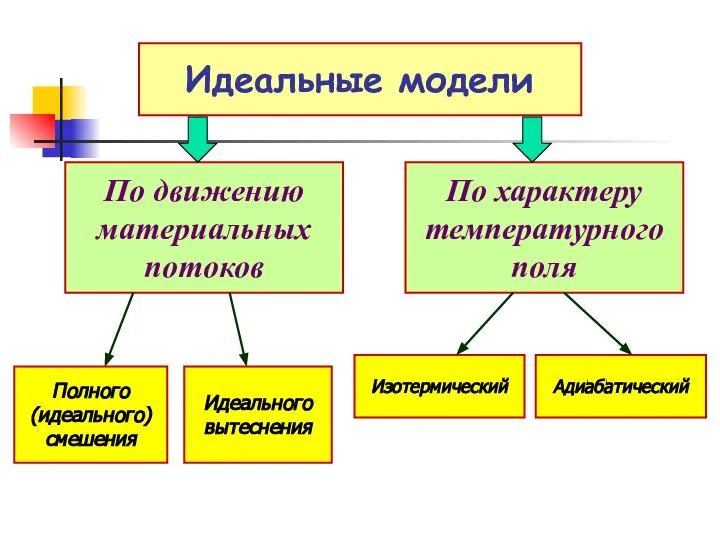
- 7. Идеальные модели Это условные (мысленные) реакционные устройства, в реакционном объеме которых предполагается идеальная гидродинамическая структура материальных
- 8. Идеальные модели По движению материальных потоков По характеру температурного поля Полного (идеального) смешения Идеального вытеснения Изотермический
- 9. При режиме идеального смешения предполагается постоянство концентрации и других параметров процесса во всем реакционном объеме. При
- 10. При идеальном изотермическом режиме должно быть полное равенство температуры во всем реакционном объеме. При идеальном адиабатическом
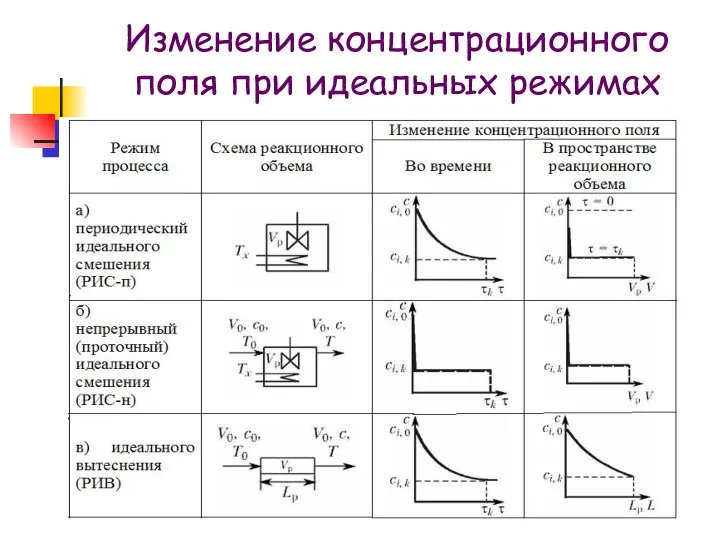
- 11. Изменение концентрационного поля при идеальных режимах
- 12. Температурное поле в процессах идеального смешения (как периодических, так и проточных) является постоянным во всем реакционном
- 13. В процессах идеального вытеснения температурное поле в реакционном объеме в общем случае является переменным как в
- 14. Кинетическая модель процесса строится на основе материального и теплового баланса в реакционном объеме и в самом
- 15. Балансовые уравнения составляют: Для всех участвующих в процессе веществ, учитывая сохранение общей массы вещества и стехиометрические
- 16. Процесс – нестационарный Сумма входящих и выходящих потоков равна ΣNвх = 0 Источником i-го вещества является
- 17. ΣQвх = 0. В реакционном объеме возможен теплообмен с теплоносителем, имеющим температуру Тх, при коэффициенте теплообмена
- 18. Изменение количества теплоты в реакционной зоне связано с изменением температуры и при неизменном значении теплоемкости реакционной
- 19. Периодический процесс в режиме идеального смешения (ИС-п) Начальные условия процесса задаются: при τ = 0 С
- 20. Процесс – стационарный dN/dτ = 0 и dQ/dτ = 0 Источник веществ – химическое превращение, т.е.
- 21. Источники теплоты в реакторе – химическое превращение и теплообмен . При постоянном значении теплоемкости ср реакционной
- 22. Непрерывный процесс в режиме идеального смешения (ИС-н) Начальные условия процесса Сi,0 и Т0 входят в эти
- 23. Процесс - стационарный dNi/dτ = 0 Режим потока — поршневой без перемешивания Профиль скорости по сечению
- 24. Процесс - стационарный dQ/dτ = 0 Уравнение теплового баланса для рассматриваемого объема dVр 0 = V0срТ
- 25. Непрерывный процесс в режиме идеального вытеснения (ИВ) Начальные условия: при τ = 0 С = С0,i
- 27. Анализ кинетических моделей Исследование влияния условий процесса и характеристик (свойств) его составляющих (химической реакции, тепло- и
- 28. Важнейшим показателем является уровень и характер распределения температуры в реакционном объеме. Температура влияет на: скорость превращения;
- 29. Изменение температуры может привести к переходу гетерогенного процесса из кинетической области в диффузионную и наоборот. Т
- 30. Температура в реакционном объеме является результатом теплового баланса, важнейшей составляющей которого является скорость тепловыделения (поглощения) в
- 31. Закрытая система Зависимость скорости от температуры проходит через максимум и при достижении определенной температуры начинает уменьшаться,
- 32. Открытая система Скорость реакции поддерживается на максимальном уровне компенсацией расхода реагентов путем непрерывной подачи сырья, в
- 34. Скачать презентацию





























 Коллигативные свойства растворов
Коллигативные свойства растворов Понятие о простых формах. Номенклатура простых форм высшей категории. Простые формы кристаллов высшей категории
Понятие о простых формах. Номенклатура простых форм высшей категории. Простые формы кристаллов высшей категории Презентация по Химии "Оцтова кислота" - скачать смотреть бесплатно
Презентация по Химии "Оцтова кислота" - скачать смотреть бесплатно Галогени. Хімічні властивості
Галогени. Хімічні властивості Производство стекла
Производство стекла Генетическая связь между классами неорганических веществ
Генетическая связь между классами неорганических веществ Ионная химическая связь
Ионная химическая связь Металлическая химическая связь. Тема 2.5
Металлическая химическая связь. Тема 2.5 Изменение активности катализатора в процессе эксплуатации
Изменение активности катализатора в процессе эксплуатации Кислоты, их классификация и свойства
Кислоты, их классификация и свойства Обмен веществ. Метаболизм и его функции
Обмен веществ. Метаболизм и его функции Мембранные липиды: строение и функции
Мембранные липиды: строение и функции Heterogeneous catalysis
Heterogeneous catalysis Скорость химических реакций
Скорость химических реакций Органическая химия. Непредельные углеводороды
Органическая химия. Непредельные углеводороды Водородная связь
Водородная связь Оксиды и кислородсодержащие кислоты неметаллов
Оксиды и кислородсодержащие кислоты неметаллов Классификация кристаллов по силам связи
Классификация кристаллов по силам связи Видалення забруднень із поверхні тканини Виконали: Сидорова Анастасія Труба Альона
Видалення забруднень із поверхні тканини Виконали: Сидорова Анастасія Труба Альона  Презентация по Химии "Волокна" - скачать смотреть бесплатно
Презентация по Химии "Волокна" - скачать смотреть бесплатно Чипсы: Вред или польза?. 9 класс
Чипсы: Вред или польза?. 9 класс Углеводы. Структура
Углеводы. Структура Гели (Студни)
Гели (Студни) Презентация по химии Такой разный песок
Презентация по химии Такой разный песок  Базальтовое волокна
Базальтовое волокна Свободное окисление и токсические формы кислорода
Свободное окисление и токсические формы кислорода Основные законы и понятия химии. Тема №10
Основные законы и понятия химии. Тема №10 Этиленгликоль. Физические свойства
Этиленгликоль. Физические свойства