Содержание
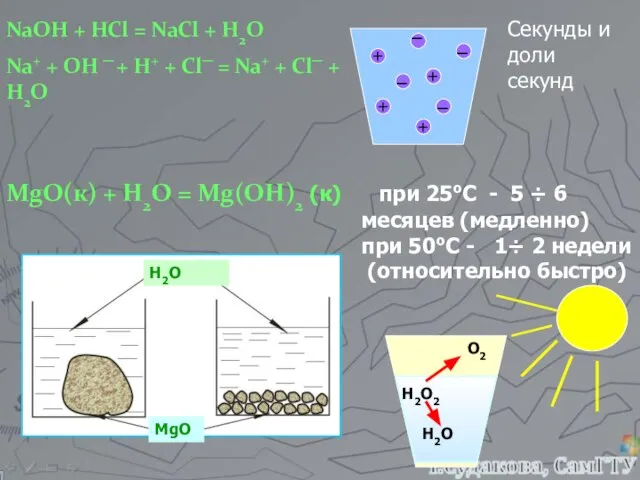
- 2. NaOH + HCl = NaCl + H2O Na+ + OH ─ + H+ + Cl─ =
- 3. Время протекания реакции скорость реакции кинетика «kinẽtikos”, что означает “движущийся”. Кинетика – раздел физической химии, изучающий
- 4. аА + bB → cC + dD, где а, b, c, d – стехиометрические коэффициенты реагентов
- 5. Гомогенные реакции – реакции, в которых все реагенты находятся в одном агрегатном состоянии разложение 2N2O5 (г)
- 6. Скорость химической реакции определяют экспериментально. По полученным результатам эксперимента строят кинетическую кривую - график изменения концентрации
- 7. Для реакции: А + 2В = 3С υ = Для реакции: H2 + I2 = 2HI
- 8. Факторы, влияющие на скорость реакции: - концентрация реагентов, - температура, - физическое состояние реагентов, - наличие
- 9. Для реакции вида аА + bB = cC закон действующих масс выражается формулой Ʋ = k
- 10. Важное замечание! Концентрация конденсированной фазы не включается в выражение ЗДМ, т.к. она является постоянной величиной. Пример:
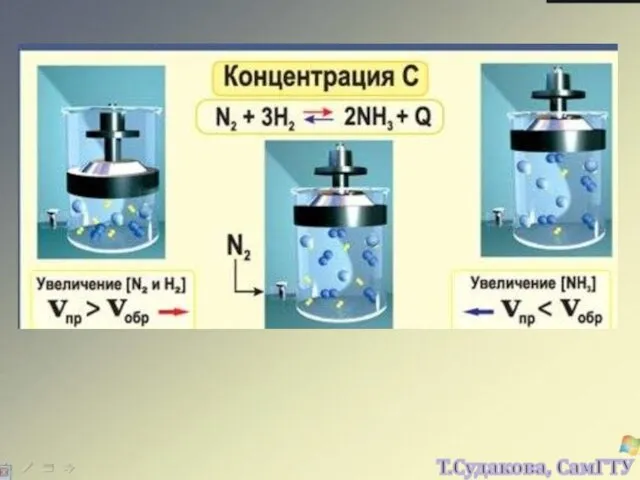
- 11. СКОРОСТЬ РЕАКЦИИ МОЖЕТ ЗАВИСЕТЬ ОТ КОНЦЕНТРАЦИЙ ОБОИХ РЕАГЕНТОВ, ИЛИ ТОЛЬКО ОТ КОНЦЕНТРАЦИИ ОДНОГО РЕАГЕНТА, А МОЖЕТ
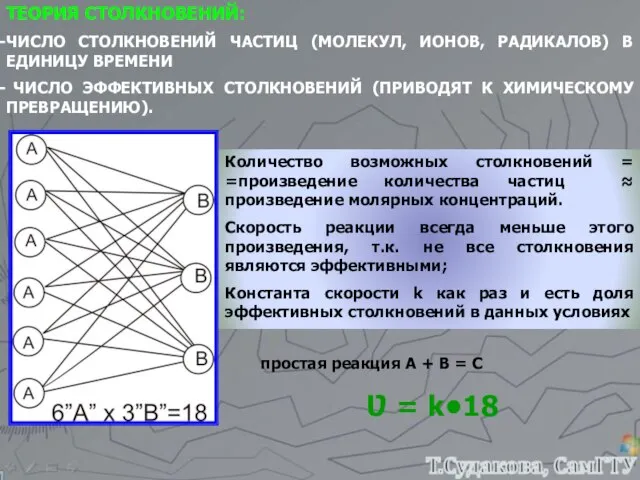
- 12. ТЕОРИЯ СТОЛКНОВЕНИЙ: ЧИСЛО СТОЛКНОВЕНИЙ ЧАСТИЦ (МОЛЕКУЛ, ИОНОВ, РАДИКАЛОВ) В ЕДИНИЦУ ВРЕМЕНИ ЧИСЛО ЭФФЕКТИВНЫХ СТОЛКНОВЕНИЙ (ПРИВОДЯТ К
- 13. ЗАВИСИМОСТЬ СКОРОСТИ ОТ ТЕМПЕРАТУРЫ: ЭМПИРИЧЕСКОЕ ПРАВИЛО ВАНТ-ГОФФА Ʋ2/Ʋ1 = γΔt/10, Δt = T2 –T1 Ʋ2 =
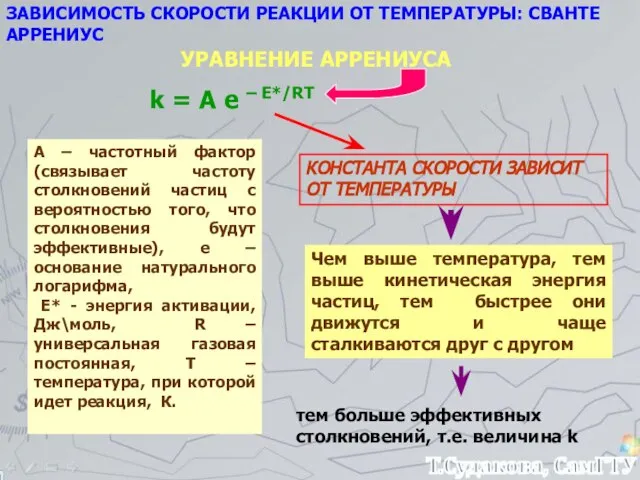
- 14. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ: СВАНТЕ АРРЕНИУС УРАВНЕНИЕ АРРЕНИУСА k = А е – Е*/RT КОНСТАНТА
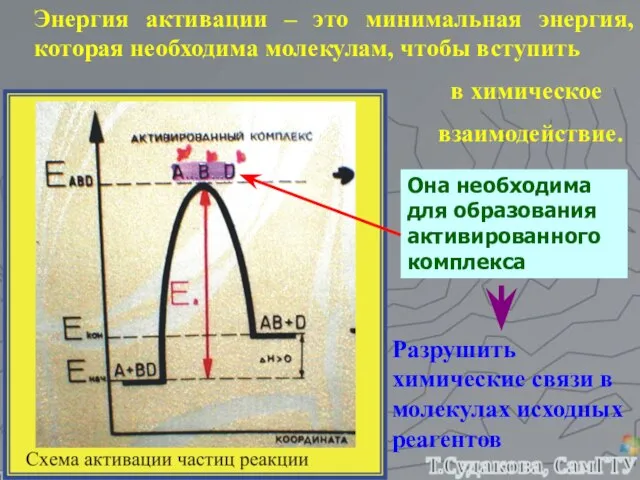
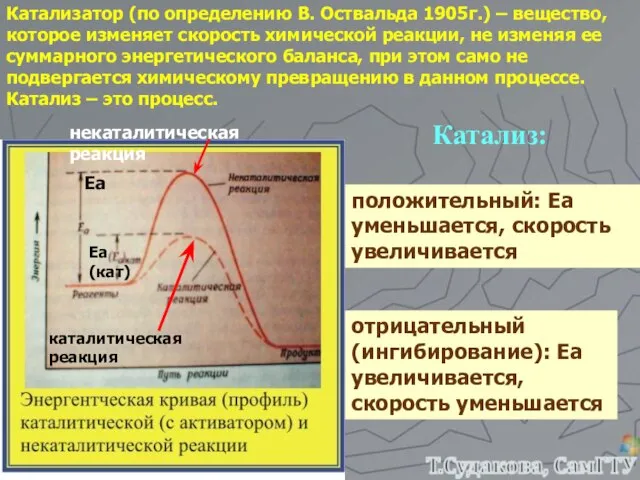
- 15. Энергия активации – это минимальная энергия, которая необходима молекулам, чтобы вступить в химическое взаимодействие. Она необходима
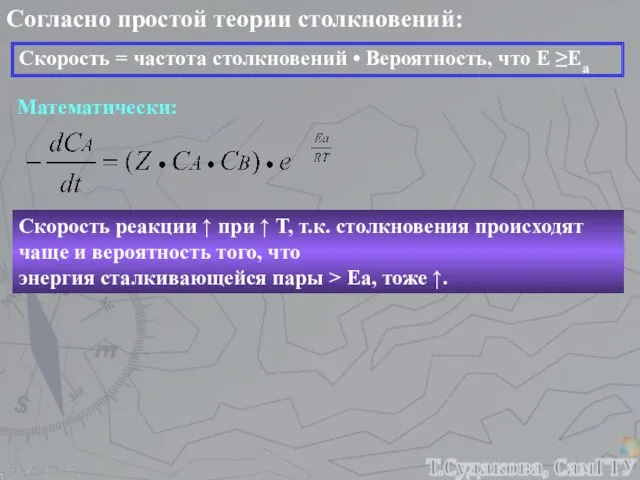
- 16. Согласно простой теории столкновений: Скорость = частота столкновений • Вероятность, что Е ≥Еа Математически: Скорость реакции
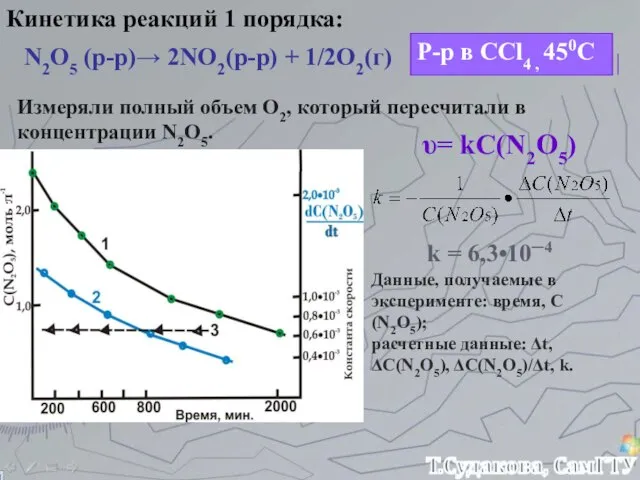
- 17. Кинетика реакций 1 порядка: N2O5 (р-р)→ 2NO2(р-р) + 1/2O2(г) Р-р в CCl4 , 450С Измеряли полный
- 18. В общем случае в теории: υ = -ln C = kt + const t=0, C=C0, const=
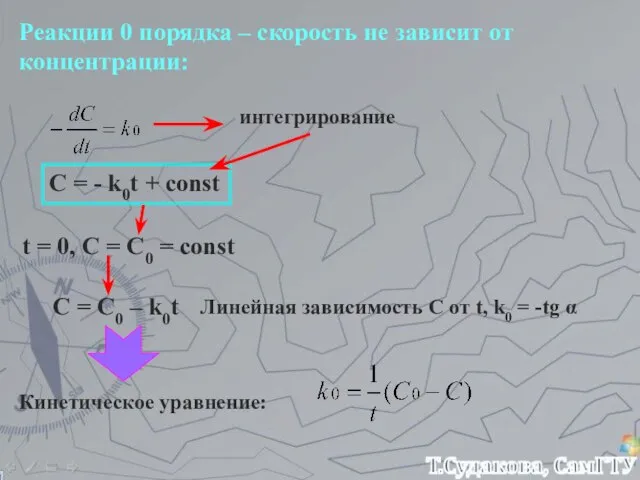
- 19. Реакции 0 порядка – скорость не зависит от концентрации: интегрирование C = - k0t + const
- 20. Реакции 2 порядка: С1 и С2 – концентрации реагентов в момент времени t. Если С1 =
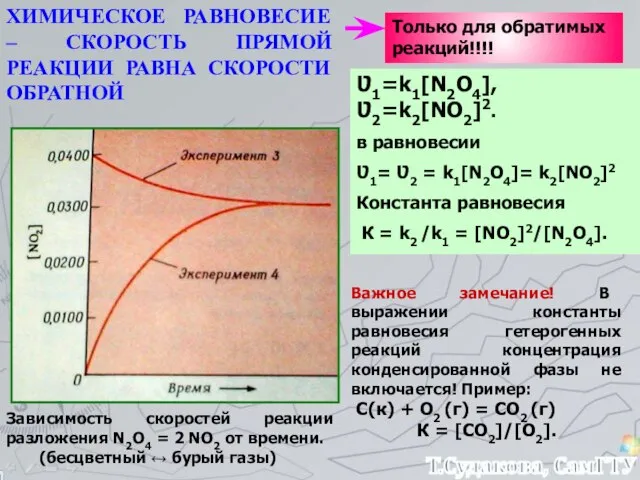
- 21. Зависимость скоростей реакции разложения N2О4 = 2 NО2 от времени. (бесцветный ↔ бурый газы) ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- 22. Изменение любого фактора, могущего влиять на состояние химического равновесия, вызывает в системе реакцию, стремящуюся противодействовать производимому
- 26. Катализатор (по определению В. Оствальда 1905г.) – вещество, которое изменяет скорость химической реакции, не изменяя ее
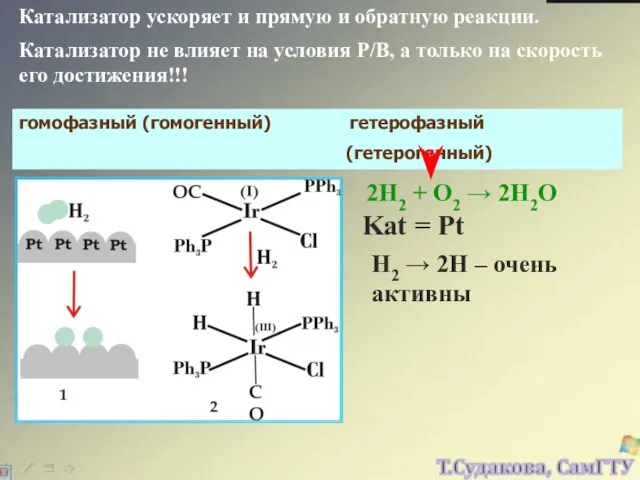
- 27. Катализатор ускоряет и прямую и обратную реакции. Катализатор не влияет на условия Р/В, а только на
- 29. Скачать презентацию















 Метанол: получение и применение
Метанол: получение и применение Факторы и процессы формирования химического состава подземных вод
Факторы и процессы формирования химического состава подземных вод Тема урока: Природный каучук.
Тема урока: Природный каучук. Классификация кристаллов по силам связи
Классификация кристаллов по силам связи Явище ізомерії. Структурна ізомерія. Близнюки органічного світу
Явище ізомерії. Структурна ізомерія. Близнюки органічного світу Периодическая система Д.И. Менделеева
Периодическая система Д.И. Менделеева Бирюза. Характеристики минерала
Бирюза. Характеристики минерала Щелочные металлы
Щелочные металлы Ізогіпсичні перетворення функціональних груп. Реакції заміщення та елімінування
Ізогіпсичні перетворення функціональних груп. Реакції заміщення та елімінування Влияние эфирного масла и конкрета из шалфея мускатного на организм человека Подготовила студентка 4 курса группа 42 TF Даной Ян
Влияние эфирного масла и конкрета из шалфея мускатного на организм человека Подготовила студентка 4 курса группа 42 TF Даной Ян Класифікація неорганічних сполук, їхній склад і номенклатура
Класифікація неорганічних сполук, їхній склад і номенклатура Основы кристаллического строения металлов
Основы кристаллического строения металлов Катаболизм пищевых и тканевых липидов. (Лекция 7)
Катаболизм пищевых и тканевых липидов. (Лекция 7) Обмен триацилглицеролов и жирных кислот
Обмен триацилглицеролов и жирных кислот Железо как химический элемент
Железо как химический элемент Галогены. Хлороводород, соляная кислота и хлориды. Биологическая роль йода в жизнедеятельности человека
Галогены. Хлороводород, соляная кислота и хлориды. Биологическая роль йода в жизнедеятельности человека Изопроцессы в идеальном газе
Изопроцессы в идеальном газе Минерал турмалин
Минерал турмалин 1. Взаємодія неметалів з металами: 1. Взаємодія неметалів з металами: а) Сu0 + Cl20 = Сu+2 Cl2-1 – купрум (ІІ) хлорид Сu0 – 2e-→ Сu+2 2 Cl20 + 2(1e-) → Cl2−1 2 б) Fe0 + Cl20 = Fe+3 Cl3-1 – ферум
1. Взаємодія неметалів з металами: 1. Взаємодія неметалів з металами: а) Сu0 + Cl20 = Сu+2 Cl2-1 – купрум (ІІ) хлорид Сu0 – 2e-→ Сu+2 2 Cl20 + 2(1e-) → Cl2−1 2 б) Fe0 + Cl20 = Fe+3 Cl3-1 – ферум Колообіг нітрогену в природі
Колообіг нітрогену в природі Химические свойства кислорода. Применение кислорода
Химические свойства кислорода. Применение кислорода Олигонуклеотидный синтез
Олигонуклеотидный синтез Тұндыру әдістері
Тұндыру әдістері Министерство сельского хозяйства Российской Федерации. Поляграфия и фотоэлектронная спектроскопия
Министерство сельского хозяйства Российской Федерации. Поляграфия и фотоэлектронная спектроскопия ИССЛЕДОВАТЕЛЬСКАЯ РАБОТА ПО ХИМИИ
ИССЛЕДОВАТЕЛЬСКАЯ РАБОТА ПО ХИМИИ Периодический закон Д.И. Менделеева. Строение атома
Периодический закон Д.И. Менделеева. Строение атома Минеральные вещества
Минеральные вещества Презентация по Химии "Химические тайны запаха" - скачать смотреть
Презентация по Химии "Химические тайны запаха" - скачать смотреть