Содержание
- 2. План лекции 1. Периодический закон Д.И. Менделеева. 2. Строение атома. Квантовые числа. Принцип Паули. 3. Распределение
- 3. 1.Периодический закон Д.И. Менделеева Авторская формулировка (1869г): Свойства элементов, а также формы и свойства соединений элементов
- 4. 2. Строение атома. Квантовые числа. Атом - наименьшая электронейтральная частица химически неделимая. Строение атома: ядро (
- 5. Принцип Паули В атоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел
- 6. 3. Распределение электронов в атоме. Правило Хунда. Электроны заполняют орбитали в порядке увеличения их энергии: 1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p7s5f6d
- 8. Скачать презентацию





 Презентация по Химии "Окислительно - восстановленные реакции" - скачать смотреть
Презентация по Химии "Окислительно - восстановленные реакции" - скачать смотреть  Презентация по Химии "Презентация Медь" - скачать смотреть
Презентация по Химии "Презентация Медь" - скачать смотреть  Лабораторное оборудование. Тесты
Лабораторное оборудование. Тесты Презентация по химии Переработка нефти
Презентация по химии Переработка нефти Фазовые равновесия и учение о растворах
Фазовые равновесия и учение о растворах Никоти́новая кислота́ (ниацин, витамин PP)
Никоти́новая кислота́ (ниацин, витамин PP) Классификация химических реакций
Классификация химических реакций Дисперсные системы
Дисперсные системы Уран. Получение урана
Уран. Получение урана Презентация по Химии "Простые вещества - металлы и неметаллы" - скачать смотреть
Презентация по Химии "Простые вещества - металлы и неметаллы" - скачать смотреть  Презентация по Химии "Кислород" - скачать смотреть
Презентация по Химии "Кислород" - скачать смотреть  Органическая химия. История развития
Органическая химия. История развития Электрохимические методы анализа
Электрохимические методы анализа Синтез белка
Синтез белка Реакции разложения
Реакции разложения Железо, хром, марганец. Свойства, получение
Железо, хром, марганец. Свойства, получение Насыщенные (предельные) углеводороды. Алканы (парафины)
Насыщенные (предельные) углеводороды. Алканы (парафины)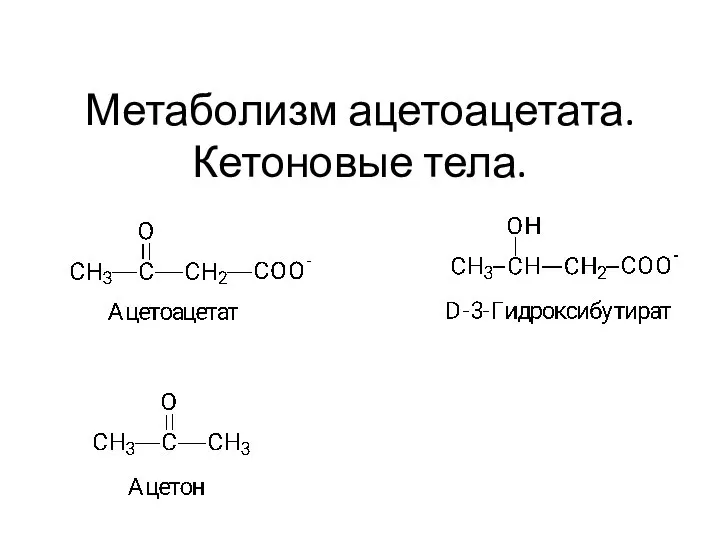 Метаболизм ацетоацетата. Кетоновые тела.Тема 10
Метаболизм ацетоацетата. Кетоновые тела.Тема 10 Химический состав водотоков архипилага Новая земля и их воздействие на прибрежную зону
Химический состав водотоков архипилага Новая земля и их воздействие на прибрежную зону Палива Підготувала Учениця 7(11) – А класу Одеського НВК№13
Палива Підготувала Учениця 7(11) – А класу Одеського НВК№13  Презентация по Химии "Свойства воды" - скачать смотреть
Презентация по Химии "Свойства воды" - скачать смотреть 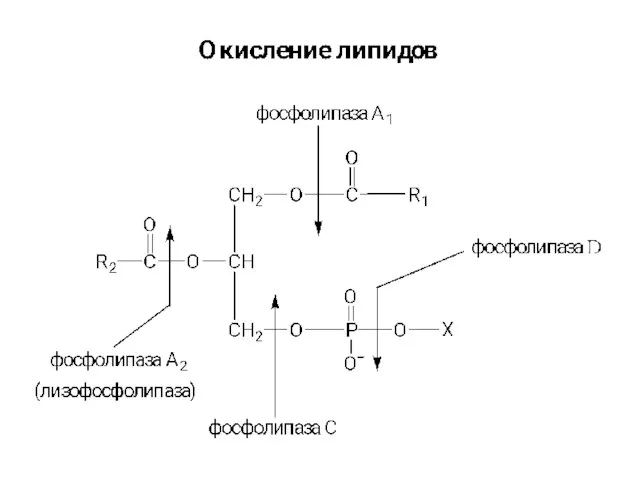 Бета-окисление жирных кислот
Бета-окисление жирных кислот Катализ и катализаторы. (Лекция 10)
Катализ и катализаторы. (Лекция 10) Вуглеводні. Насичені, ненасичені та ароматичні вуглеводні: їх склад, будова, фізичні та хімічні властивості.
Вуглеводні. Насичені, ненасичені та ароматичні вуглеводні: їх склад, будова, фізичні та хімічні властивості.  Клетчатка. Алу жолдары
Клетчатка. Алу жолдары Поликонденсация. Фенолформальдегидные смолы
Поликонденсация. Фенолформальдегидные смолы Синтез 2,4-диметил-3,5-ди(этоксикарбонил)пиррола
Синтез 2,4-диметил-3,5-ди(этоксикарбонил)пиррола Межклеточная сигнализация. Сигнальные молекулы. Гормоны. (Тема 3)
Межклеточная сигнализация. Сигнальные молекулы. Гормоны. (Тема 3)