Содержание
- 2. Содержание темы: «Кислород» Открытие кислорода Кислород в природе Физические свойства кислорода Химический элемент и простое вещество
- 3. Кислород – самый распространенный на Земле химический элемент Атмосфера 21 % Гидросфера 98 % Литосфера 49
- 4. Задача В настоящее время численность населения земного шара приблизилась к 6-ти миллиардной отметке, количество кислорода в
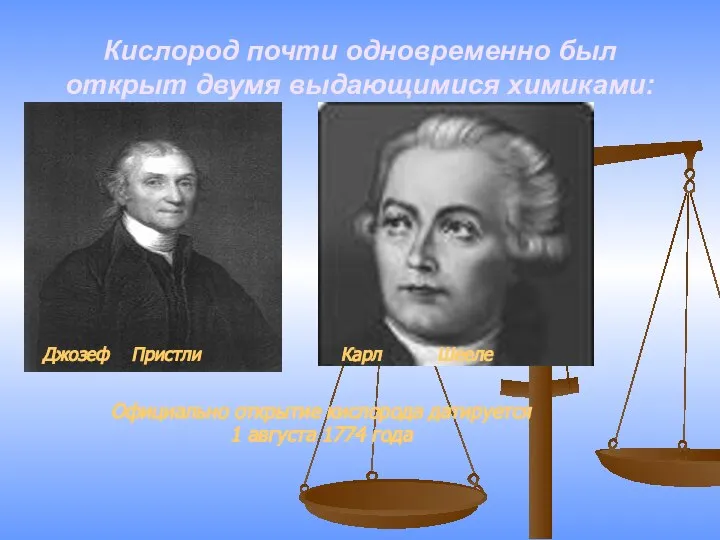
- 5. Кислород почти одновременно был открыт двумя выдающимися химиками: Джозеф Пристли Карл Шееле Официально открытие кислорода датируется
- 6. оксюс – «кислый» генао – «рождаю» Современное название кислороду дал Антуан Лавуазье
- 7. Кислород – химический элемент
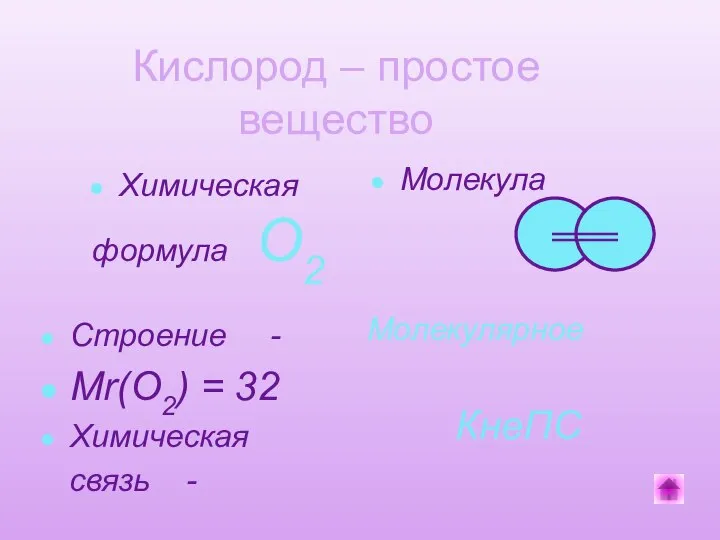
- 8. Химическая формула О2 Молекула Строение - Мr(O2) = 32 Химическая связь - Молекулярное КнеПС Кислород –
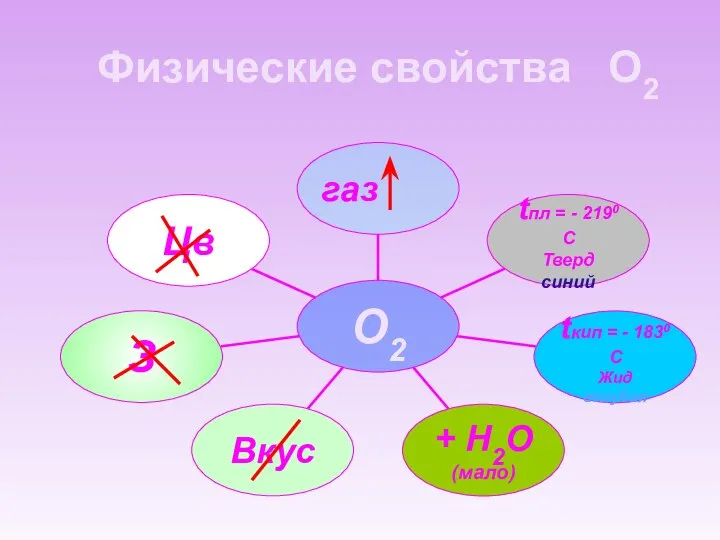
- 9. Физические свойства О2
- 10. Аллотропные модификации 3О2 → 2О3 кислород озон О3 → О + О2 озон атомарный кислород сильный
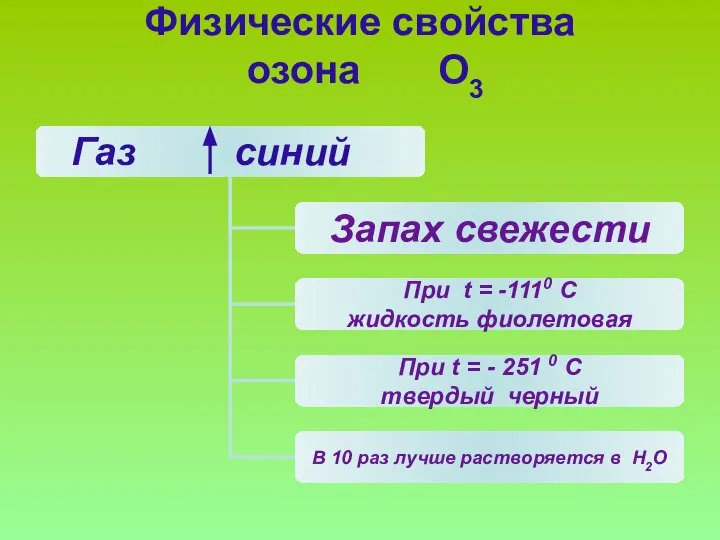
- 11. Физические свойства озона О3
- 12. Не ядовит, поддерживает процессы дыхания, горения, окисления, гниения Быстро разрушает резину, обесцвечивает красители, обладает бактерицидными свойствами,
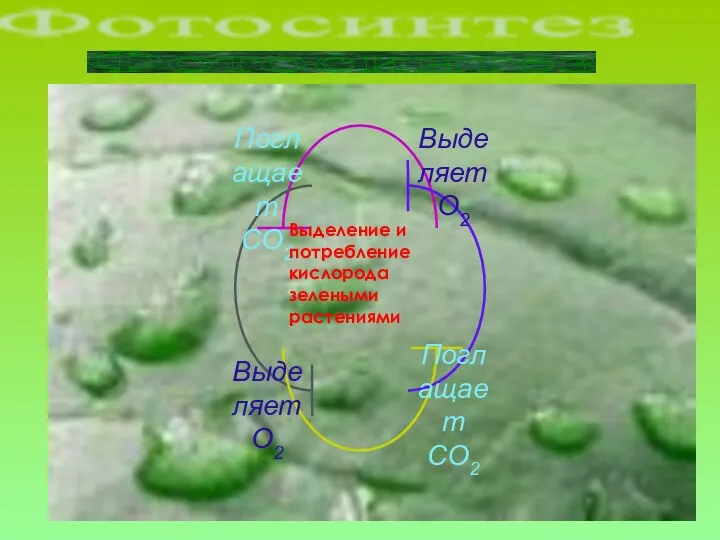
- 14. Выделение и потребление кислорода зелеными растениями Фотосинтез
- 15. В промышленности кислород получают Из жидкого воздуха Электролизом воды Н2О = Н2 + О2 2 2
- 16. В лаборатории кислород получают KClO3⭢ KCl + O2 KMnO4 ⭢ K2MnO4 + MnO2 + O2 2
- 17. Способы собирания Вытеснением воды Вытеснением воздуха
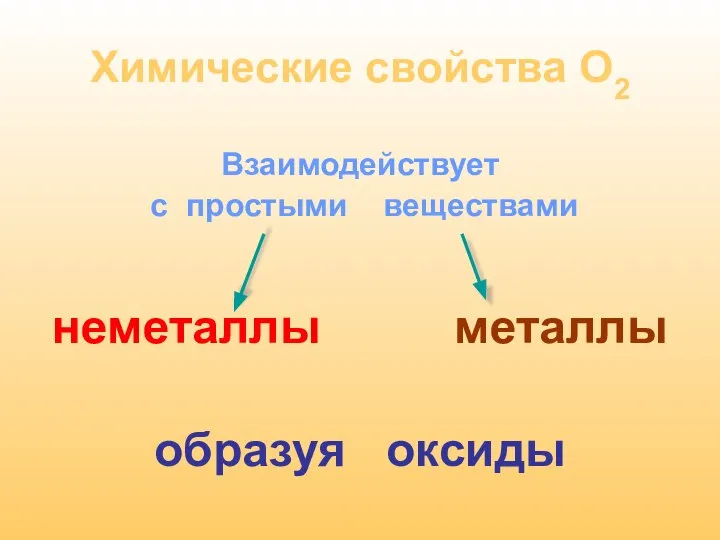
- 18. Химические свойства О2 Взаимодействует с простыми веществами неметаллы металлы образуя оксиды
- 19. Неметаллы СЕРА S + O2→SO2 СЕРА СЕРА СЕРА
- 20. P + O2 → P2O5 Неметаллы Фосфор Горение фосфора 4 5 2
- 21. Металлы 3 Fe + O2 2 ⭢ Fe3O4 ржавчина железо железо железо
- 22. Металлы Са + О 2 → СаО 2 2 негашеная известь кальций
- 23. Сложные вещества С3Н8 + О2→ СО2⭡ + Н2О При горении сложных веществ образуется столько продуктов, сколько
- 25. Скачать презентацию















 ОБЩАЯ ХИМИЯ 11 КЛАСС РАЗДЕЛ «ВЕЩЕСВА И ИХ СВОЙСТВА»
ОБЩАЯ ХИМИЯ 11 КЛАСС РАЗДЕЛ «ВЕЩЕСВА И ИХ СВОЙСТВА» Кислотность и основность рганических соединений. Инфракрасная спектроскопия
Кислотность и основность рганических соединений. Инфракрасная спектроскопия КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ КУБАНСКИЙ МЕДИЦИНСКИЙ ИНСТИТУТ КАФЕДРА ФУНДАМЕНТАЛЬНОЙ И КЛИНИЧЕСКОЙ БИОХИМ
КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ КУБАНСКИЙ МЕДИЦИНСКИЙ ИНСТИТУТ КАФЕДРА ФУНДАМЕНТАЛЬНОЙ И КЛИНИЧЕСКОЙ БИОХИМ Биогеотехнология
Биогеотехнология Скорость химической реакции (химическая кинетика )
Скорость химической реакции (химическая кинетика ) Реакционная способность твердых тел и способы ее регулирования
Реакционная способность твердых тел и способы ее регулирования Пестициды. Применение пестицидов
Пестициды. Применение пестицидов Валентность. Правила составления формул бинарных соединений
Валентность. Правила составления формул бинарных соединений Химические компоненты клетки. Неорганические компоненты
Химические компоненты клетки. Неорганические компоненты Презентация по Химии "Харчові добавки" - скачать смотреть бесплатно
Презентация по Химии "Харчові добавки" - скачать смотреть бесплатно Генетика человека с основами медицинской генетики.(Лекция 2)
Генетика человека с основами медицинской генетики.(Лекция 2) Гели (Студни)
Гели (Студни) Сероводород в природе. Получение сероводорода синтетическим способом
Сероводород в природе. Получение сероводорода синтетическим способом Операции термической обработки
Операции термической обработки Азотсодержащие органические соединения. Амины. Анилинароматический амин
Азотсодержащие органические соединения. Амины. Анилинароматический амин 9 класс Урок №7. Сложные эфиры. Жиры. Составитель презентации – учитель химии МОУ СОШ г. Холма Насонова Т.А.
9 класс Урок №7. Сложные эфиры. Жиры. Составитель презентации – учитель химии МОУ СОШ г. Холма Насонова Т.А. Анализ качества лекарственных веществ, определяемых методом комплексонометрии
Анализ качества лекарственных веществ, определяемых методом комплексонометрии Вторая группа главная подгруппа наряду с семейством щелочноземельных металлов включает и два типических элемента –бериллий и ма
Вторая группа главная подгруппа наряду с семейством щелочноземельных металлов включает и два типических элемента –бериллий и ма Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады)
Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады) Алмазы, искусственный и естественный рост
Алмазы, искусственный и естественный рост Своя Игра Химия
Своя Игра Химия Тұздар. Құрамы және химиялық қасиеттері
Тұздар. Құрамы және химиялық қасиеттері Основные виды и понятия курса органической химии в старшей школе
Основные виды и понятия курса органической химии в старшей школе Anionic Polymerization
Anionic Polymerization Ліпіди. Класифікація ліпідів
Ліпіди. Класифікація ліпідів Статья двумя способами. Приготовление катализатора
Статья двумя способами. Приготовление катализатора Chemical physics. Atomic structure
Chemical physics. Atomic structure Сплавы
Сплавы