Содержание
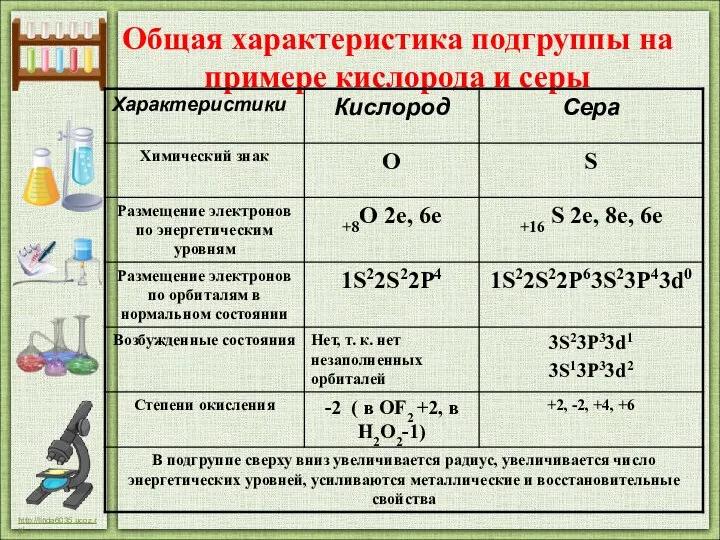
- 2. Общая характеристика подгруппы на примере кислорода и серы
- 3. Я.Берцелиус К И С Л О Р О Д– это вещество, вокруг которого вращается вся земная
- 4. В 1750 году М.В.Ломоносов на основании своих опытов доказал, что в состав воздуха входит вещество, окисляющее
- 5. Кислород был открыт английским химиком Джозефом ПристлиДжозефом Пристли 1 августаДжозефом Пристли 1 августа 1774 года путём
- 6. В 1771 году – это вещество было получено шведским химиком Карлом Вильгельмом Шееле. Он прокаливал селитру
- 7. Лавуазье Антуан Лоран в 1775 году установил, что кислород входит в состав воздуха и содержится во
- 8. 1. Элемент кислород находится в VI группе, главной подгруппе, II периоде, порядковый номер №8, Ar =
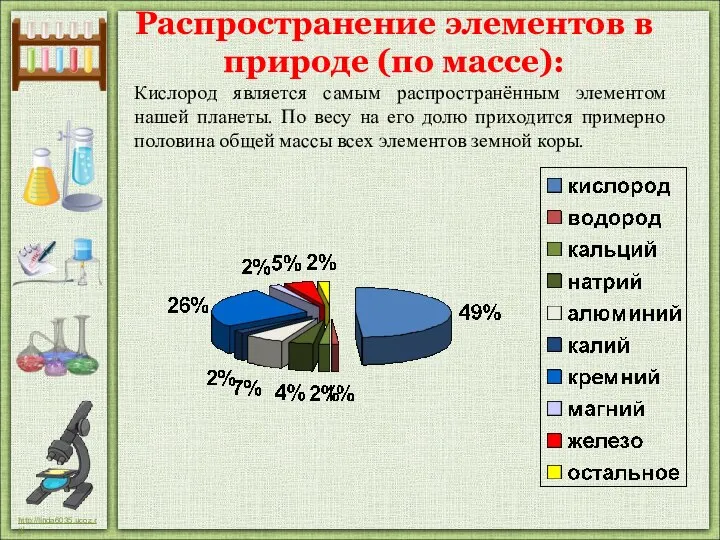
- 9. 5. В земной коре его 49% по массе, в гидросфере – 89% по массе. 6. В
- 10. Распространение элементов в природе (по массе): Кислород является самым распространённым элементом нашей планеты. По весу на
- 11. Способы получения и собирания кислорода А) В природе: Кислород в природе образуется в процессе фотосинтеза. 6СО2
- 12. Б) В промышленности: Перегонкой сжиженного воздуха при t = - 1830 С под давлением. В) В
- 13. Д) некоторых высших оксидов: 4CrO3= 2Cr2O3 + 3О2; 2PbO2 = 2PbO + О2; 3MnO2 = Mn3O4
- 14. Способы получения и собирания кислорода. ж) перманганата калия при нагревании: 2KMnO4 –t°→ K2MnO4 + MnO2 +
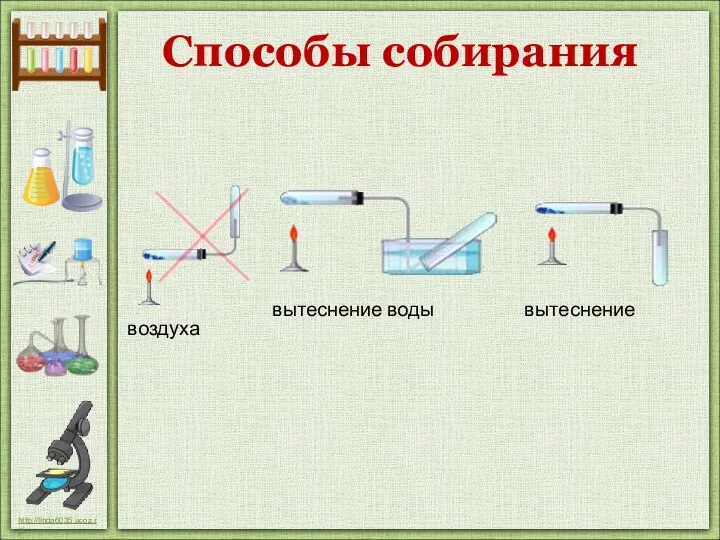
- 15. Способы собирания вытеснение воды вытеснение воздуха
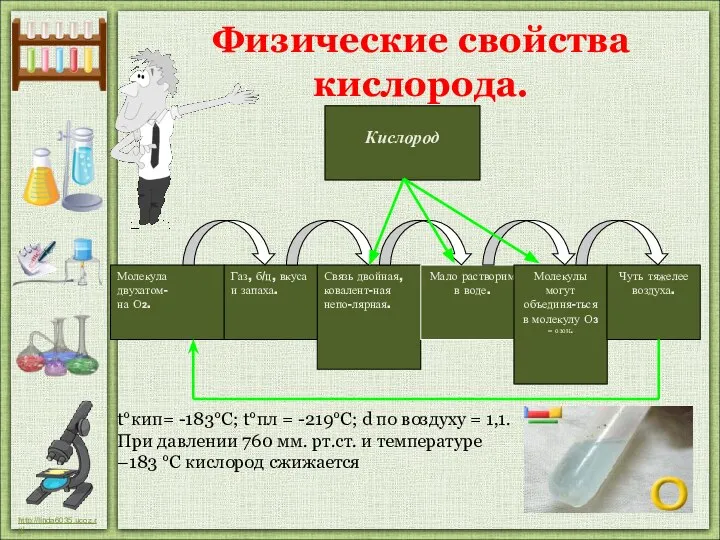
- 16. Физические свойства кислорода. t°кип= -183°С; t°пл = -219°C; d по воздуху = 1,1. При давлении 760
- 17. Аллотропия- существование какого-либо элемента в виде нескольких простых веществ.
- 18. Взаимодействие веществ с кислородом называется окислением. С кислородом реагируют все элементы, кроме Au, Pt, He, Ne
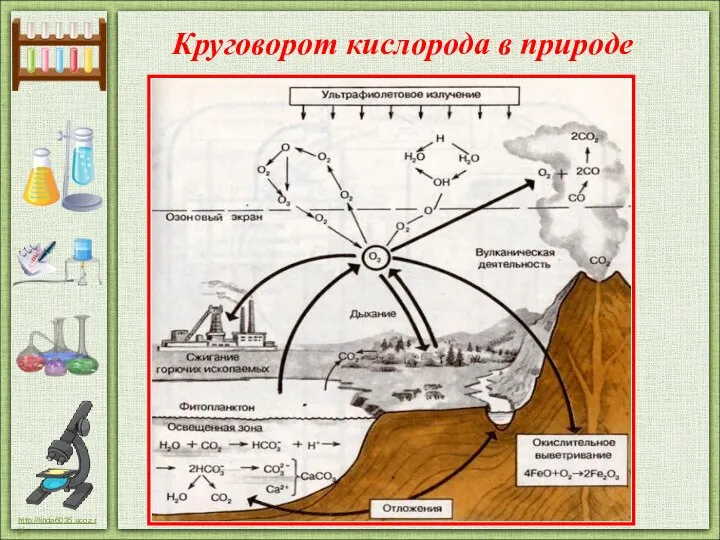
- 19. Круговорот кислорода в природе
- 20. Находит широкое применение в медицине и промышленности. При высотных полётах лётчиков снабжают специальными приборами с кислородом.
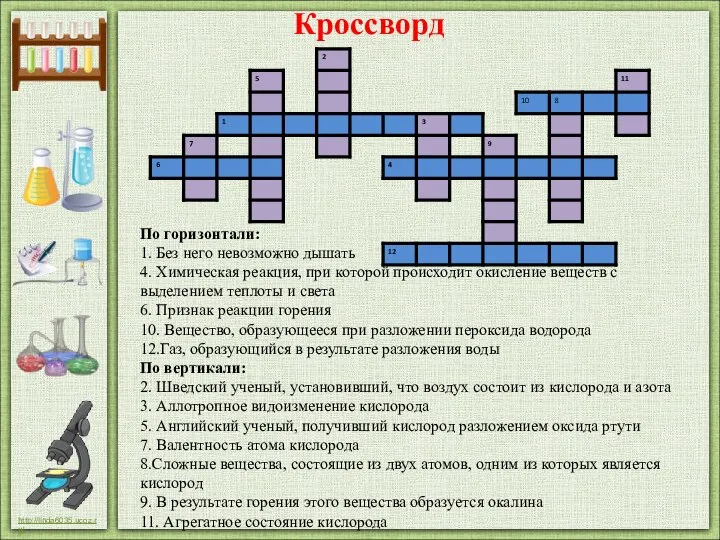
- 21. По горизонтали: 1. Без него невозможно дышать 4. Химическая реакция, при которой происходит окисление веществ с
- 22. Домашнее задание: § 20, №1-2
- 24. Скачать презентацию















 Периодический закон Д.И. Менделеева. Строение атома
Периодический закон Д.И. Менделеева. Строение атома Лаборатория в домашних условиях. Мастер-класс
Лаборатория в домашних условиях. Мастер-класс Магматичні родовища
Магматичні родовища Выбраковка результатов химического анализа
Выбраковка результатов химического анализа Роль витаминов в обмене веществ
Роль витаминов в обмене веществ Химиялық пәндер. Алкалоидтар
Химиялық пәндер. Алкалоидтар СЕРОЛОГИЧЕСКИЕ РЕАКЦИИ
СЕРОЛОГИЧЕСКИЕ РЕАКЦИИ  Методы исследования химического состава нефти и продуктов ее переработки
Методы исследования химического состава нефти и продуктов ее переработки Презентация Электролиты
Презентация Электролиты Менделеевский период
Менделеевский период Настольная образовательная игра по химии. Мастер - класс
Настольная образовательная игра по химии. Мастер - класс Кількість речовини в хімії
Кількість речовини в хімії  Гігієна води. Лекція 6
Гігієна води. Лекція 6 Природные соединения кремния
Природные соединения кремния Очищение грязной воды
Очищение грязной воды Органика – 4 галогенпроизводные
Органика – 4 галогенпроизводные Производство шампуня. Технология
Производство шампуня. Технология Роль побутової хімії у житті
Роль побутової хімії у житті Строение вещества. Химические элементы
Строение вещества. Химические элементы ЖИРИ, ЇХ ЗНАЧЕННЯ Виконала: учениця 9-А класу СЗШ №90 Людмила Зимницька Прийняла: вчитель з хімії Чучвера І. В.
ЖИРИ, ЇХ ЗНАЧЕННЯ Виконала: учениця 9-А класу СЗШ №90 Людмила Зимницька Прийняла: вчитель з хімії Чучвера І. В.  Презентация по Химии "РАСТВОРЫ ЭЛЕКТРОЛИТОВ" - скачать смотреть
Презентация по Химии "РАСТВОРЫ ЭЛЕКТРОЛИТОВ" - скачать смотреть  Производство органических препаратов ароматического ряда
Производство органических препаратов ароматического ряда ХІМІЯ В КОСМЕТИЦІ
ХІМІЯ В КОСМЕТИЦІ  Уксусная кислота
Уксусная кислота Производство извести в домашних условиях. 7 класс
Производство извести в домашних условиях. 7 класс Спирты. Классификация спиртов
Спирты. Классификация спиртов Геологические структуры МПИ. Группа доминерализационных структур
Геологические структуры МПИ. Группа доминерализационных структур Электрохимические производства
Электрохимические производства