Содержание
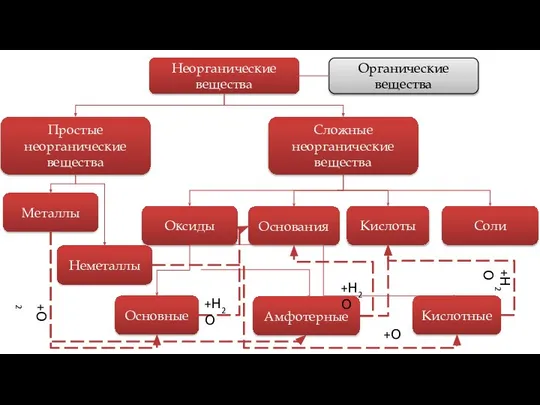
- 2. Сложные неорганические вещества Оксиды Основания Кислоты Соли Основные Амфотерные Кислотные Простые неорганические вещества Металлы Неметаллы Неорганические
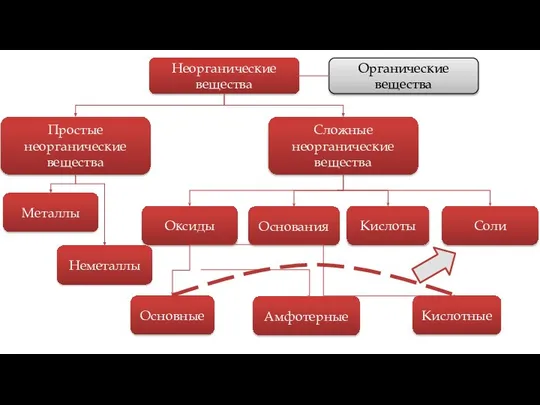
- 3. Сложные неорганические вещества Оксиды Основания Кислоты Соли Основные Амфотерные Кислотные Простые неорганические вещества Металлы Неметаллы Неорганические
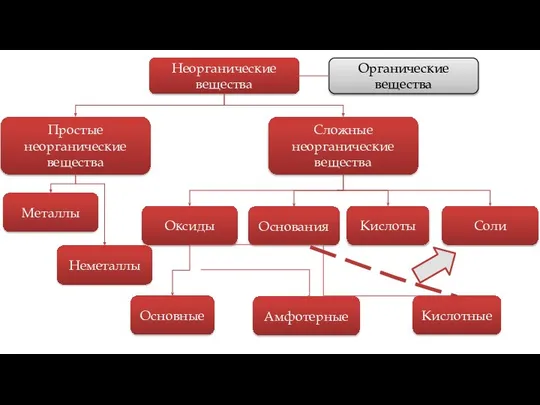
- 4. Сложные неорганические вещества Оксиды Основания Кислоты Соли Основные Амфотерные Кислотные Простые неорганические вещества Металлы Неметаллы Неорганические
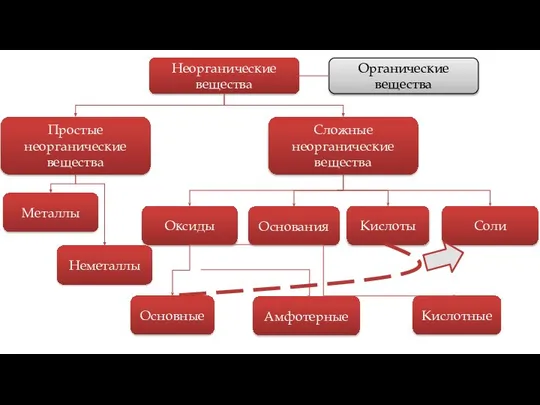
- 5. Сложные неорганические вещества Оксиды Основания Кислоты Соли Основные Амфотерные Кислотные Простые неорганические вещества Металлы Неметаллы Неорганические
- 6. Сложные неорганические вещества Оксиды Основания Кислоты Соли Основные Амфотерные Кислотные Простые неорганические вещества Металлы Неметаллы Неорганические
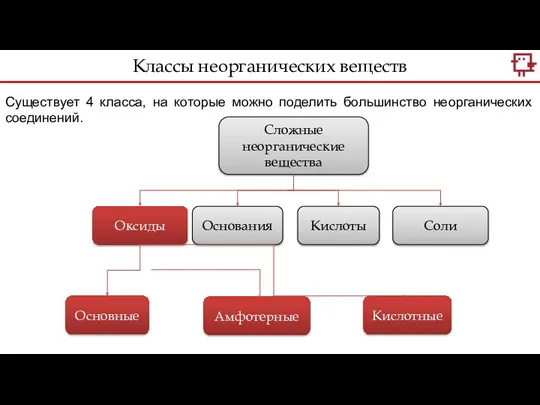
- 7. Существует 4 класса, на которые можно поделить большинство неорганических соединений. Классы неорганических веществ Сложные неорганические вещества
- 8. ? ? ? Повторение
- 9. CaO + H2O ? CuCl2 + NaOH ? Li2O + H2O ? CaCO3 + SiO2 ?
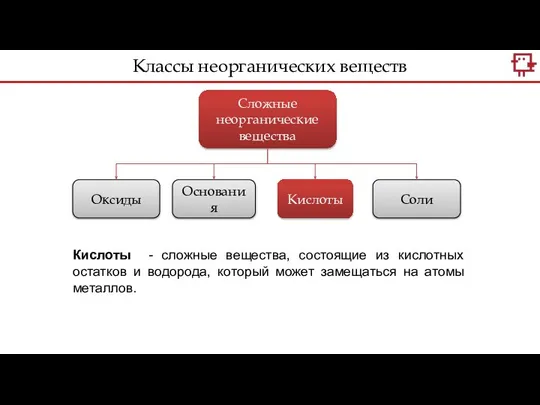
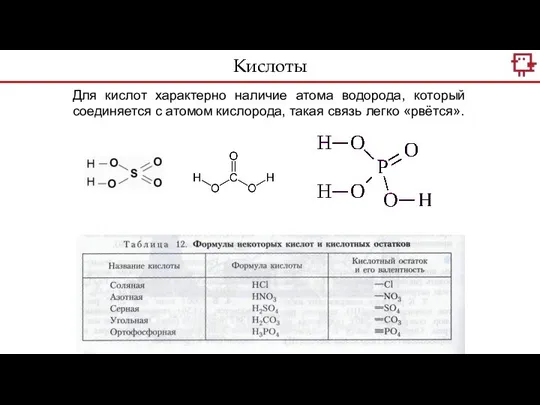
- 10. Сложные неорганические вещества Оксиды Основания Кислоты Соли Кислоты - сложные вещества, состоящие из кислотных остатков и
- 11. Для кислот характерно наличие атома водорода, который соединяется с атомом кислорода, такая связь легко «рвётся». Кислоты
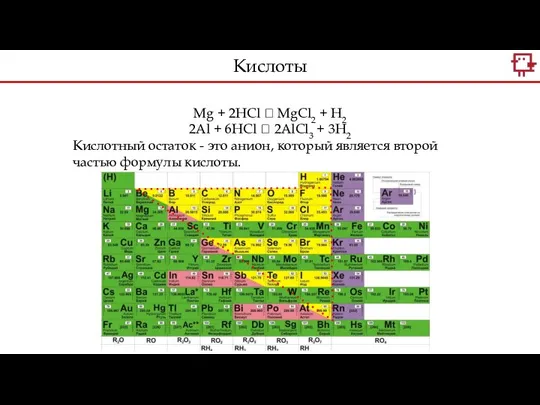
- 12. Mg + 2HCl ? MgCl2 + H2 2Al + 6HCl ? 2AlCl3 + 3H2 Кислотный остаток
- 13. Mg + 2HCl ? MgCl2 + H2 2Al + 6HCl ? 2AlCl3 + 3H2 Кислотные остатки
- 14. Физические свойства. Многие кислоты – жидкости: серная, азотная и т.д. Некоторые твёрдые: кремниевая H2SiO3, ортофосфорная H3PO4,
- 15. Физические свойства. Многие кислоты – жидкости: серная, азотная и т.д. Некоторые твёрдые: кремниевая H2SiO3, ортофосфорная H3PO4,
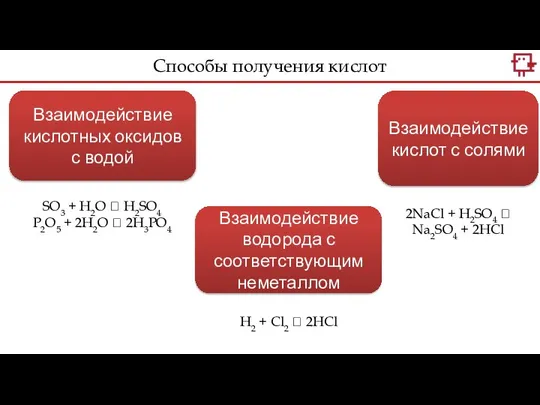
- 16. Взаимодействие кислотных оксидов с водой Взаимодействие водорода с соответствующим неметаллом Взаимодействие кислот с солями SO3 +
- 17. Кислоты
- 18. Химические свойства. C металлами. Если металл находится в ряду активности до водорода, то выделяется водород и
- 19. Химические свойства. 2. C основными оксидами. Образуется соль и вода. CuO + H2SO4 ? CuSO4 +
- 20. Химические свойства. 3. С основаниями. Образуется соль и вода. NaOH + HCl ? NaCl + H2O
- 21. Химические свойства. 4. С солями. В соответствии с рядом кислот (каждая предыдущая кислота может вытеснить из
- 22. Химические свойства. 5. При нагревании некоторые кислоты разлагаются. H2SO3 ? H2O + SO2 Кислоты
- 23. Кислоты
- 25. Скачать презентацию











 XIII конференция ИХТРЭМС Научно-практические проблемы в области химии и химических технологий
XIII конференция ИХТРЭМС Научно-практические проблемы в области химии и химических технологий Битумы природного происхождения
Битумы природного происхождения Brass
Brass Stirring in liquid media
Stirring in liquid media Обмен углеводов, белков, липидов. (Лекция 4)
Обмен углеводов, белков, липидов. (Лекция 4) Қатты күйдегі препараттар
Қатты күйдегі препараттар Биологические катализаторы
Биологические катализаторы Твёрдое состояние вещества
Твёрдое состояние вещества Наукові напрямки практичної реалізації принципів «Зеленої» хімії
Наукові напрямки практичної реалізації принципів «Зеленої» хімії Презентация Жидкие кристаллы
Презентация Жидкие кристаллы  Металлическая связь
Металлическая связь Ароматические и гетероциклические соединения. Электронная спектроскопия
Ароматические и гетероциклические соединения. Электронная спектроскопия Презентация по Химии "Полезные ископаемые." - скачать смотреть бесплатно_
Презентация по Химии "Полезные ископаемые." - скачать смотреть бесплатно_ Штучні алмази в техниці
Штучні алмази в техниці Нафта, сланцевий газ, екологія середовища Підготувала учениця 11 Б класу Кандибка Ольга
Нафта, сланцевий газ, екологія середовища Підготувала учениця 11 Б класу Кандибка Ольга  Минералы земной коры
Минералы земной коры Антидиабеттік қауынқұрттың реологиялық қасиетін анықтау
Антидиабеттік қауынқұрттың реологиялық қасиетін анықтау Серная кислота H2SO4
Серная кислота H2SO4 Гидроксид аммония
Гидроксид аммония Алкены. Химические свойства этилена
Алкены. Химические свойства этилена Полимеры
Полимеры Презентация по Химии "Химия, нефтехимия. Производство неорганических веществ" - скачать смотреть
Презентация по Химии "Химия, нефтехимия. Производство неорганических веществ" - скачать смотреть  Обсидиан
Обсидиан Галогены
Галогены Теория химического строения органических соединений А.М. Бутлерова (ТХС)
Теория химического строения органических соединений А.М. Бутлерова (ТХС) Нанотехнологии. Методы получения наноматериалов. (Лекция 2)
Нанотехнологии. Методы получения наноматериалов. (Лекция 2) Технологические свойства жиров
Технологические свойства жиров Алкадиены
Алкадиены