Содержание
- 2. НПЗ вырабатывают: горючие и смазочные материалы, твердые и полужидкие смеси парафинов (парафин, церезин, вазелин), битумы, электродный
- 3. 1. Предварительная стадия обезвоживают, обессоливают, очищают от кокса путем продолжительного отстаивания в подогретом состоянии 180 гр.С
- 4. 2. перегонка Насос Трубчатая печь 320 гр.С Ректификационная колонна Пары охлаждаются (флегмой) сгущение в конденсаторе Бензин
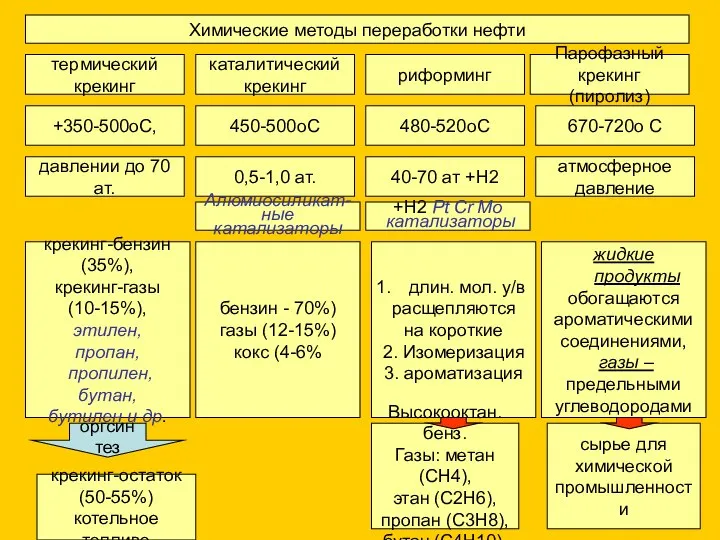
- 5. Химические методы переработки нефти термический крекинг каталитический крекинг риформинг Парофазный крекинг (пиролиз) +350-500оС, 450-500оС 480-520оС 670-720о
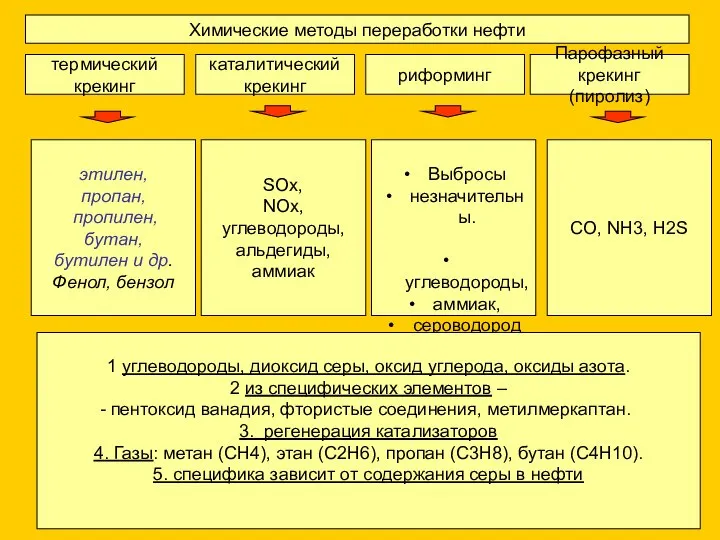
- 6. Химические методы переработки нефти термический крекинг каталитический крекинг риформинг Парофазный крекинг (пиролиз) этилен, пропан, пропилен, бутан,
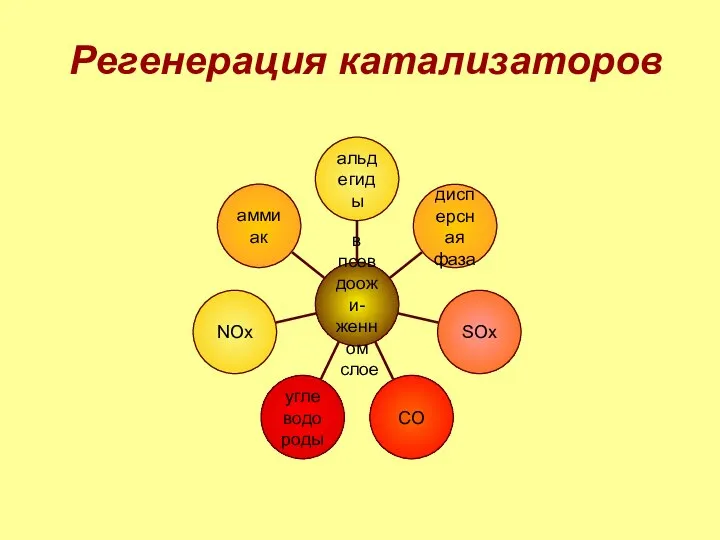
- 7. Регенерация катализаторов
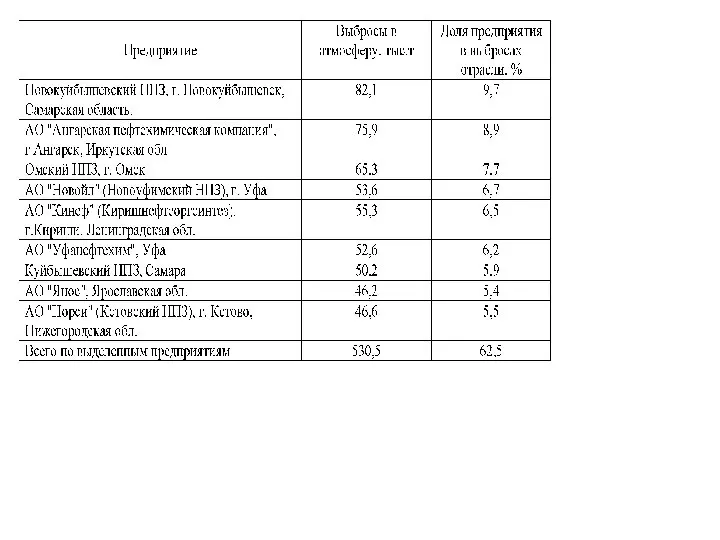
- 8. Со сточными водами НПЗ в поверхностные воды поступает нефтепродукты, сульфаты, хлориды, соединения азота, фенолы, соли тяжелых
- 9. токсичные отходы состоят из: биологически активного газа, который остается после эксплуатации очистных сооружений, осадков из резервуаров,
- 11. Производство серной кислоты Серная кислота – H2SO4 бесцветная тяжелая маслянистая жидкость, кипящая при 304оС и кристаллизующаяся
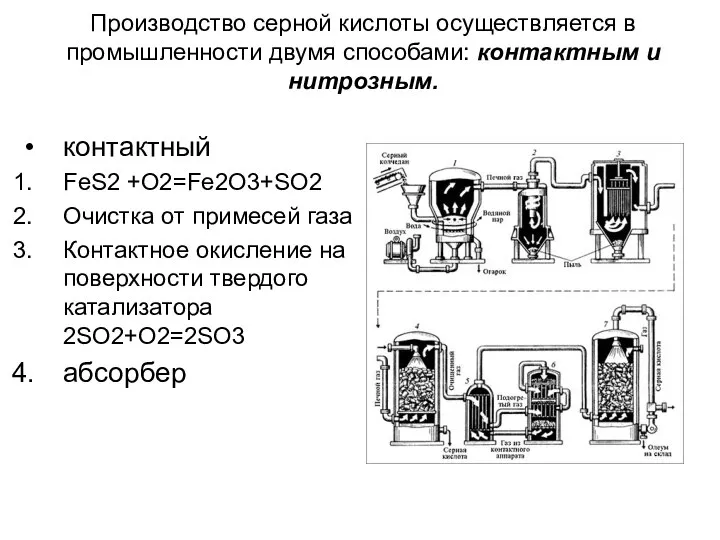
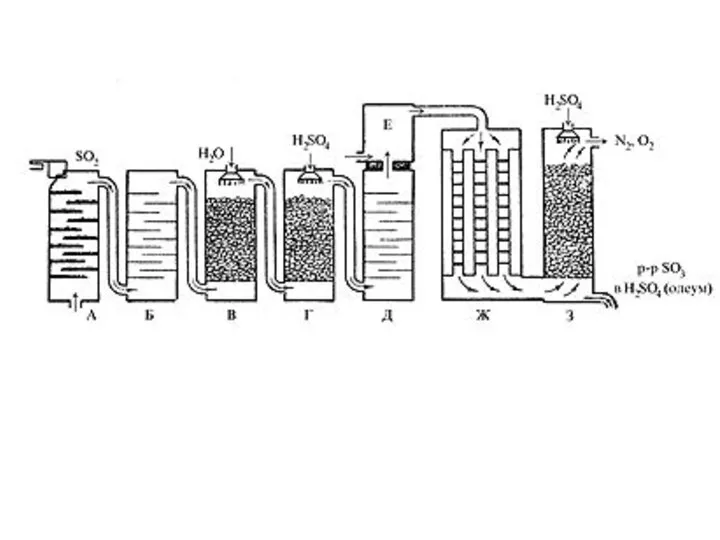
- 12. Производство серной кислоты осуществляется в промышленности двумя способами: контактным и нитрозным. контактный FeS2 +O2=Fe2O3+SO2 Очистка от
- 14. Нитрозный способ – известен с середины 18 в. 1. 2SO2+H2O+NO2=H2SO4+NO ОКИСЛИТЕЛЕМ ЯВЛЯЕТСЯ NO2, ОН ВОССТАНАВЛИВАЕТСЯ 2.
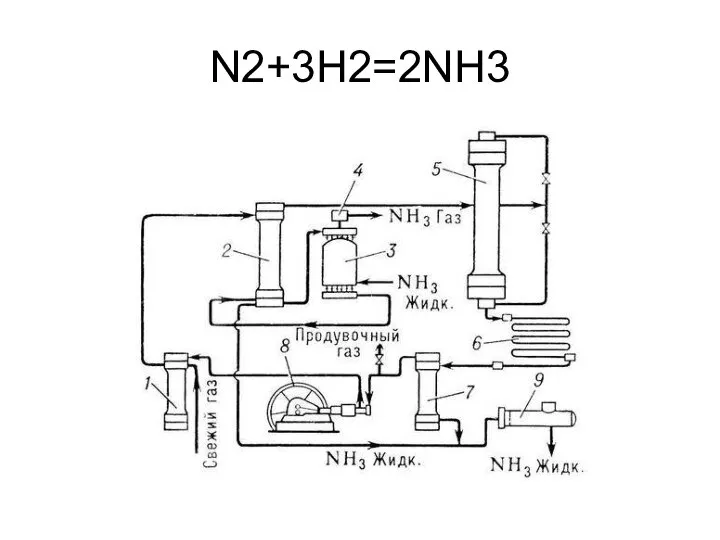
- 15. Производство аммиака
- 16. N2+3H2=2NH3
- 17. Для получения 1 т NH3 – 3000 куб.м азото-водородной смеси, 90 куб. м воды, 1750 кВт*ч
- 18. Производство азотной кислоты
- 19. Азотная кислота занимает второе место по объему в производстве кислот после серной.
- 20. Исходным веществом для получения азотной кислоты является аммиак – NH3.
- 21. Получение слабой азотной кислоты имеет три стадии: 1. окисление аммиака до окиси азота NO; (аммиак и
- 22. Окисление аммиака проводится при температуре 800-900оС в присутствии катализатора, изготовленного из сплава платины и родия.
- 23. Кроме платины, могут применяться менее активные катализаторы на основе окиси кобальта или железа с активирующими добавками.
- 24. Для получения 1 т разбавленной азотной кислоты в установках с нормальным атмосферным давлением расходуется 300 кг
- 25. Выброс HNO3 может составлять до 3 кг на 1 т. в пересчете на 100%-ную кислоту.
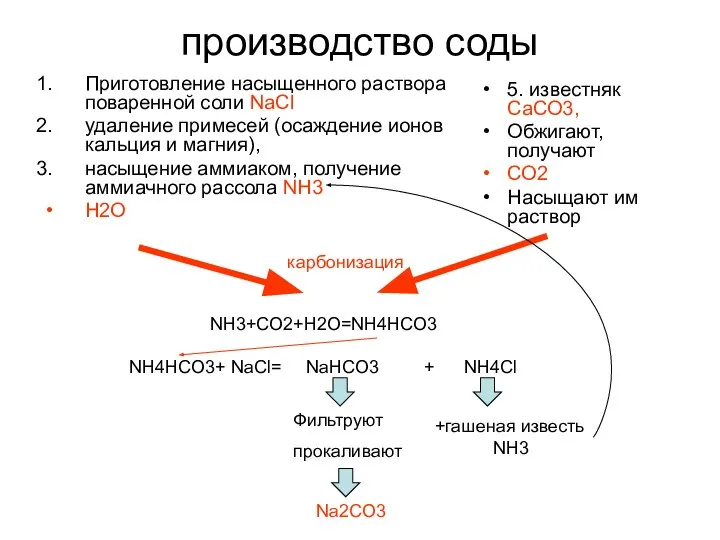
- 26. производство соды Приготовление насыщенного раствора поваренной соли NaCl удаление примесей (oсаждение ионов кальция и магния), насыщение
- 27. При получении 1 т соды - образуется около 1 т NH4Cl, раствор которого обрабатывают известковым молоком
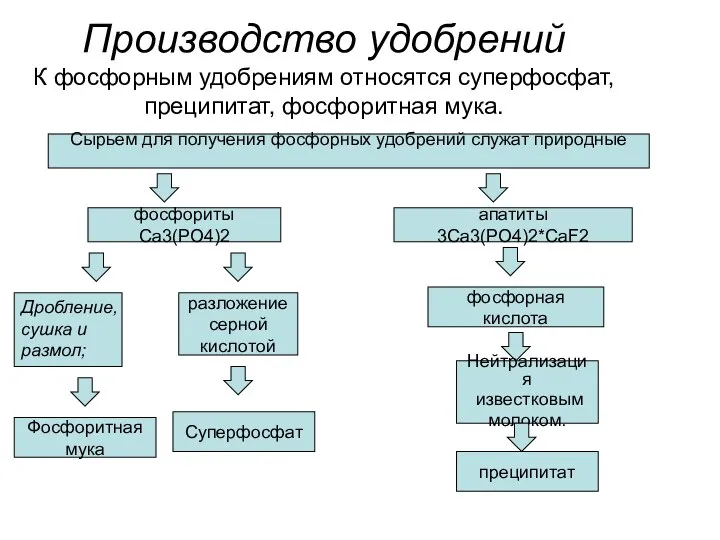
- 28. Производство удобрений К фосфорным удобрениям относятся суперфосфат, преципитат, фосфоритная мука. Сырьем для получения фосфорных удобрений служат
- 29. Главный загрязнитель при производстве фосфорных удобрений – фтористые соединения. Фториды присутствуют как в газообразном состоянии, так
- 30. Калийные удобрения это хлорид калия (KCl), сульфат калия (K2SO4) сульфат калия-магния (K2SO4*2MgSO4). Сырьем для получения хлористого
- 31. Производство калийных удобрений включает: 1 отделение хлористого калия от хлорида натрия и глины. 2. Сильвинит размалывают,
- 32. В технологии изготовления хлорида калия можно выделить 4 этапа, при которых происходят наиболее существенные выбросы в
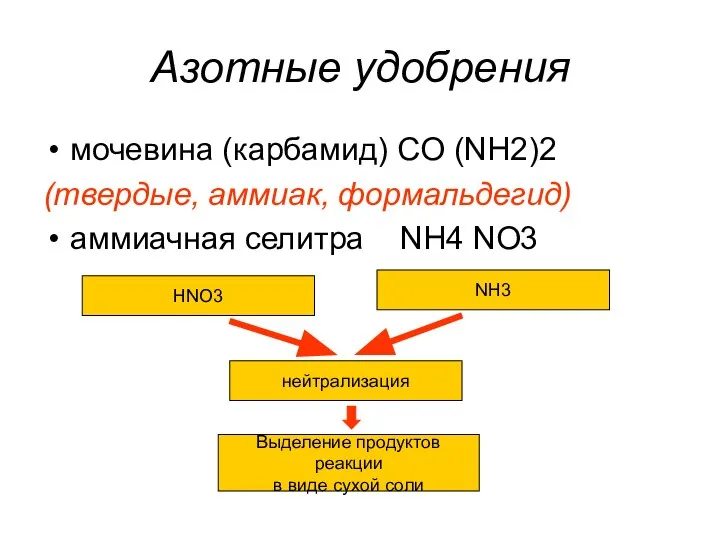
- 33. Азотные удобрения мочевина (карбамид) CO (NH2)2 (твердые, аммиак, формальдегид) аммиачная селитра NH4 NO3 HNO3 NH3 нейтрализация
- 34. ядохимикаты Инсектициды: 1. парижская зелень 3 Сu(AsO2)2*Cu(CH3COO)2 Cырье - As2O3 руды обжигают соли 2. Фтористый и
- 35. II. Фунгициды (грибковые заболевания) Бордосская жидкость (медь содерж.) Получается смешиванием медного купороса с известковым молоком 2.
- 37. Скачать презентацию
























 Определение физических свойств минералов
Определение физических свойств минералов История возникновения химии
История возникновения химии Нанотехнологии в моей будущей профессии Работу выполнил выпускник КГОУ НПО ПУ №26 2010г., ныне учащийся 2 курса КГОУ СПО Педагогиче
Нанотехнологии в моей будущей профессии Работу выполнил выпускник КГОУ НПО ПУ №26 2010г., ныне учащийся 2 курса КГОУ СПО Педагогиче Строение вещества. Химическая связь
Строение вещества. Химическая связь Динамический характер адсорбции. Лекция 2
Динамический характер адсорбции. Лекция 2 Дисперсные
Дисперсные  Процессы минералообразования
Процессы минералообразования Презентация по Химии "Металлическая связь" - скачать смотреть
Презентация по Химии "Металлическая связь" - скачать смотреть  Получение, собирание и распознавание водорода
Получение, собирание и распознавание водорода Презентация по Химии "ХІМІЯ" - скачать смотреть бесплатно_
Презентация по Химии "ХІМІЯ" - скачать смотреть бесплатно_ Топливо. Виды топлива
Топливо. Виды топлива Степень окисления. Бинарные соединения
Степень окисления. Бинарные соединения Презентация по Химии "Как определить качество меда" - скачать смотреть
Презентация по Химии "Как определить качество меда" - скачать смотреть  Специфика химии как науки (определение предмета химии)
Специфика химии как науки (определение предмета химии) Викторина «Что это?»
Викторина «Что это?» Рассмотрение продуктов цинкового производства при помощи аналитических методов анализа
Рассмотрение продуктов цинкового производства при помощи аналитических методов анализа Квантовая механика – теоретическая основа современной химии
Квантовая механика – теоретическая основа современной химии Химические реакции с участием макромолекул
Химические реакции с участием макромолекул Периодическая система элементов Д.И. Менделеева
Периодическая система элементов Д.И. Менделеева Составление электронных формул и электронно-графических схем строения атома
Составление электронных формул и электронно-графических схем строения атома Презентация по Химии "Професії, пов'язані з хімією" - скачать смотреть бесплатно
Презентация по Химии "Професії, пов'язані з хімією" - скачать смотреть бесплатно Тема урока: Сложные эфиры.
Тема урока: Сложные эфиры. Очищение грязной воды
Очищение грязной воды Симметрия физических свойств кристаллов
Симметрия физических свойств кристаллов Химия - основы общей химии (теория)
Химия - основы общей химии (теория) История создания термометра: как придумали первый градусник?
История создания термометра: как придумали первый градусник? Биохимия печени и крови
Биохимия печени и крови Проект на тему «Екзо- та ендотермічні реакції на службі людства»
Проект на тему «Екзо- та ендотермічні реакції на службі людства»