Содержание
- 2. «Их получают путем горения Или сложных веществ разложения. В них два элемента, один – кислород. Я
- 3. Из предложенного списка выпишите формулы оксидов и оснований СaCl2; BaO; Fe(OH)2; H2SO4; HNO3; CaO; CO2; Ca(OH)2;
- 4. «Они имеют кислый вкус. В них изменяет цвет лакмус. с фиолетового на красный».
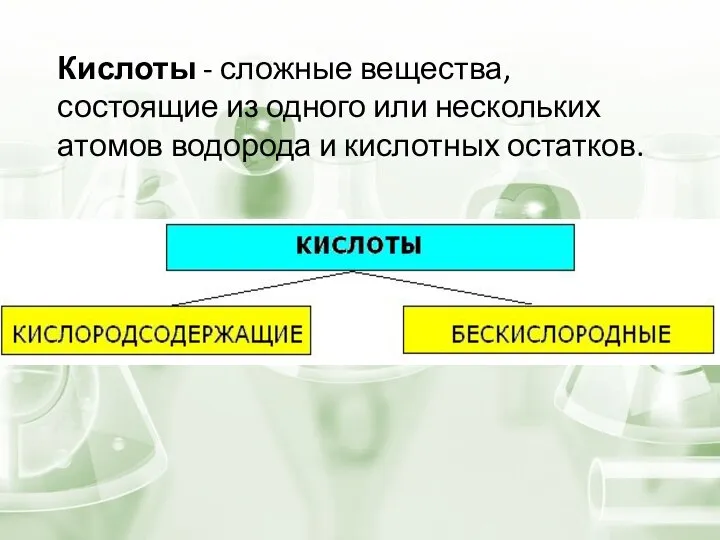
- 5. Кислоты - сложные вещества, состоящие из одного или нескольких атомов водорода и кислотных остатков.
- 6. Физические свойства кислот Многие кислоты, например серная, азотная, соляная – это бесцветные жидкости. Известны также твёрдые
- 7. Способы получения кислот
- 8. ИНДИКАТОРЫ (от лат. indicator – указатель) – вещества, позволяющие следить за составом среды или за протеканием
- 9. Химические свойства кислот 1. Изменяют окраску индикаторов
- 10. 2.Реагируют с металлами в ряду активности до H2 (искл. HNO3 –азотная кислота) Ме + КИСЛОТА =СОЛЬ
- 11. 3. С основными (амфотерными) оксидами – оксидами металлов МехОу + КИСЛОТА= СОЛЬ + Н2О CuO +
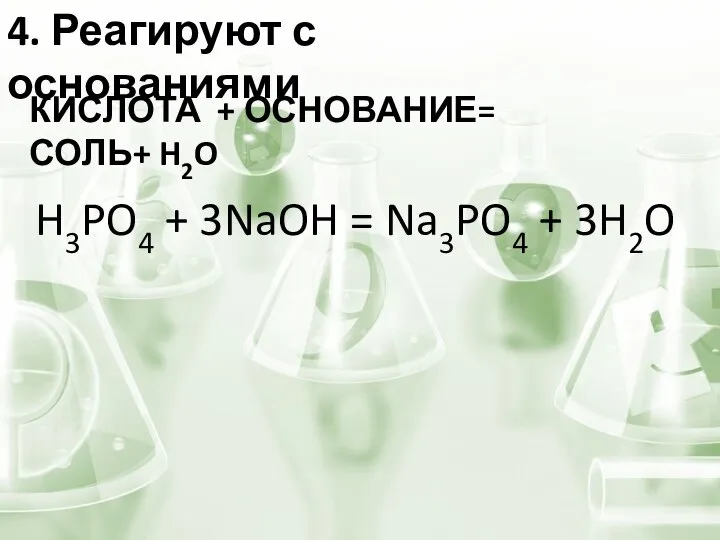
- 12. 4. Реагируют с основаниями КИСЛОТА + ОСНОВАНИЕ= СОЛЬ+ H2O H3PO4 + 3NaOH = Na3PO4 + 3H2O
- 13. 5. Реагируют с солями слабых, летучих кислот - если образуется соль, выпадающая в осадок или выделяется
- 14. 6. Разложение кислородсодержащих кислот при нагревании ( искл. H2SO4 ; H3PO4 ) КИСЛОТА = КИСЛОТНЫЙ ОКСИД
- 15. ХИМИЧЕСКИЕ СВОЙСТВА СОЛЯНОЙ КИСЛОТЫ
- 17. Скачать презентацию












 Ингибиторы коррозии
Ингибиторы коррозии «Соединения химических элементов»
«Соединения химических элементов» Абсорбция, адсорбция, конденсация
Абсорбция, адсорбция, конденсация Алюминий и его соединения
Алюминий и его соединения Разбор контрольной работы. Химия (9 класс)
Разбор контрольной работы. Химия (9 класс) Страшні помилки людства Відкриття радіоактивності людство поставило собі на службу. Атомні електростанції – основні виробники
Страшні помилки людства Відкриття радіоактивності людство поставило собі на службу. Атомні електростанції – основні виробники  Реакции щелочно-земельных металлов (Группа 2) – Mg, Ca
Реакции щелочно-земельных металлов (Группа 2) – Mg, Ca IVA группа С, Si, Ge, Sn, Pb (подгруппа титана)
IVA группа С, Si, Ge, Sn, Pb (подгруппа титана) Внеклеточный матрикс – основа минерализованных тканей Автор – доцент кафедры биохимии Е.А. Рыскина
Внеклеточный матрикс – основа минерализованных тканей Автор – доцент кафедры биохимии Е.А. Рыскина  Брейн – ринг. Мини – ЕГЭ по химии
Брейн – ринг. Мини – ЕГЭ по химии Классификация химических реакций
Классификация химических реакций Презентация Проверим знания по теме «Кремний»
Презентация Проверим знания по теме «Кремний» Ионообменная хроматография
Ионообменная хроматография Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Уравнение состояния идеального газа. Решение задач
Уравнение состояния идеального газа. Решение задач Методы определения подлинности лекарственного растительного сырья
Методы определения подлинности лекарственного растительного сырья Металлы. Общая характеристика
Металлы. Общая характеристика Теоретические аспекты химического осаждения из газовой фазы
Теоретические аспекты химического осаждения из газовой фазы Polygels and Tempoxy-LO in NaClO based formulations
Polygels and Tempoxy-LO in NaClO based formulations Высокоэффективная жидкостная хроматография в анализе готовых лекарственных форм и контроле технологии их производства
Высокоэффективная жидкостная хроматография в анализе готовых лекарственных форм и контроле технологии их производства Химическая промышленность
Химическая промышленность Количество вещества. Число Авагадро. Молярная масса
Количество вещества. Число Авагадро. Молярная масса Приемы обращения с лабораторным оборудованием. Строение пламени
Приемы обращения с лабораторным оборудованием. Строение пламени Теория электролитической диссоциации
Теория электролитической диссоциации Витамины. Классификация витаминов
Витамины. Классификация витаминов Электролитическая диссоциация
Электролитическая диссоциация Woda jako rozpuszczalnik
Woda jako rozpuszczalnik