Содержание
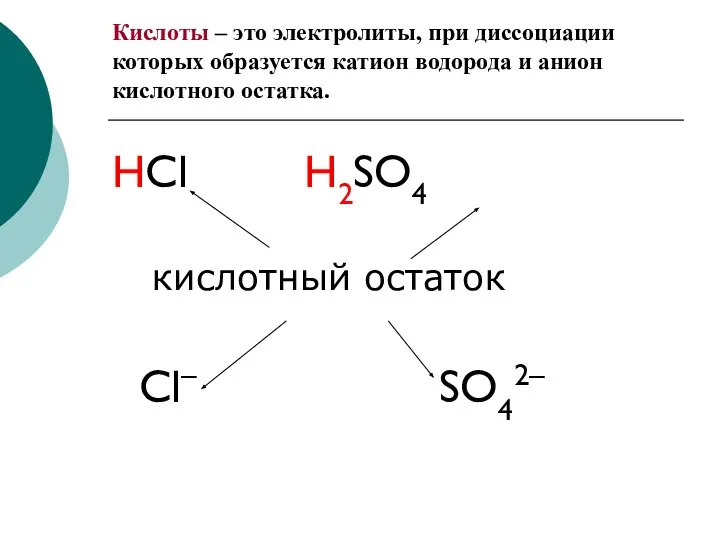
- 2. Кислоты – это электролиты, при диссоциации которых образуется катион водорода и анион кислотного остатка. HCl H2SO4
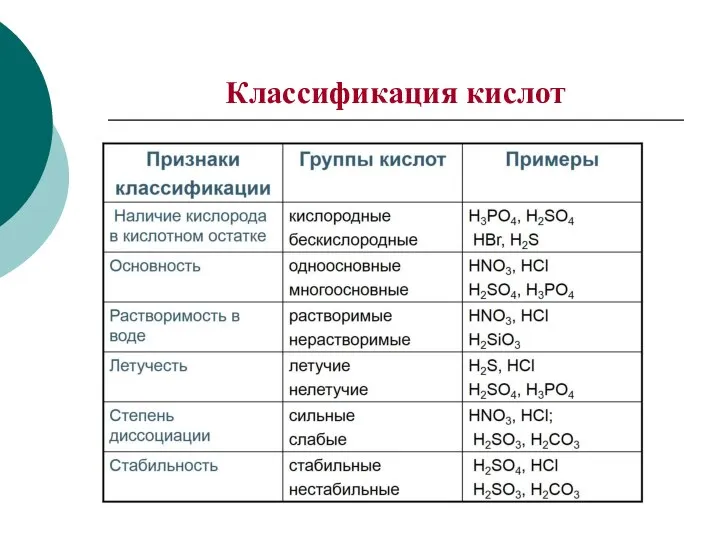
- 3. Классификация кислот
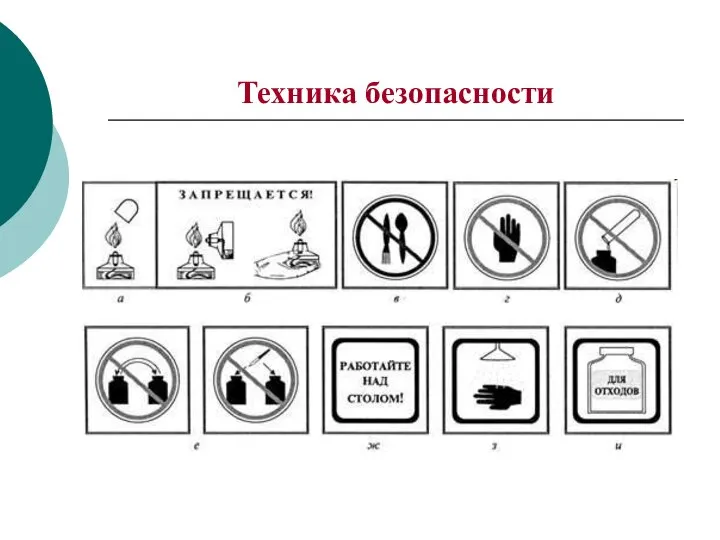
- 4. Техника безопасности
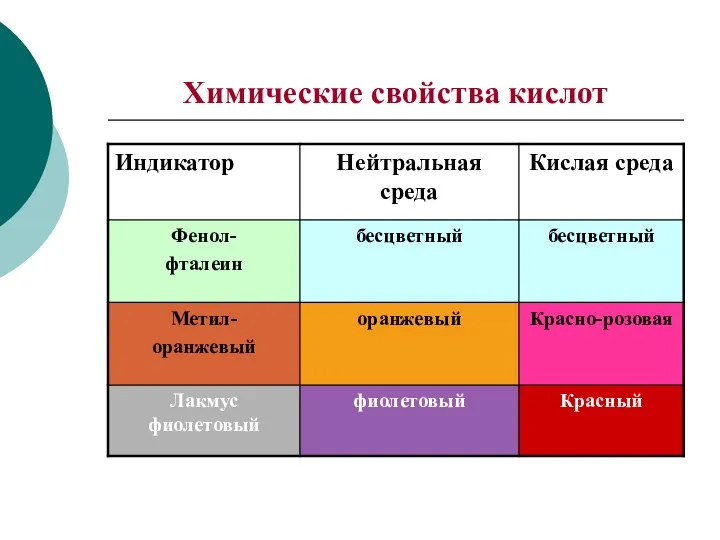
- 5. Химические свойства кислот
- 6. ТИПИЧНЫЕ РЕАКЦИИ КИСЛОТ Кислота + металл = соль + водород (реакция замещения) Условия протекания: металл должен
- 7. ТИПИЧНЫЕ РЕАКЦИИ КИСЛОТ Кислота + оксид металла = соль + вода H2SO4 + CuO = CuSO4
- 8. ТИПИЧНЫЕ РЕАКЦИИ КИСЛОТ Кислота + основание → соль + вода HCl + NaOH = NaCl +
- 9. ТИПИЧНЫЕ РЕАКЦИИ КИСЛОТ Кислота + соль = новая соль + новая кислота Условия протекания: Образование осадка
- 10. Применение кислот
- 12. Скачать презентацию





 Виды лабораторной посуды и её применение в исследовательской работе
Виды лабораторной посуды и её применение в исследовательской работе Коррозия металлов
Коррозия металлов Теория химического строения органических соединений А.М. Бутлерова (ТХС)
Теория химического строения органических соединений А.М. Бутлерова (ТХС) Инновационная технология производства биоэтанола из целлюлозосодежащих продуктов
Инновационная технология производства биоэтанола из целлюлозосодежащих продуктов Периодическая система элементов, предсказание химических свойств элементов на основе таблицы
Периодическая система элементов, предсказание химических свойств элементов на основе таблицы Катализатор Уилкинсона
Катализатор Уилкинсона Топливо. Виды топлива
Топливо. Виды топлива Сульфиды. Лекция 8
Сульфиды. Лекция 8 ГИА. Вопрос А3. Химическая связь
ГИА. Вопрос А3. Химическая связь Физико-химические основы получения лекарственных препаратов. Лекция 2
Физико-химические основы получения лекарственных препаратов. Лекция 2 Витаминдер. Майда еритін витаминдер
Витаминдер. Майда еритін витаминдер Школьный кабинет химии
Школьный кабинет химии Physical chemistry of nanostructured systems.( lecture no. 7)
Physical chemistry of nanostructured systems.( lecture no. 7) Пантотен қышқылы (В3 дәрумені)
Пантотен қышқылы (В3 дәрумені) Kо́бальт (лат. Cobaltum)
Kо́бальт (лат. Cobaltum) НАСЛІДКИ ЧОРНОБИЛЬСЬКОЇ ТРАГЕДІЇ Чорнобиль продемонстрував всемогутність і безсилля людини та застеріг її: не захоплюйся своєю
НАСЛІДКИ ЧОРНОБИЛЬСЬКОЇ ТРАГЕДІЇ Чорнобиль продемонстрував всемогутність і безсилля людини та застеріг її: не захоплюйся своєю  Межлабораторные сравнительные испытания качественных параметров нефтепродуктов
Межлабораторные сравнительные испытания качественных параметров нефтепродуктов Молекулярные массы. Простые и сложные вещества
Молекулярные массы. Простые и сложные вещества Биогенные элементы. Классификация. Топография биогенных элементов в организме человека
Биогенные элементы. Классификация. Топография биогенных элементов в организме человека Надмолекулярные структуры
Надмолекулярные структуры Савченко Анна
Савченко Анна  Простые и сложные вещества Звонарёва Т.И. Учитель биологии МОУ лицей Г. Электрогорск
Простые и сложные вещества Звонарёва Т.И. Учитель биологии МОУ лицей Г. Электрогорск Пентозний шлях
Пентозний шлях Кристаллические системы
Кристаллические системы Анализ лекарственных смесей
Анализ лекарственных смесей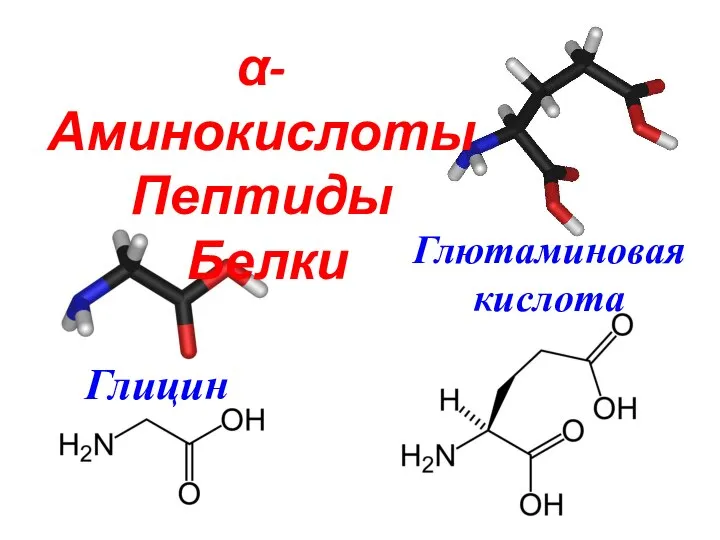 α-Аминокислоты
α-Аминокислоты Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Л.Н.Толстой утверждал: «Вино губит телесное здоровье людей, губит умственные способности, губит благосостояние семей и, что уж
Л.Н.Толстой утверждал: «Вино губит телесное здоровье людей, губит умственные способности, губит благосостояние семей и, что уж