Содержание
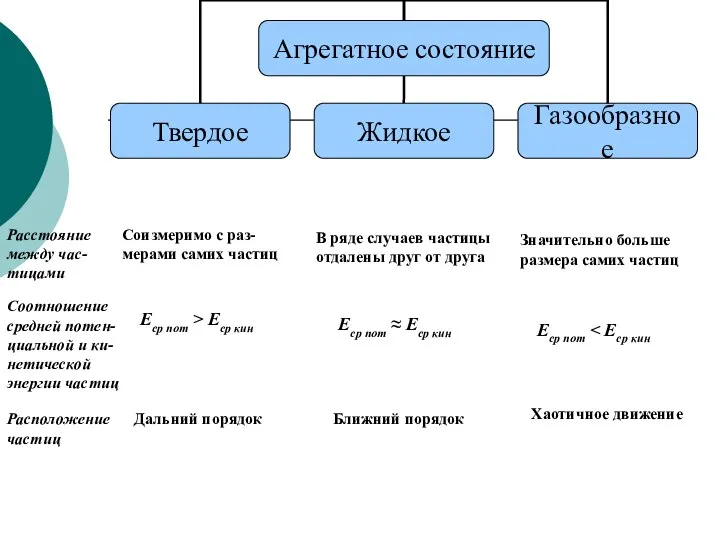
- 2. Расстояние между час- тицами Соизмеримо с раз-мерами самих частиц В ряде случаев частицы отдалены друг от
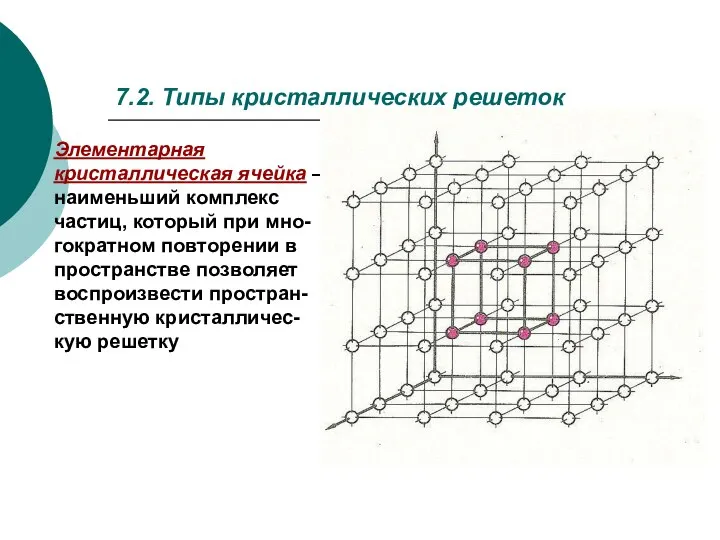
- 3. 7.2. Типы кристаллических решеток Элементарная кристаллическая ячейка – наименьший комплекс частиц, который при мно-гократном повторении в
- 4. По типу частиц, находящихся в узлах кристаллической решетки, их делят на: молекулярные ионные атомные металлические
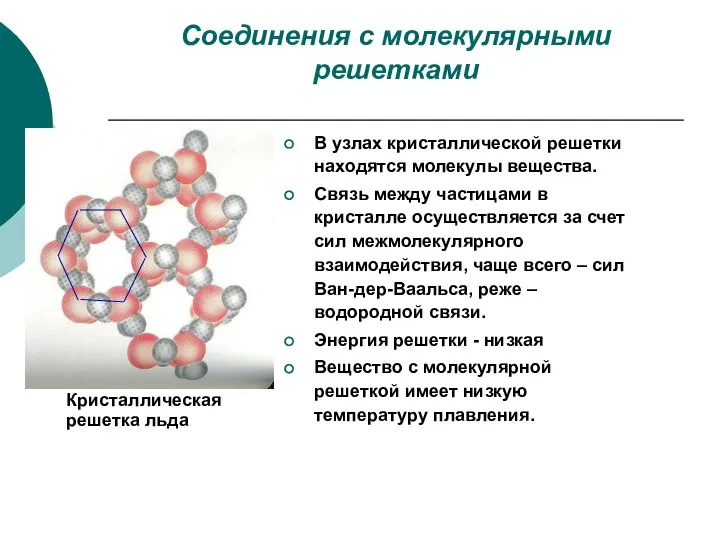
- 5. Соединения с молекулярными решетками В узлах кристаллической решетки находятся молекулы вещества. Связь между частицами в кристалле
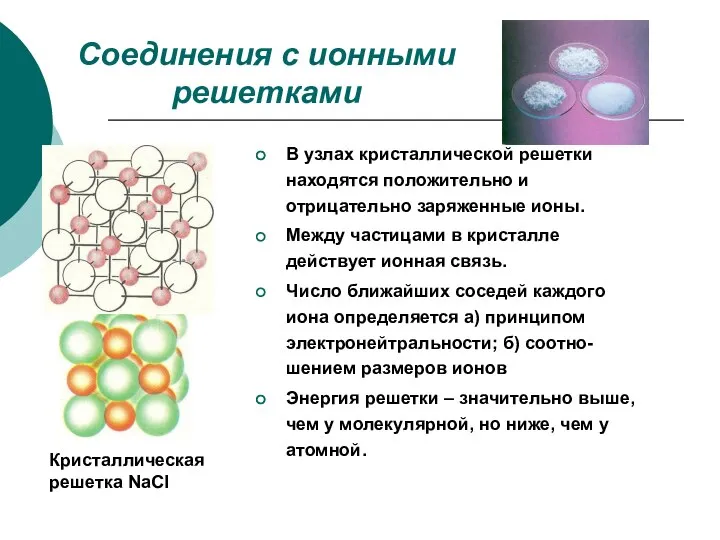
- 6. Соединения с ионными решетками Кристаллическая решетка NaCl В узлах кристаллической решетки находятся положительно и отрицательно заряженные
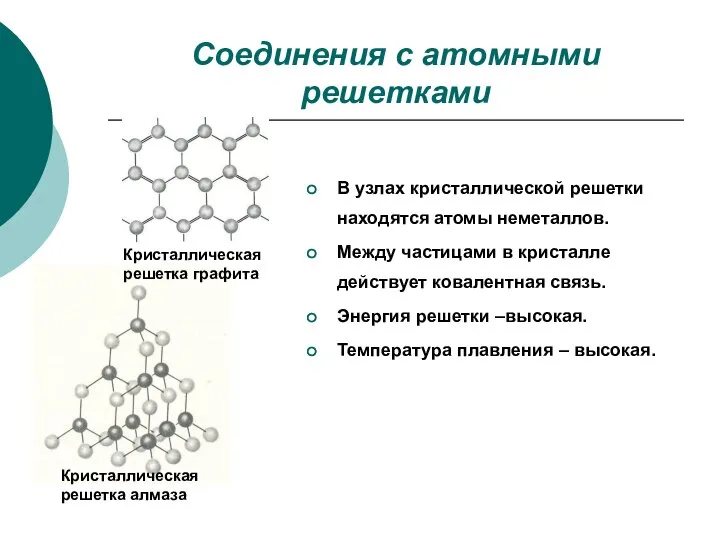
- 7. Соединения с атомными решетками Кристаллическая решетка графита Кристаллическая решетка алмаза В узлах кристаллической решетки находятся атомы
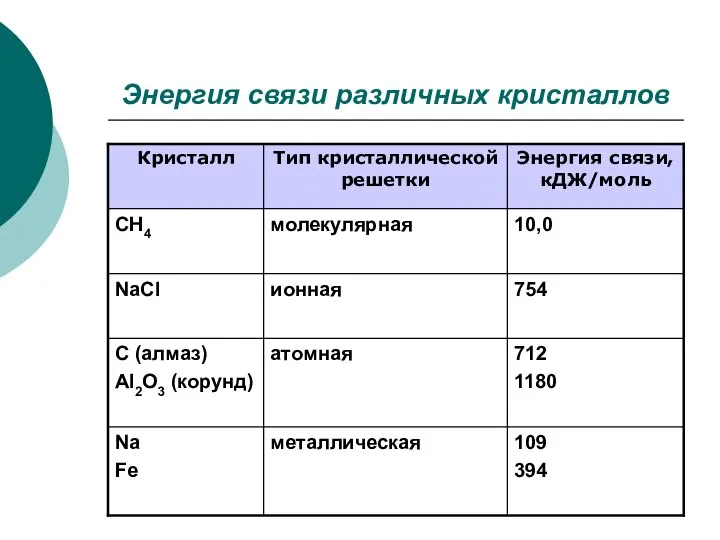
- 8. Энергия связи различных кристаллов
- 9. 7.3. Особенности кристаллов металлов Физические и технологические свой-ства металлов: электропроводность, прочность, пластичность, и ряд других, определяются
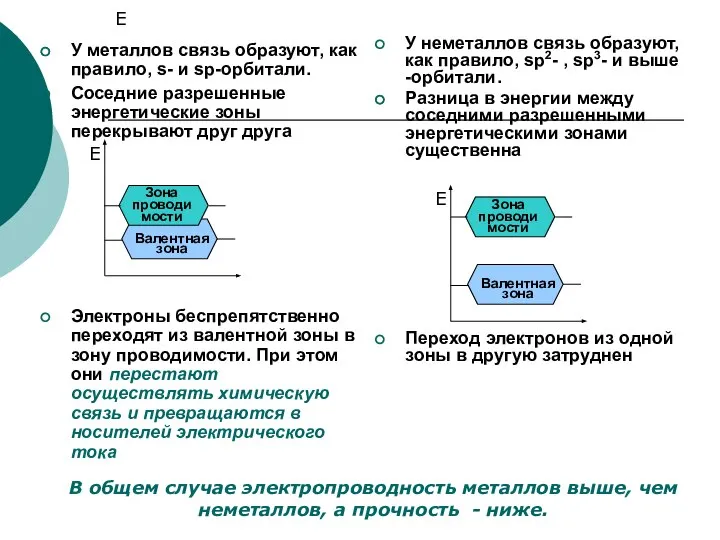
- 10. Химизм явления электропроводности При образовании атомного и металлического кристалла все соседние атомы оказываются связаны между собой
- 11. Е У металлов связь образуют, как правило, s- и sp-орбитали. Соседние разрешенные энергетические зоны перекрывают друг
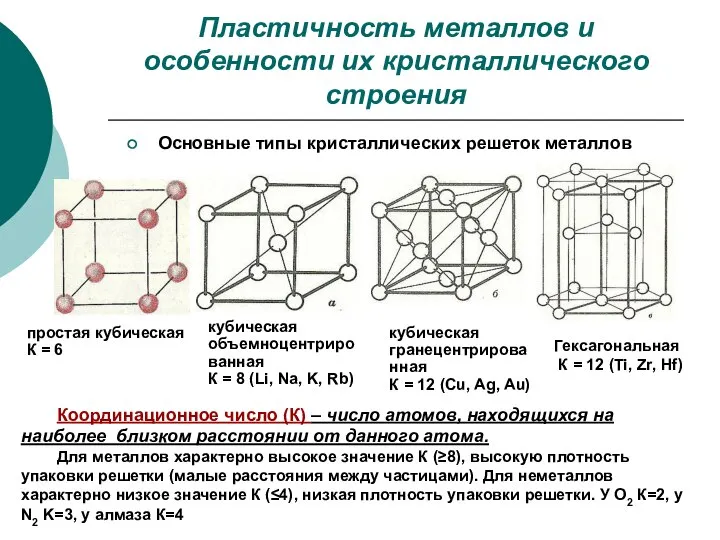
- 12. Пластичность металлов и особенности их кристаллического строения кубическая гранецентрированная К = 12 (Cu, Ag, Au) кубическая
- 14. Скачать презентацию



 Комплексный анализ текста ЕГЭ
Комплексный анализ текста ЕГЭ Хімія і медицина
Хімія і медицина  Аттестационная работа. Разработка по выполнению исследовательской работы. Выращивание кристаллов в домашних условиях
Аттестационная работа. Разработка по выполнению исследовательской работы. Выращивание кристаллов в домашних условиях Презентация по Химии "Кислоты" - скачать смотреть
Презентация по Химии "Кислоты" - скачать смотреть  Душистые вещества животного и растительного происхождения
Душистые вещества животного и растительного происхождения Хром. Использование хрома
Хром. Использование хрома Ямало-Ненецкий автономный округ г.Ноябрьск МБОУ СОШ №9 Выполнила: Учитель химии Нигаматова Айгуль Разифовна
Ямало-Ненецкий автономный округ г.Ноябрьск МБОУ СОШ №9 Выполнила: Учитель химии Нигаматова Айгуль Разифовна Электролиз расплавов и растворов электролитов
Электролиз расплавов и растворов электролитов Полезные ископаемые Луны
Полезные ископаемые Луны Превращения веществ в окружающей среде и живых организмах
Превращения веществ в окружающей среде и живых организмах Полезные продукты на основе 4-хлоризотиазолов
Полезные продукты на основе 4-хлоризотиазолов Характеристика металу Sr
Характеристика металу Sr Бериллий. Строение элемента. Физические и химические свойства. Способы получения. Применение. Интересные факты. Опыты
Бериллий. Строение элемента. Физические и химические свойства. Способы получения. Применение. Интересные факты. Опыты Презентация по Химии "Вплив побутової хімії на здоров'я людини" - скачать смотреть бесплатно
Презентация по Химии "Вплив побутової хімії на здоров'я людини" - скачать смотреть бесплатно Презентация по Химии "Термодинамічні розрахунки Для оцінювання енергетичної цінності харчування" - скачать смотреть бесплат
Презентация по Химии "Термодинамічні розрахунки Для оцінювання енергетичної цінності харчування" - скачать смотреть бесплат Строение атома (8 класс)
Строение атома (8 класс) Получение фосфорной кислоты
Получение фосфорной кислоты Двойной электрический слой на границе раздела твердое тело. Раствор электролита
Двойной электрический слой на границе раздела твердое тело. Раствор электролита Химическое равновесие
Химическое равновесие Почему протекают химические реакции Начала термодинамики Автор: Фельдман Людмила Валентиновна, учитель химии МБОУ СОШ им. А.М.Гор
Почему протекают химические реакции Начала термодинамики Автор: Фельдман Людмила Валентиновна, учитель химии МБОУ СОШ им. А.М.Гор Гидроксид натрия
Гидроксид натрия Химические уравнения
Химические уравнения Химическое сопротивление эластомеров. Резины. Дерево
Химическое сопротивление эластомеров. Резины. Дерево Краски. Виды красок
Краски. Виды красок Классификация органических веществ
Классификация органических веществ Кирпичики наноструктуры. Занятие 8
Кирпичики наноструктуры. Занятие 8 Колоїдний захист
Колоїдний захист Мыс айналымы
Мыс айналымы