Содержание
- 2. ЛЕКЦИЯ 1 ОСНОВНАЯ НОРМАТИВНАЯ ДОКУМЕНТАЦИЯ, ИСПОЛЬЗУЕМАЯ ПРИ АНАЛИЗЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ Федеральный закон № 61 от 12
- 3. ВИДЫ ВНУТРИАПТЕЧНОГО КОНТРОЛЯ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ (согласно приказу 751н) Приемочный Письменный Опросный Органолептический Физический Химический Контроль
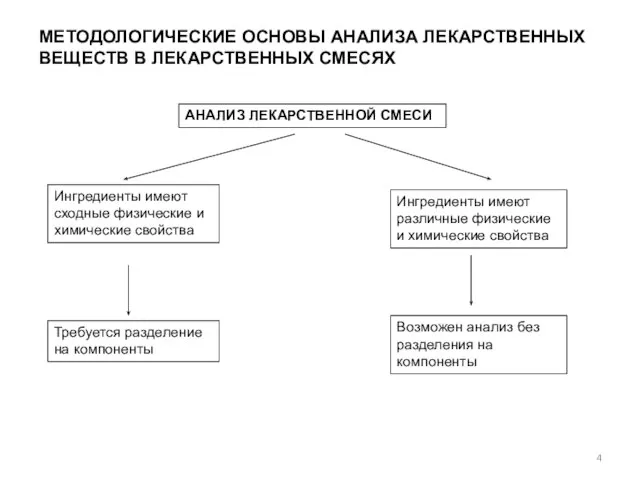
- 4. МЕТОДОЛОГИЧЕСКИЕ ОСНОВЫ АНАЛИЗА ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ В ЛЕКАРСТВЕННЫХ СМЕСЯХ АНАЛИЗ ЛЕКАРСТВЕННОЙ СМЕСИ Ингредиенты имеют сходные физические и
- 5. КЛАССИФИКАЦИЯ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ ПО КИСЛОТНО-ОСНОВНЫМ СВОЙСТВАМ, РАСТВОРИМОСТИ В ВОДЕ И ОРГАНИЧЕСКИХ РАСТВОРИТЕЛЯХ Органические кислоты Соли органических
- 6. АНАЛИЗ ЛЕКАРСТВЕННЫХ СМЕСЕЙ БЕЗ РАЗДЕЛЕНИЯ КОМПОНЕНТОВ Смесь №1 Кислоты хлористоводородной разведенной 4,4 – 100,0 Натрия хлорида
- 7. Количественное определение. Кислота хлористоводородная. Метод нейтрализации: титрант – 0,1 н. раствор натрия гидроксида; индикатор – бромфеноловый
- 8. Натрия хлорид. Оттитрованный после определения кислоты хлористоводородной раствор переносят в мерную колбу вместимостью 50 мл и
- 9. Смесь №2 Натрия бромида Натрия хлорида по 3,0 Воды очищенной – 100,0 Подлинность. Натрий-ион – по
- 10. 2) К 2 каплям раствора прибавляют по 10 капель воды и серной кислоты разведенной, 1 мл
- 11. Количественное определение. Натрия хлорид. К 1 мл микстуры прибавляют 3 – 5 мл воды, по 3
- 12. К обесцвеченному раствору добавляют 10 мл 0,1н. раствора серебра нитрата, 15-20 капель раствора железоаммониевых квасцов и
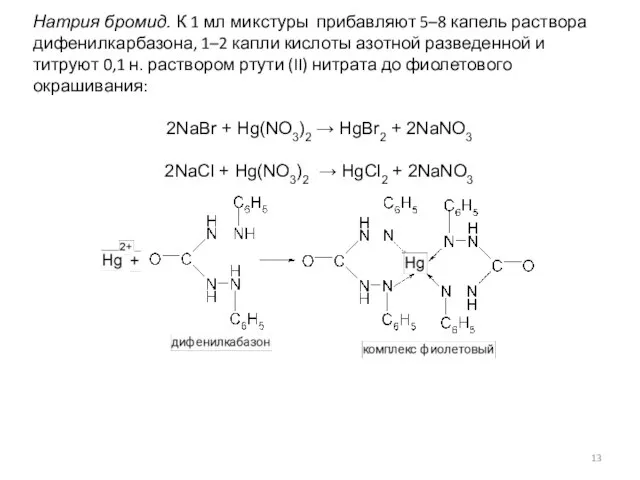
- 13. Натрия бромид. К 1 мл микстуры прибавляют 5–8 капель раствора дифенилкарбазона, 1–2 капли кислоты азотной разведенной
- 14. Содержание натрия бромида в граммах (Х) рассчитывают по формуле: Где Х – содержание натрия бромида в
- 15. Смесь № 3 Натрия хлорида 25,0 Натрия тиосульфата 0,5 Кальция хлорида 1,5 Воды для инъекций 500,0
- 16. Подлинность. Натрий. Капля раствора окрашивает пламя горелки в желтый цвет. Кальций. К 1 мл раствора добавляют
- 17. Количественное определение. Натрия тиосульфат. Метод йодометрии. Титруют 2 мл раствора 0,01 н. раствором йода до появления
- 18. Кальция хлорид. Метод определения – комплексонометрия. К 2 мл раствора добавляют 5 мл аммиачного буферного раствора,
- 20. Скачать презентацию















 Термодинамика химического равновесия. Уравнения изотермы, изобары, изохоры Вант-Гоффа
Термодинамика химического равновесия. Уравнения изотермы, изобары, изохоры Вант-Гоффа Ферроцен. Свойства, получение и применение
Ферроцен. Свойства, получение и применение Правила поведения зимой на воде
Правила поведения зимой на воде  Методическая разработка урока МНОГОАТОМНЫЕ СПИРТЫ
Методическая разработка урока МНОГОАТОМНЫЕ СПИРТЫ Кинетика ферментативного катализа. (Лекция 5)
Кинетика ферментативного катализа. (Лекция 5) Камень, скользящий на льду
Камень, скользящий на льду Химия
Химия Олигомеризация олефинов
Олигомеризация олефинов Презентация по Химии "Строение периодической таблицы Д.И. Менделеева" - скачать смотреть
Презентация по Химии "Строение периодической таблицы Д.И. Менделеева" - скачать смотреть  История возникновения химии
История возникновения химии Пластмассы. Классификация
Пластмассы. Классификация Примеры методов разделения белков (фракционирования)
Примеры методов разделения белков (фракционирования) Разделение и концентрирование методом осаждения и соосаждения. Различие осаждения и соосаждения. (Лекция 6)
Разделение и концентрирование методом осаждения и соосаждения. Различие осаждения и соосаждения. (Лекция 6) Учебно-познавательный проект на тему: «Физико-химические процессы, происходящие при выпечке и хранении хлеба и хлебобулочных изде
Учебно-познавательный проект на тему: «Физико-химические процессы, происходящие при выпечке и хранении хлеба и хлебобулочных изде Углеводы
Углеводы  Каталитический риформинг
Каталитический риформинг Природний газ
Природний газ Химиялық қару
Химиялық қару Ферменты. Часть I
Ферменты. Часть I Соединения азота. Оксиды азота
Соединения азота. Оксиды азота Органическая химия. Алифатические углеводороды
Органическая химия. Алифатические углеводороды Нуклеиновые кислоты Выполнил : Росовский Алексей
Нуклеиновые кислоты Выполнил : Росовский Алексей Технология пластических масс на основе поликонденсационных смол
Технология пластических масс на основе поликонденсационных смол Синтез и исследование метилольных и хлорметильных производных аллантоина
Синтез и исследование метилольных и хлорметильных производных аллантоина Нанохимия, как наука
Нанохимия, как наука Устойчивость и коагуляция золей
Устойчивость и коагуляция золей Производство серной кислоты
Производство серной кислоты Основания. Простые и сложные ионы
Основания. Простые и сложные ионы