Содержание
- 2. Солями называются вещества, в которых атомы металла связаны с кислотными остатками. Общая формула класса: MenAm
- 3. Исключением являются соли аммония, в которых с кислотными остатками связаны не атомы металла, а частицы NH4+.
- 4. Формула соли строится с учетом валентностей металла и кислотного остатка. Практически все соли – ионные соединения,
- 5. Названия солей составляются из названия кислотного остатка и названия металла. Главным в названии является кислотный остаток.
- 6. Из таблицы видно, что названия кислородсодержащих солей имеют окончания "ат", а названия бескислородных солей – окончания
- 7. Классификация солей В зависимости от состава соли бывают: 1. Средние – продукт полного замещения водорода в
- 8. Классификация солей 3. Основные – продукт неполного замещения групп OH- основания на кислотный остаток. Mg(OH)2 +
- 9. Классификация солей 5. Смешанные – состоящие из общего металла и различных кислотных остатков. CuOHNO3 + CH3COOH
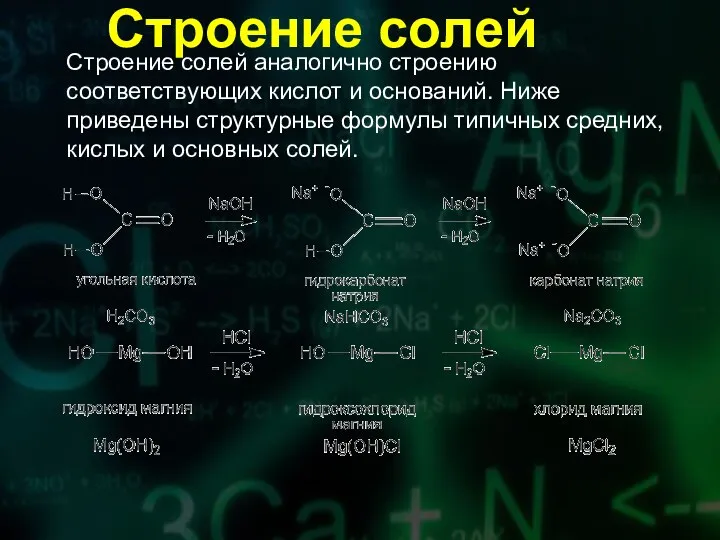
- 10. Строение солей аналогично строению соответствующих кислот и оснований. Ниже приведены структурные формулы типичных средних, кислых и
- 11. Получение солей Соли получают при химическом взаимодействии соединений различных классов и простых веществ. Отметим важнейшие способы
- 12. Получение солей 1. Реакция нейтрализации: Ca(OH)2 + H2CO3 = = CaCO3 + 2H2O карбонат кальция
- 13. Получение солей 2. Взаимодействие металлов с неметаллами: 2Al + 3S = Al2S3 сульфид алюминия
- 14. Получение солей 3. Взаимодействие металлов с кислотами: Zn + 2HCl = ZnCl2 + H2 хлорид цинка
- 15. Получение солей 4. Взаимодействие основных оксидов с кислотными оксидами. CaO + SiO2 = CaSiO3 силикат кальция
- 16. Физические свойства солей Соли, за небольшим исключением, являются твёрдыми кристал-лическими веществами различного цвета. По растворимости в
- 17. Химические свойства солей Соли взаимодействуют: C простыми веществами – металлами и неметаллами. со сложными – кислотами,
- 18. Химические свойства солей 1. С металлами: CuSO4 + Fe = FeSO4 + Cu сульфат меди (II)
- 19. Химические свойства солей 3. С кислотами: 2NaCl + H2SO4 = хлорид натрия = Na2SO4 + 2HCl
- 20. Химические свойства солей 4. С щелочами: FeCl2 + 2NaOH = хлорид железа (II) =Fe(OH)2 + 2NaCl
- 21. Химические свойства солей 5. С солями: AgNO3 + KCl = нитрат серебра =AgCl + KNO3 хлорид
- 23. Скачать презентацию



















 Эукариоты
Эукариоты Aromatik uglevodorodlar (Arenlar)
Aromatik uglevodorodlar (Arenlar) Виды химической связи. Кристаллические решетки
Виды химической связи. Кристаллические решетки Юные химики
Юные химики Презентация по Химии "Углеводы" - скачать смотреть
Презентация по Химии "Углеводы" - скачать смотреть  Генетика. Лекция 5 Генотип. Геном. Кариотип. Геномные мутации. Генный баланс. Компенсация доз генов. Эволюция генома.
Генетика. Лекция 5 Генотип. Геном. Кариотип. Геномные мутации. Генный баланс. Компенсация доз генов. Эволюция генома.  Оксигенвмісні органічні сполуки. Лекція 12
Оксигенвмісні органічні сполуки. Лекція 12 Оксиды азота
Оксиды азота Презентация по Химии "Самодельная грелка" - скачать смотреть
Презентация по Химии "Самодельная грелка" - скачать смотреть  Углеводы. Структура
Углеводы. Структура Оксиды. Классы неорганических соединений
Оксиды. Классы неорганических соединений Автомобильные эксплуатационные материалы и экономия топливноэнергетических ресурсов 3. Автомобильные бензины
Автомобильные эксплуатационные материалы и экономия топливноэнергетических ресурсов 3. Автомобильные бензины Homecredit Bank. Показатели и зоны роста
Homecredit Bank. Показатели и зоны роста Ғажайып химия
Ғажайып химия Ферум. Залізо. Будова атома, фізичні і хімічні властивості
Ферум. Залізо. Будова атома, фізичні і хімічні властивості Синтетичні каучуки
Синтетичні каучуки  Регуляция водно-солевого и минерального обмена
Регуляция водно-солевого и минерального обмена Составление уравнений окислительно-восстановительных реакций
Составление уравнений окислительно-восстановительных реакций Дюралюминий. Дюраль
Дюралюминий. Дюраль Катализ. Лекция 1
Катализ. Лекция 1 Электропроводность растворов и электрохимия
Электропроводность растворов и электрохимия Водородная и донорно-акцепторная связи. (Лекция 15)
Водородная и донорно-акцепторная связи. (Лекция 15) Химические опыты в домашних условиях
Химические опыты в домашних условиях Катализ металлами. Лекция 3
Катализ металлами. Лекция 3 Дмитрий Иванович Менделеев
Дмитрий Иванович Менделеев Аммиак. Строение молекулы. Водородная связь
Аммиак. Строение молекулы. Водородная связь Терминология и основные понятия в химии высокомолекулярных соеденений
Терминология и основные понятия в химии высокомолекулярных соеденений Иондар және олардың түзілуі
Иондар және олардың түзілуі