Содержание
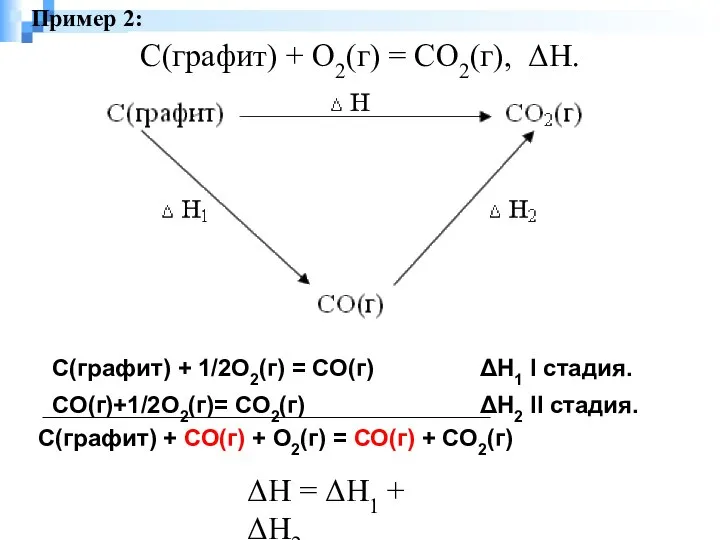
- 2. С(графит) + О2(г) = СО2(г), ΔН. ΔН = ΔН1 + ΔН2 Пример 2:
- 3. Пример 3: Рассчитайте тепловой эффект реакции горения аммиака: 4NН3 (г) + 3О2 (г) = 2N2 (г)
- 4. Пример 4:
- 5. Пример 5:
- 6. Пример 6: Гомогенные реакции: 2SO2(г) + O2(г) = 2SO3(г) υ = k ·c(SO2)2·c(O2) Гетерогенные реакции: С(тв)
- 7. Пример 7. Как изменится скорость реакции, протекающей в газовой фазе, если температуру уменьшить от 60°С до
- 8. Смещение химического равновесия Принцип Ле-Шателье При изменении внешних условий химическое равновесие смещается в сторону той реакции
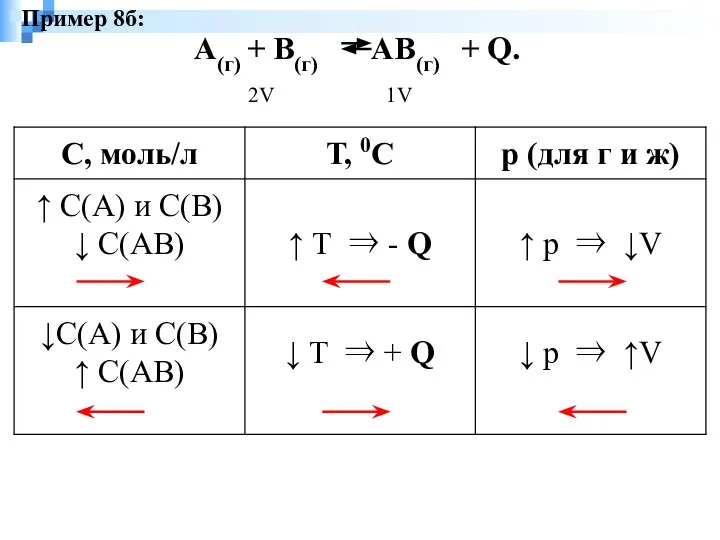
- 9. А(г) + В(г) АВ(г) + Q. 2V 1V Пример 8б:
- 11. Скачать презентацию






 Презентация по Химии "Оксиды: получение, свойства, применение" - скачать смотреть
Презентация по Химии "Оксиды: получение, свойства, применение" - скачать смотреть  Презентация по Химии "Детонаційна стійкість бензину" - скачать смотреть бесплатно
Презентация по Химии "Детонаційна стійкість бензину" - скачать смотреть бесплатно Общая и неорганическая химия. Введение
Общая и неорганическая химия. Введение Где прячутся взрывчатые вещества Работа Баранова Александра Учащегося 8«а»класса МОУ СОШ №4 Г. Маркса
Где прячутся взрывчатые вещества Работа Баранова Александра Учащегося 8«а»класса МОУ СОШ №4 Г. Маркса Green chemistry application to intermolecular forces
Green chemistry application to intermolecular forces Презентация АТОМНАЯ ЭНЕРГЕТИКА
Презентация АТОМНАЯ ЭНЕРГЕТИКА “TERRA” программасы бойынша ферросиликоалюминийдің балқуының фазалық күйіндегі термодинамикалық есептеуі
“TERRA” программасы бойынша ферросиликоалюминийдің балқуының фазалық күйіндегі термодинамикалық есептеуі Анализ пригодности природной воды в качестве питьевой по формуле М.Г. Курлова
Анализ пригодности природной воды в качестве питьевой по формуле М.Г. Курлова Происхождение химичесих элементов
Происхождение химичесих элементов Формы природных выделений минералов. Занятие 2
Формы природных выделений минералов. Занятие 2 Федотова Елена Анатольевна – учитель химии МБОУ Изыхская СОШ
Федотова Елена Анатольевна – учитель химии МБОУ Изыхская СОШ  Растворы. рН среды. Вспомогательные вещества. Химические вещества и материалы в индустрии красоты. Лекция 7
Растворы. рН среды. Вспомогательные вещества. Химические вещества и материалы в индустрии красоты. Лекция 7 Специальный выпуск «Слово эксперту». Антиоксидантная защита от Орифлэйм
Специальный выпуск «Слово эксперту». Антиоксидантная защита от Орифлэйм «Теллур»
«Теллур» Деловая игра «Деятельность учителя и деятельность ученика». обучающий семинар «Системно – деятельностный
Деловая игра «Деятельность учителя и деятельность ученика». обучающий семинар «Системно – деятельностный  Карбонаты и гидрокарбонаты К уроку химии в 9 классе «Кислородсодержащие соединения углерода» Учитель химии Слизкая В.Ф.
Карбонаты и гидрокарбонаты К уроку химии в 9 классе «Кислородсодержащие соединения углерода» Учитель химии Слизкая В.Ф. Химия элементов семейства Fe Co Ni
Химия элементов семейства Fe Co Ni Синтетический каучук и его применение
Синтетический каучук и его применение ГИА. Вопрос 10. Химические свойства оксидов: основных, амфотерных, кислотных
ГИА. Вопрос 10. Химические свойства оксидов: основных, амфотерных, кислотных 6-я группа элементов. 9 класс
6-я группа элементов. 9 класс Устойчивость дисперсных систем
Устойчивость дисперсных систем Rectification. Difference between the rectification and distillation
Rectification. Difference between the rectification and distillation Становление органической химии как отдельной науки. (Модуль 1)
Становление органической химии как отдельной науки. (Модуль 1) Чистые вещества и смеси
Чистые вещества и смеси Группа ультраосновных пород
Группа ультраосновных пород Химические реакции. Тепловой эффект
Химические реакции. Тепловой эффект Синтетикалық полимерлер (пластиктер)
Синтетикалық полимерлер (пластиктер) Состав, строение, классификация кислот
Состав, строение, классификация кислот