Содержание
- 2. ЦЕЛЬ УРОКА: Обеспечить развитие представлений учащихся о законе сохранения энергии. Организовать деятельность учащихся по применению знаний
- 3. Количество теплоты, которое выделяется или поглощается при химической реакции, называют тепловым эффектом реакции. Тепловой эффект обозначается
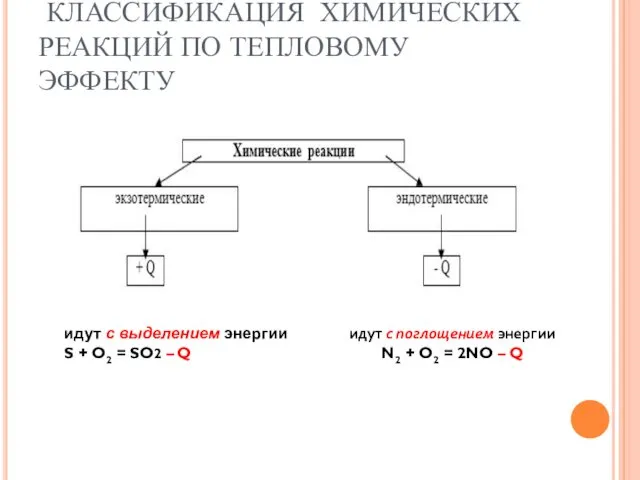
- 4. КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ ПО ТЕПЛОВОМУ ЭФФЕКТУ идут с выделением энергии S + O2 = SO2 –
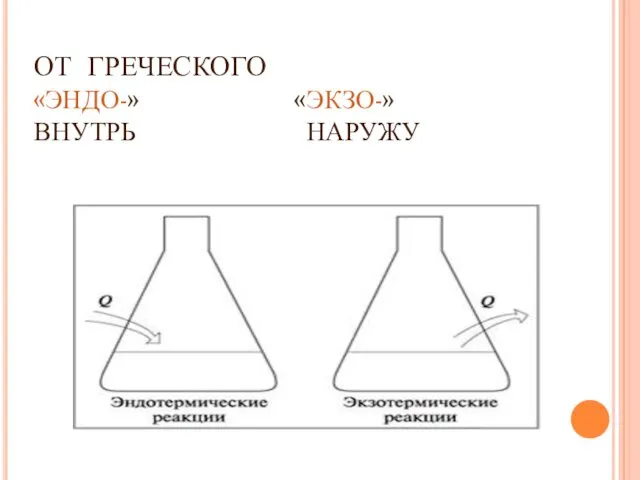
- 5. ОТ ГРЕЧЕСКОГО «ЭНДО-» «ЭКЗО-» ВНУТРЬ НАРУЖУ
- 6. Химические уравнения, в которых указывается тепловой эффект, называют термохимическими. Например: 2HgO —> 2Hg + O2 –
- 7. ГЕРМАН ИВАНОВИЧ ГЕСС -Российский академик -Основоположник термохимии Термохимия — раздел химии, в задачу которого входит определение
- 8. АЛГОРИТМ РЕШЕНИЯ ЗАДАЧ ПО ТЕРМОХИМИЧЕСКОМУ УРАВНЕНИЮ Кратко записать условия задачи (“дано”). Записать термохимическое уравнение реакции (ТХУ),
- 9. ЗАПОЛНИ ПРОПУСКИ 1. Реакции, протекающие с выделением теплоты и света называются реакциями ….. а) разложения; б)
- 10. 2. Какие схемы можно назвать термохимическими уравнениями реакций? а) 2 H2(г) + O2(г) = 2 H2О(ж)
- 11. 3. Какая запись, соответствует эндотермической реакции? а) С(тв) + O2(г) = СO2(г) + 394 кДж б)
- 12. 4. Приведены уравнения реакций: 1. С+О2 = СО2 + 402,24кДж 2. 2HgO = 2Hg + О2
- 13. ДОМАШНЕЕ ЗАДАНИЕ Что происходит с энергией при разрыве химических связей? Что происходит с энергией при образовании
- 15. Скачать презентацию










 Химия элементов VIA группы. SO2
Химия элементов VIA группы. SO2 Элемент астат
Элемент астат Общая характеристика реакций органических соединений. Кислотные и основные свойства органических соединений
Общая характеристика реакций органических соединений. Кислотные и основные свойства органических соединений Нечаев 18
Нечаев 18 Алкадиены. Состав и строение
Алкадиены. Состав и строение Ди- және полисахаридтер
Ди- және полисахаридтер Что у нас на столе? Сороколетова Ольга Аракчеева Елена
Что у нас на столе? Сороколетова Ольга Аракчеева Елена Organic compounds: nomenclature
Organic compounds: nomenclature АНАЛИТИЧЕСКАЯ БИОХИМИЯ Цели курса: 1.Развитие интереса к выбранному профилю. 2. Показать наглядно эксперименты и опыты
АНАЛИТИЧЕСКАЯ БИОХИМИЯ Цели курса: 1.Развитие интереса к выбранному профилю. 2. Показать наглядно эксперименты и опыты Органика из аптеки
Органика из аптеки Екобригада ДЗВІН ЗЕМЛІ Чортківська ЗОШ І-ІІІ ст №5
Екобригада ДЗВІН ЗЕМЛІ Чортківська ЗОШ І-ІІІ ст №5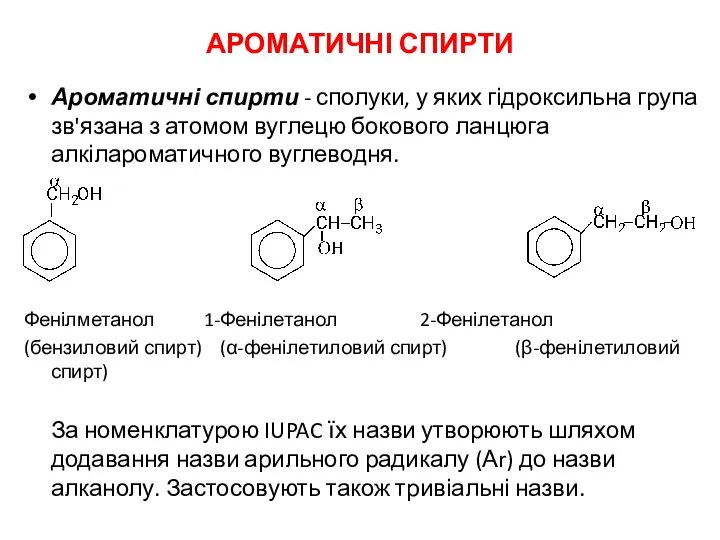 Ароматичні спирти
Ароматичні спирти Вода. Твердість води
Вода. Твердість води  Обмен белков - 1
Обмен белков - 1 Автомобильные бензины и дизельные топлива. Характеристика и классификация автомобильных топлив
Автомобильные бензины и дизельные топлива. Характеристика и классификация автомобильных топлив Металлы. Атомы металлов
Металлы. Атомы металлов Каучук Презентація учня 11-Б класу гімназії №117 ім. Лесі Українки м. Києва Мусієнка Андрія
Каучук Презентація учня 11-Б класу гімназії №117 ім. Лесі Українки м. Києва Мусієнка Андрія  Галогены
Галогены Логическая структура модуля по дисциплине "Аналитическая химия"
Логическая структура модуля по дисциплине "Аналитическая химия" Валентность химических элементов (8 класс)
Валентность химических элементов (8 класс) Биохимия как наука
Биохимия как наука Тема: Мониторинг воды и осадков в разное время года. Творческое название проекта: «Пить или не пить - вот в чем вопрос» Авторы:Коньк
Тема: Мониторинг воды и осадков в разное время года. Творческое название проекта: «Пить или не пить - вот в чем вопрос» Авторы:Коньк Використання вуглеводнів
Використання вуглеводнів  Общая и неорганическая химия. Введение
Общая и неорганическая химия. Введение Природный и синтетический каучуки
Природный и синтетический каучуки Исследовательская деятельность в преподавании химии
Исследовательская деятельность в преподавании химии Предмет органической Химии. Классификация Органических соединений
Предмет органической Химии. Классификация Органических соединений Презентация по Химии "Особенности строения атома карбона в основном и возбужденном состояниях. Образование ковалентных связей
Презентация по Химии "Особенности строения атома карбона в основном и возбужденном состояниях. Образование ковалентных связей