Содержание
- 2. ЖОСПАР КІРІСПЕ НЕГІЗГІ БӨЛІМ ҰЮ ШЕКАРАСЫ ШУЛЬЦЕ – ГАРДИ ЕРЕЖЕСІ КОАГУЛЯЦИЯ КИНЕТИКАСЫ ҚОРЫТЫНДЫ ПАЙДАЛЫНЫЛҒАН ӘДЕБИЕТТЕР
- 3. КІРІСПЕ Коагуляция (ұю) – коллоидты бөлшектердің бірігу үдерісі, нәтижеде ірі агрегаттар түзіліп, агрегатты тұрақтылық жоғалады. Коагуляция
- 4. Коллоидты ерітінділерге электролитті қосу қарама – қарсы иондардың барлық қабатындағы, оның ішінде, адсорбциялық қабаттағы мөлшерінің өсуіне,
- 5. Заряд таңбасы Гарди, 1900 жылы ережесі: Ұю процесін зольдегі коллоидтық бөлшектің зарядына таңбасы карама – қарсы
- 6. Валенттілік ережесі Электролиттің коагуляциялық әсері Шульце ережесімен беріледі: ұйытқыш ионының заряды артқан сайын оның коагуляциялау қабілеті
- 7. As2S3 және Fe(OH)3 зольдерін электролиттер мен ұйыту
- 9. ШУЛЬЦЕ – ГАРДИ ЕРЕЖЕСІ
- 10. Cонымен,Шульце – Гарди ережесі бейорганикалық иондардың әсерін сипаттайды; ал органикалық иондардың ұйыту қабілеті олардың адсорбциялық қабілетіне
- 11. КОАГУЛЯЦИЯНЫҢ ЖҮРУІ ҮШІН БІР УАҚЫТ ҚАЖЕТ, ДЕМЕК ҰЮ ҮДЕРІСІ БЕЛГІЛІ БІР ЖЫЛДАМДЫҚПЕН СИПАТТАЛАДЫ. ҰЮ ЖЫЛДАМДЫҒЫ, ХИМИЯЛЫҚ
- 12. Суретте ұю жылдамдығының концентрациясына байланысты тәуелдлігі көрсетілген. Электролит концентрациясының ұю жылдамдығына әсері
- 14. Тез коагуляция теориясын М. Смолуховский (1916жылы) жасады. Ол тез коагуляция аймағында бөлшектердің кез – келген соқтығысуы
- 15. Смолуховский ұюды қайтымсыз химиялық реакциялар деп есептеп, оған формальды химиялық кинетиканың теңдеулерін келесі шарттарды ескере отырып,
- 16. БАЯУ КОАГУЛЯЦИЯ
- 17. ӨЗАРА ҰЮ
- 18. Өзара ұю толық жүру үшін қарама – қарсы зарядталған коллоидты бөлшектердің сандары өзара тең болуы қажет.
- 19. ҚОРЫТЫНДЫ Сонымен қорыта келе, коагуляция деп – коллоидт бөлшектердің бірігу үдерісі, нәтижеде ірі агрегаттар түзіліп, агрегатты
- 20. Пайдаланылған әдебиеттер: 1.ПАТСАЕВ Ә.Қ., ШИТЫБАЕВ С.А., ТӨРЕБЕКОВА Г.А. «ФИЗИКАЛЫҚ ЖӘНЕ КОЛЛОИДТЫҚ ХИМИЯ» ШЫМКЕНТ 2010 2.С.Ж. ЖАЙЛАУ,Қ.С.ҚҰЛАЖАНОВ.
- 22. Скачать презентацию



















 Великие ученые-химики
Великие ученые-химики Предалхимический период
Предалхимический период Карбоновые кислоты и их производные. Взаимопревращения. (Лекция 13)
Карбоновые кислоты и их производные. Взаимопревращения. (Лекция 13) Анализ физико-химических свойств синтетических моющих средств (СМС) и их значение в жизни человека
Анализ физико-химических свойств синтетических моющих средств (СМС) и их значение в жизни человека Электролиз. Электролиз хлорида натрия
Электролиз. Электролиз хлорида натрия Строение атома. Классификация ядер атомов
Строение атома. Классификация ядер атомов Презентация "Гидролиз солей"
Презентация "Гидролиз солей" Сучасні каталізатори у процесах нафтопереробки та нафтохімії
Сучасні каталізатори у процесах нафтопереробки та нафтохімії В таблиці я ― відомий елемент, Та літеру зміни з одного боку, Переконаєшся в один момент, Що я не елемент вже, а протока. Метаграми
В таблиці я ― відомий елемент, Та літеру зміни з одного боку, Переконаєшся в один момент, Що я не елемент вже, а протока. Метаграми  Презентация Дисперсные системы
Презентация Дисперсные системы  Химия на службе искусства (на примере древнерусской живописи) Выполнила Брагина Юлия
Химия на службе искусства (на примере древнерусской живописи) Выполнила Брагина Юлия  Строение атома
Строение атома Презентация по Химии "Классификация химических реакций" - скачать смотреть
Презентация по Химии "Классификация химических реакций" - скачать смотреть  Зелёная химия
Зелёная химия Альдегидная функциональная группа
Альдегидная функциональная группа Подготовка к ЕГЭ: КИСЛОРОДСОДЕРЖАЩИЕ. УГЛЕВОДЫ. Муниципальное бюджетное общеобразовательное учреждение «Средняя общеобразоват
Подготовка к ЕГЭ: КИСЛОРОДСОДЕРЖАЩИЕ. УГЛЕВОДЫ. Муниципальное бюджетное общеобразовательное учреждение «Средняя общеобразоват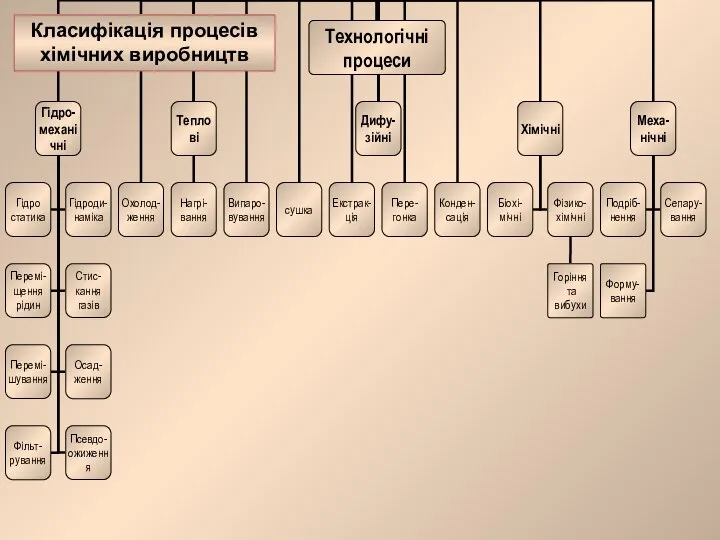 Класифікація процесів хімічних виробництв
Класифікація процесів хімічних виробництв Презентация по Химии "Охорона навколишнього середовища під час виробництва і використання металів" - скачать смотреть беспла
Презентация по Химии "Охорона навколишнього середовища під час виробництва і використання металів" - скачать смотреть беспла Домашняя аптечка исследовательская работа Авторы: Полынникова Анастасия, Савина Мария учащиеся 9 «Б» класса Руководитель: Ма
Домашняя аптечка исследовательская работа Авторы: Полынникова Анастасия, Савина Мария учащиеся 9 «Б» класса Руководитель: Ма L-2-Chemical bonds
L-2-Chemical bonds Топливо. Механические топки
Топливо. Механические топки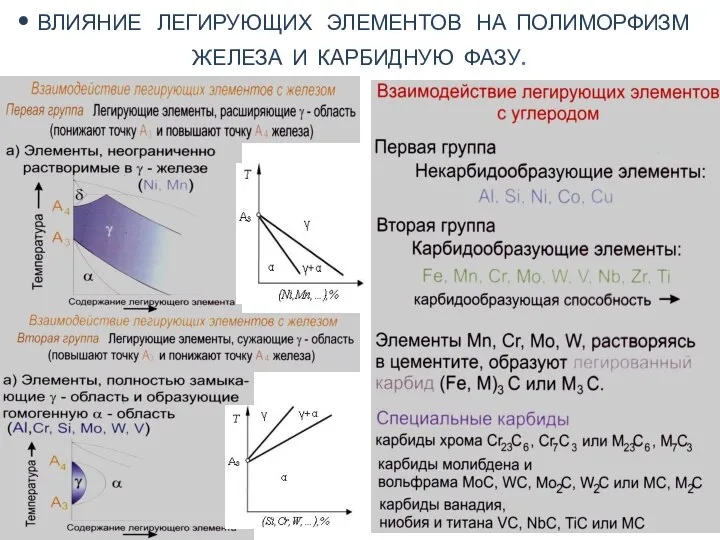 Влияние легирующих элементов на полиморфизм железа и карбидную фазу
Влияние легирующих элементов на полиморфизм железа и карбидную фазу Cross-section sample preparation using focused ion beam system (FIB) for transmission electron microscopy (TEM)
Cross-section sample preparation using focused ion beam system (FIB) for transmission electron microscopy (TEM) Полезные свойства камней
Полезные свойства камней Гидролиз солей
Гидролиз солей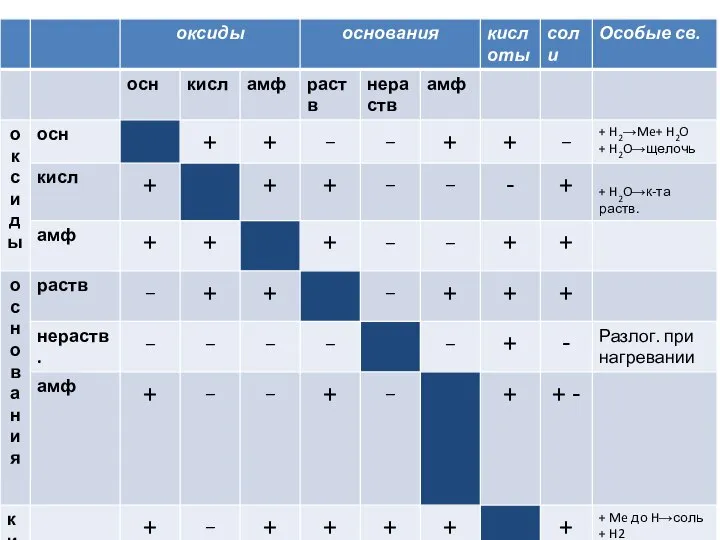 Оксиды, основания, кислоты
Оксиды, основания, кислоты Углеводы
Углеводы Форми періодичної системи хімічних елементів
Форми періодичної системи хімічних елементів