Содержание
- 2. Комплексные соединения (координационные соединения) – сложные химические вещества, в составе которых имеются комплексные ионы, образованные центральным
- 3. Двойная соль или комплексное соединение? KCr(SO4)2∙ 12H2O – хромокалиевые квасцы KCr(SO4)2∙ 12H2O = = K+ +
- 4. Теорию комплексных соединений –(координационную теорию), разработал в 1893 г. швейцарский химик Альфред Вернер, который в 1913
- 5. Положения координационной теории Вернера в центре комплексного соединения находится центральный ион – комплексообразователь. Ионами –коплексообразователями являются
- 6. Вокруг центрального атома (иона-комплексообразователя) находятся противоположно заряженные ионы или нейтральные молекулы, которые называются лигандами (от латинского
- 7. Природа химической связи в комплексных соединениях Во внутренней сфере между комплексообразователем и лигандами существуют ковалентные связи,
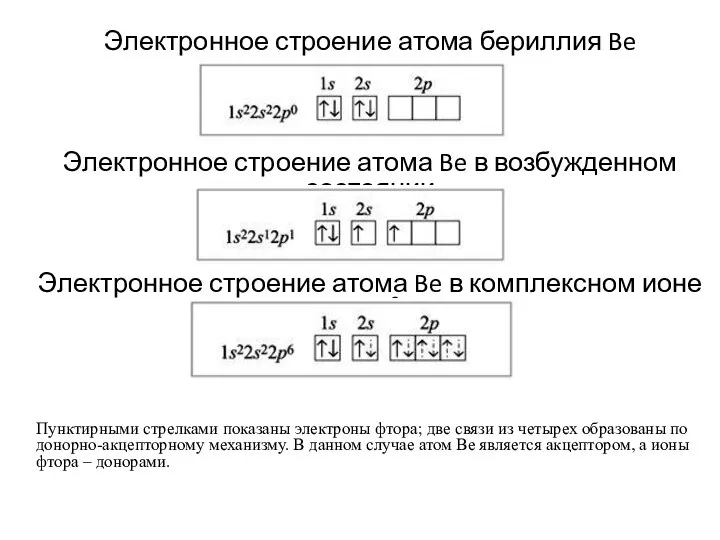
- 8. Электронное строение атома бериллия Be Электронное строение атома Be в возбужденном состоянии Электронное строение атома Be
- 9. Механизм образования комплексного иона [Al(OH)4]-
- 10. Донорно-акцепторный механизм: лиганд предоставляет электронную пару (основание Льюиса), а центральный атом вакантную орбиталь (кислота Льюиса). Координационные
- 11. Строение комплексного соединения K3 [Fe(CN)6] Ион- Комплексо- образователь Лиганды Координационное число Внутренняя сфера Внешняя сфера [Cu(NH3)4]Cl2
- 13. Заряд комплексного иона равен алгебраической сумме зарядов иона-комплексообразователя и лигандов. 2+ 0 2+ 2- [Cu(NH3)4] SO4
- 14. ЦЕНТРАЛЬНЫЙ АТОМ (ц. а.) (ион-комплексообразователь) Чаще всего центральными атомами являются ионы металлов d-элементов: Cu, Ag, Pt,
- 15. Координационное число (к. ч.) Координационное число (к. ч.) не является неизменной величиной. Даже для одних и
- 16. Заряд центрального иона является основным фактором, влияющим на координационное число
- 17. чаще всего кч устойчивого комплекса в два раза больше степени окисления ц.а. КЧ = 2Z Эмпирическое
- 18. Na[BF4] Na3[AlF6] rB3+ = 0,02 нм rAl3+ = 0,057 нм
- 19. Na3[AlF6] Na [AlCl4] Al3+ rF_ = 0,133 нм rCl- = 0,181 нм
- 20. ЛИГАНДЫ Лигандами могут быть: нейтральные молекулы H2O, NH3, CO, карбамида (NH2)2CO, этилендиамина NH2CH2CH2NH2, α-аминоуксусной кислоты NH2CH2COOH,
- 21. Дентатность лиганда определяется числом координационных мест, занимаемых лигандом в координационной сфере комплексообразователя. Различают монодентатные лиганды, занимающие
- 22. К числу монодентатных лигандов относятся все галогенид-ионы, цианид-ион, аммиак, вода и другие.
- 23. -монодентатные лиганды, содержат 1 донорный атом (H2 O, NH3, OH-, Cl-, Br-) Лат. dentalus – имеющий
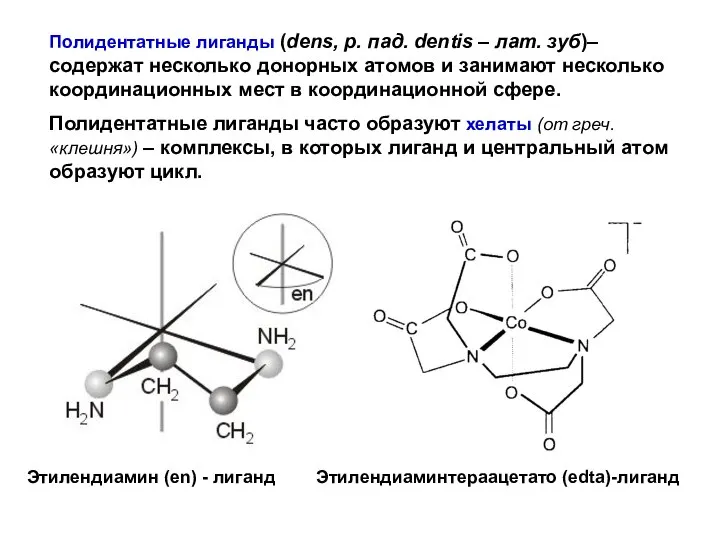
- 24. Полидентатные лиганды (dens, р. пад. dentis – лат. зуб)– содержат несколько донорных атомов и занимают несколько
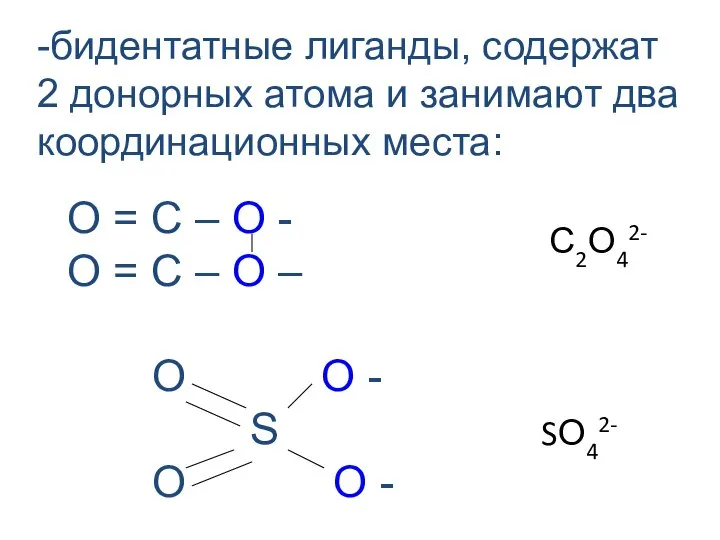
- 25. -бидентатные лиганды, содержат 2 донорных атома и занимают два координационных места: О = С – О
- 26. Существует целый ряд лигандов, которые в комплексах являются практически всегда бидентатными. Это этилендиамин, карбонат-ион, оксалат-ион и
- 27. ЛИГАНДЫ Амбидентатные лиганды – содержат несколько различных донорных атомов Роданид анион SCN-: если донорный атом S
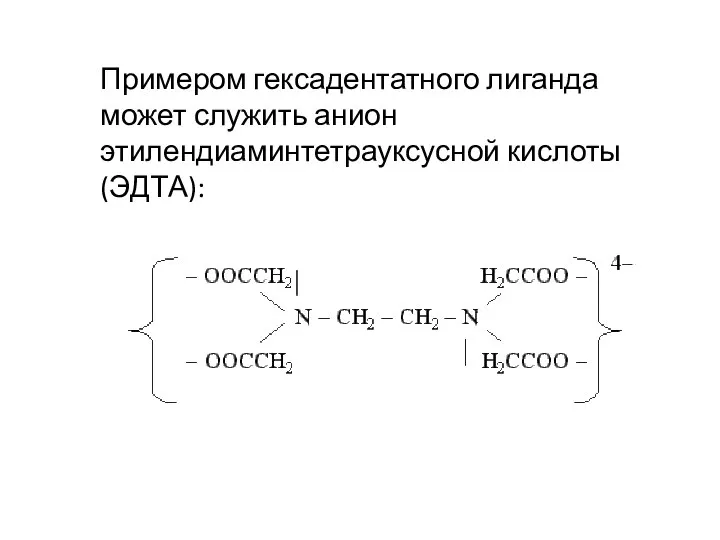
- 28. Примером гексадентатного лиганда может служить анион этилендиаминтетрауксусной кислоты (ЭДТА):
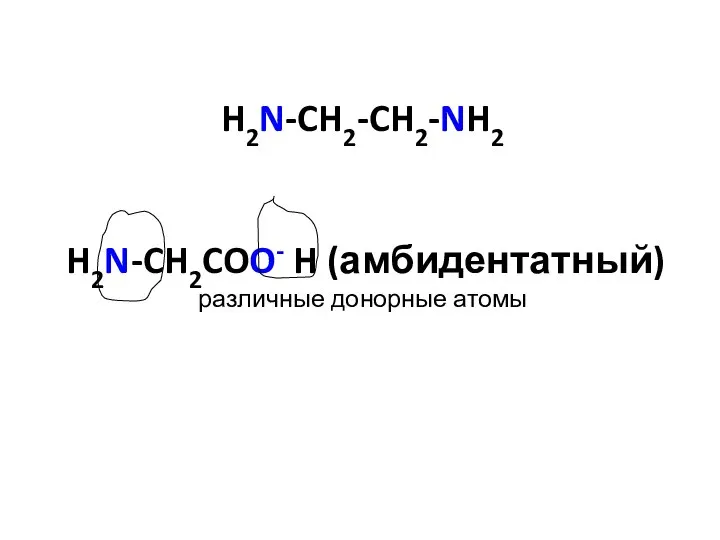
- 29. H2N-CH2-CH2-NH2 H2N-CH2COO- H (амбидентатный) различные донорные атомы
- 30. 1. По заряду внутренней сферы Классификация комплексных соединений
- 31. [Cu(NH3)4]SO4 Na3[Co(NO2)6] [Co(NH3)4Cl2]Cl [Pt(NH3)2Cl2] [Fe(CO)5] K3 [Fe(CN) 6] 2+ 3- + 0 0 3-
- 32. [Cu(NH3)4]SO4 Na3[Co(NO2)6] [Pt(NH3)2Cl2] [Cr(H2O)2(NH3)3 Cl]Br2 Сульфат тетраамминмеди (II) Гексанитрокобальтат (III) натрия Дихлородиамминплатина Бромид хлородиакватриамминхрома (III)
- 33. По природе лиганда 1) Аммиакаты — комплексы, в которых лигандами служат молекулы аммиака, например: [Cu(NH3)4]SO4, [Co(NH3)6]Cl3,
- 34. 4) Ацидокомплексы — комплексы, в которых лигандами являются кислотные остатки. K2[PtCl4], H2[CoCl4], H2[SiF6]. 5) Гидроксокомплексы —
- 35. 7) Циклические (хелатные) комплексы содержат полидентантный лиганд, который захватывает центральный ион подобно клешням, образуя цикл. Между
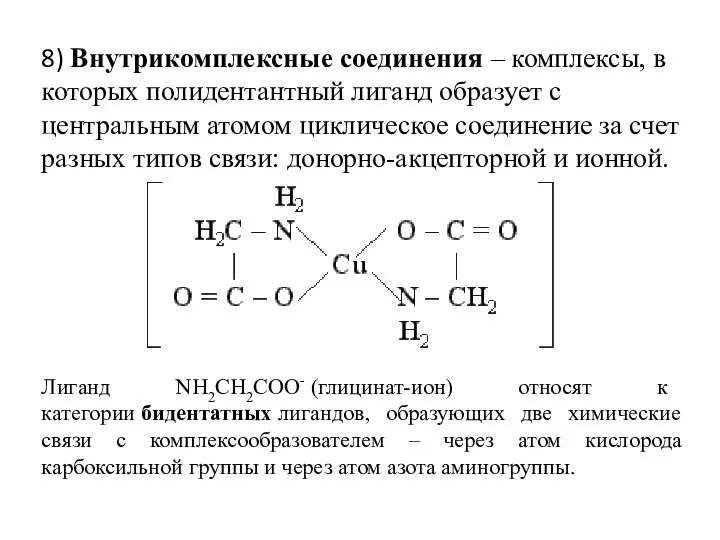
- 36. 8) Внутрикомплексные соединения – комплексы, в которых полидентантный лиганд образует с центральным атомом циклическое соединение за
- 37. Номенклатура Основы современной номенклатуры комплексных соединений были заложены Альфредом Вернером. До его работ в этой области
- 38. Названия некоторых важнейших лигандов
- 39. Номенклатура комплексных соединений K3 [Fe(CN)6] Гексацианоферрат(III) калия [Cu(NH3)4]Cl2 Хлорид тетраамминмеди(II) +3 +2 Порядок перечисления лигандов: Анионные:
- 40. Соль содержит комплексный катион [Cо(NH3)4Cl2]Cl хлорид дихлоротетраамминкобальта (III) -называют анион соли (хлорид); -называют входящие во внутреннюю
- 41. Соль содержит комплексный анион K4[Fe(CN)6] гексацианоферрат (II) калия -называют лиганды-анионы с окончанием на «о» с указанием
- 42. Нейтральный комплекс [Co2(CO)8] октакарбонилдикобальт [Сo(NH3)3 (NO2)2Cl] хлородинитритотриамминкобальт -названия комплексов без внешней сферы состоят из одного слова;
- 43. Упражнение 1 Первое основание Рейзе [Pt(NH3)4](OH)2 Соль Чугаева [Pt(NH3)5Cl]Cl3 Соль Цейзе K[PtCl3C2H4] Пурпуреосоль [Co(NH3)5Cl]Cl2 Кроцеосоль [Co(NH3)4(NO2)2]Cl
- 44. Упражнение 2 Гексанитрокобальтат(III) натрия Na3[Co(NO2)6] Гидроксид диаммминсеребра(I) [Ag(NH3)2]OH реактив Толленса Тетраиодомеркурат(II) калия K2[HgI4] реактив Несслера Тетрароданомеркурат(II)
- 45. Комплексные соединения в растворах
- 46. Химические свойства Комплексные соединения можно условно разделить на две большие группы: электролиты и неэлектролиты. К неэлектролитам
- 47. Комплексные соединения в растворах Первичная диссоциация комплексных соединений K3[Fe(CN)6] = 3K+ + [Fe(CN)6]3- [Cu(NH3)4]SO4 = [Cu(NH3)4]2+
- 48. Если во внешней сфере комплексного соединения находятся гидроксид-ионы, то это соединение – сильное основание (диссоциация идет
- 49. 2. Обратимая диссоциация комплексов. Комплексные ионы подвергаются обратимой электролитической диссоциации как слабые электролиты. [Ag(NH3)2]Cl → [Ag(NH3)2]+
- 50. Вторичная диссоциация комплексов [Ag(NH3)2]+ [Ag(NH3)]+ + NH3 [Ag(NH3)]+ Ag+ + NH3 [Ag+] [NH3]2 KH = =
- 51. K4 [Fe(CN)6]
- 52. K4 [Fe(CN)6]→ 4 K+ + [Fe(CN)6 ] 4- первичная диссоциация
- 53. [Fe(CN)6 ] 4- ↔ Fe2+ +6(CN)- вторичная диссоциация Константа нестойкости (Кн): Kн = 1ּ10-31 (очень прочный
- 54. [Ni(NH3)6]2+ Кн = 2*10-9 (непрочный комплекс) Куст.=1/ Кн
- 55. Кн и Ку относятся только к комплексному иону! Не забывайте !
- 56. Вернер подтверждает Вернера 1893-4 гг. не были периодом утверждения теории. Вернер 20 лет не оставлял лаборатории
- 57. Ряды Вернера - Миолати 1 [Pt(NH3)6]Cl4 2 [Pt(NH3)5Cl]Cl3 3 [Pt(NH3)4Cl2]Cl2 4 [Pt(NH3)3Cl3]Cl 5 [Pt(NH3)2Cl4] 6 K[Pt(NH3)Cl5]
- 58. Разрушение комплексных соединений Труднорастворимый осадок Слабый электролит Окислить или восстановить Выделить в виде газа Связать в
- 59. [Ag (NH3)2]+↔ Ag+ + 2 NH3 Кн = 9,3 ·10-8
- 60. [Ag (NH3)2]++ KI =AgI↓+ NH3 +K+ ПРAgI = 1,5·10 -16 [Ag (NH3)2]++2CN- = [Ag(CN)2]- +2NH3 Кн
- 61. [Ag (NH3)2]+↔ Ag+ + 2 NH3
- 62. 2. При действии сильных кислот происходит разрушение гидроксокомплексов, например: а) при недостатке кислоты Na3[Al(OH)6] + 3HCl
- 63. 3. Нагревание (термолиз) всех аммиакатов приводит к их разложению, например: [Cu(NH3)4]SO4 → CuSO4 + 4NH3
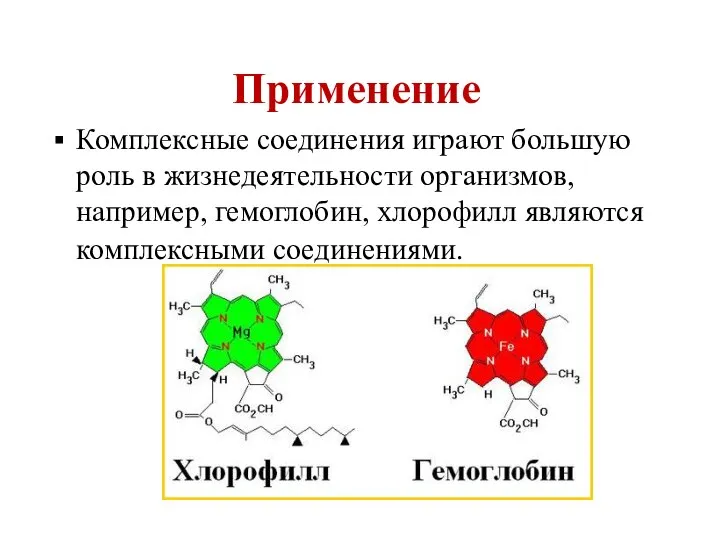
- 64. Применение Комплексные соединения играют большую роль в жизнедеятельности организмов, например, гемоглобин, хлорофилл являются комплексными соединениями.
- 65. Комплексные соединения используются для извлечения металлов из руд. Например, для отделения золота от породы руду обрабатывают
- 66. Для получения чистых железа, никеля, кобальта используют термическое разложение карбонилов металлов. Эти соединения - летучие жидкости,
- 67. K4[Fe(CN)6] - желтая кровяная соль, содержащий ион железа Fe2+, является реактивом на ионы железа Fe3+ в
- 68. K3[Fe(CN)6] - красная кровяная соль является реактивом на обнаружение ионов Fe2+ в растворе: 3Fe2+ + 2[Fe(CN)6]3-
- 69. Комплексные цианиды серебра K[Ag(CN)2] применяют для гальванического серебрения, так как при электролизе растворов обычных солей серебра
- 70. Таким образом, с использованием комплексных соединений связана возможность получения многообразных химических продуктов: лаков, красок, металлов, фотоматериалов,
- 71. [Ag(NH3)2]OH – гидроксид диамминсеребра (I) [Ag(NH3)2]OH → [Ag(NH3)2]+ + OH– [Ag(NH3)2]+ ↔ Ag+ + 2 NH3
- 72. Na[Al(OH)4] – тетрагидроксоалюминат натрия Na[Al(OH)4] →Na+ + [Al(OH)4]– [Al(OH)4]– ↔ Al 3+ + 4 OH–
- 74. Скачать презентацию






![Механизм образования комплексного иона [Al(OH)4]-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404673/slide-8.jpg)

![Строение комплексного соединения K3 [Fe(CN)6] Ион- Комплексо- образователь Лиганды Координационное число](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404673/slide-10.jpg)






![Na[BF4] Na3[AlF6] rB3+ = 0,02 нм rAl3+ = 0,057 нм](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404673/slide-17.jpg)
![Na3[AlF6] Na [AlCl4] Al3+ rF_ = 0,133 нм rCl- = 0,181 нм](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404673/slide-18.jpg)







![[Cu(NH3)4]SO4 Na3[Co(NO2)6] [Co(NH3)4Cl2]Cl [Pt(NH3)2Cl2] [Fe(CO)5] K3 [Fe(CN) 6] 2+ 3- + 0 0 3-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404673/slide-30.jpg)
![[Cu(NH3)4]SO4 Na3[Co(NO2)6] [Pt(NH3)2Cl2] [Cr(H2O)2(NH3)3 Cl]Br2 Сульфат тетраамминмеди (II) Гексанитрокобальтат (III) натрия Дихлородиамминплатина Бромид хлородиакватриамминхрома (III)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404673/slide-31.jpg)

![4) Ацидокомплексы — комплексы, в которых лигандами являются кислотные остатки. K2[PtCl4],](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404673/slide-33.jpg)



![Номенклатура комплексных соединений K3 [Fe(CN)6] Гексацианоферрат(III) калия [Cu(NH3)4]Cl2 Хлорид тетраамминмеди(II) +3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404673/slide-38.jpg)
![Соль содержит комплексный катион [Cо(NH3)4Cl2]Cl хлорид дихлоротетраамминкобальта (III) -называют анион соли](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404673/slide-39.jpg)
![Соль содержит комплексный анион K4[Fe(CN)6] гексацианоферрат (II) калия -называют лиганды-анионы с](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404673/slide-40.jpg)
![Нейтральный комплекс [Co2(CO)8] октакарбонилдикобальт [Сo(NH3)3 (NO2)2Cl] хлородинитритотриамминкобальт -названия комплексов без внешней](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404673/slide-41.jpg)
2 Соль Чугаева [Pt(NH3)5Cl]Cl3 Соль Цейзе K[PtCl3C2H4] Пурпуреосоль [Co(NH3)5Cl]Cl2 Кроцеосоль [Co(NH3)4(NO2)2]Cl](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404673/slide-42.jpg)
![Упражнение 2 Гексанитрокобальтат(III) натрия Na3[Co(NO2)6] Гидроксид диаммминсеребра(I) [Ag(NH3)2]OH реактив Толленса Тетраиодомеркурат(II)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404673/slide-43.jpg)


![Комплексные соединения в растворах Первичная диссоциация комплексных соединений K3[Fe(CN)6] = 3K+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404673/slide-46.jpg)


![Вторичная диссоциация комплексов [Ag(NH3)2]+ [Ag(NH3)]+ + NH3 [Ag(NH3)]+ Ag+ + NH3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404673/slide-49.jpg)
![K4 [Fe(CN)6]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404673/slide-50.jpg)
![K4 [Fe(CN)6]→ 4 K+ + [Fe(CN)6 ] 4- первичная диссоциация](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404673/slide-51.jpg)
![[Fe(CN)6 ] 4- ↔ Fe2+ +6(CN)- вторичная диссоциация Константа нестойкости (Кн):](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404673/slide-52.jpg)
![[Ni(NH3)6]2+ Кн = 2*10-9 (непрочный комплекс) Куст.=1/ Кн](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404673/slide-53.jpg)


![Ряды Вернера - Миолати 1 [Pt(NH3)6]Cl4 2 [Pt(NH3)5Cl]Cl3 3 [Pt(NH3)4Cl2]Cl2 4](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404673/slide-56.jpg)
![[Ag (NH3)2]+↔ Ag+ + 2 NH3 Кн = 9,3 ·10-8](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404673/slide-58.jpg)
![[Ag (NH3)2]++ KI =AgI↓+ NH3 +K+ ПРAgI = 1,5·10 -16 [Ag](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404673/slide-59.jpg)
![[Ag (NH3)2]+↔ Ag+ + 2 NH3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404673/slide-60.jpg)

![3. Нагревание (термолиз) всех аммиакатов приводит к их разложению, например: [Cu(NH3)4]SO4 → CuSO4 + 4NH3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404673/slide-62.jpg)


![K4[Fe(CN)6] - желтая кровяная соль, содержащий ион железа Fe2+, является реактивом](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404673/slide-66.jpg)
![K3[Fe(CN)6] - красная кровяная соль является реактивом на обнаружение ионов Fe2+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404673/slide-67.jpg)
![Комплексные цианиды серебра K[Ag(CN)2] применяют для гальванического серебрения, так как при](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404673/slide-68.jpg)

![[Ag(NH3)2]OH – гидроксид диамминсеребра (I) [Ag(NH3)2]OH → [Ag(NH3)2]+ + OH– [Ag(NH3)2]+ ↔ Ag+ + 2 NH3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404673/slide-70.jpg)
![Na[Al(OH)4] – тетрагидроксоалюминат натрия Na[Al(OH)4] →Na+ + [Al(OH)4]– [Al(OH)4]– ↔ Al 3+ + 4 OH–](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1404673/slide-71.jpg)
 Титан (лат. Titanium; обозначается символом Ti)
Титан (лат. Titanium; обозначается символом Ti) Презентация по Химии "История открытия и экспериментального подтверждения периодического закона" - скачать смотреть
Презентация по Химии "История открытия и экспериментального подтверждения периодического закона" - скачать смотреть  Презентация по Химии "Алкены" - скачать смотреть бесплатно__
Презентация по Химии "Алкены" - скачать смотреть бесплатно__ Закон сохранения массы веществ
Закон сохранения массы веществ Презентация по химии Амины
Презентация по химии Амины Radiation-induced desorption of excited atoms from solid nitrogen
Radiation-induced desorption of excited atoms from solid nitrogen Кислородсодержащие органические соединения. Спирты
Кислородсодержащие органические соединения. Спирты Acizii nucleici
Acizii nucleici Обмен простых белков. Дезаминирование и трансаминирование аминокислот
Обмен простых белков. Дезаминирование и трансаминирование аминокислот Ртуть
Ртуть Трансляция. Активирование аминокислоты
Трансляция. Активирование аминокислоты Амфотерні оксиди та гідроксиди
Амфотерні оксиди та гідроксиди Альдегиды
Альдегиды Словарь архаизмов и историзмов 4 класс
Словарь архаизмов и историзмов 4 класс  Монокристалл. Резка монокристаллического слитка на полупроводниковые пластины
Монокристалл. Резка монокристаллического слитка на полупроводниковые пластины Бикомпонентные покрытия
Бикомпонентные покрытия Фракциялық айдау
Фракциялық айдау Презентация по Химии "Алканы, алкены, алкины: строение, изомерия и номенклатура" - скачать смотреть
Презентация по Химии "Алканы, алкены, алкины: строение, изомерия и номенклатура" - скачать смотреть  Свойства катализатора. Влияние массы катализатора на скорость реакции
Свойства катализатора. Влияние массы катализатора на скорость реакции Предмет физиологии центральной нервной системы
Предмет физиологии центральной нервной системы Определение температуры. Абсолютная температура
Определение температуры. Абсолютная температура Плавиковая кислота или фтористоводородная кислота
Плавиковая кислота или фтористоводородная кислота Классификация химических веществ
Классификация химических веществ Дифузія у побуті
Дифузія у побуті Окислительно-восстановительные реакции в неорганическом синтезе. (Тема 6)
Окислительно-восстановительные реакции в неорганическом синтезе. (Тема 6) Лекарственные средства, влияющие на афферентную иннервацию
Лекарственные средства, влияющие на афферентную иннервацию Продукт полимеризации стирола - полистирол
Продукт полимеризации стирола - полистирол История получения алюминия и его применение
История получения алюминия и его применение