Содержание
- 2. Цель урока: Сформировать представление учащихся о составе, строении, номенклатуре, видах и классификации комплексных соединений. Научить давать
- 3. Содержание урока 1. Понятие : Комплексные соединения 2. Строение комплексных соединений 3. Номенклатура комплексных соединений 4.
- 4. Комплексные называют соединения, содержащие сложные ионы и молекулы, способные к существованию как а кристаллическом виде, так
- 5. Швейцарский химик Альфред Вернер, лауреат Нобелевской премии. Его научная деятельность проходила в Цюрихском университете. Ученый синтезировал
- 6. СТРОЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ N H H H Cl + - [ [ * * * *
- 7. [N-3H+14]Cl-1 КОМПЛЕКСНЫЙ ИОН [NH4]+ ВНУТРЕННЯЯ СФЕРА: КОМПЛЕКСООБРАЗОВАТЕЛЬ N-3 ЛИГАНДЫ H+ ВНЕШНЯЯ СФЕРА АНИОН Cl-
- 8. Лигандами могут быть: а) полярные молекулы NH3 H2O CO NO б) простые ионы CI- Br- I-
- 9. (OH)- 4 [Zn+x Na+ (+1) + x + (-1) ] 2 ·2 ·4 = 0 x
- 10. РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ: Na3[AlF6] Ответ: Na+3[Al+3F-6] K[MgCl3] Na[Al(OH)4] Na4[Fe(CN)6] Ответ: Na+[Al+3(OH)-4] Ответ: K+[Mg+2Cl-3] Ответ:Na+4[Fe+2(CN)-6]
- 11. НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ 2- 4- 3- 5- 6- ди- три- тетра- пента- гекса- ЧИСЛИТЕЛЬНЫЕ: НАЗВАНИЯ ЛИГАНДОВ:
- 12. НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ НАЗВАНИЯ АНИОНОВ: Fe - феррат Cu - купрат Ag - аргентат Au -
- 13. тетра гидроксо цинкат НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Na+2 4] (OH)- [Zn+2 натрия [Cr+3 (H2O)0 6] Cl-3 хлорид
- 14. НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Na3[AlF6] Na[Al(OH)4] K4[Fe(CN)6] Гексафтороалюминат натрия Тетрагидроксоалюминат натрия Гексационоферрат (II) калия
- 15. НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ [Cu(NH3)4]SO4 Сульфат тетраамминмеди (II) [Ag(NH3)2]Cl Хлорид диамминсеребра Хлорид гексааквахрома (III) [Cr(H2O)6]Cl3
- 16. Ответ: K2[PtCl6] Гексахлороплатинат (IV) калия Гексагидроксохромат (III) натрия СОСТАВЬТЕ ФОРМУЛЫ ВЕЩЕСТВ Ответ: Na3[Cr(OH)6]
- 17. ХИМИЧЕСКИЕ СВОЙСТВА 1. Диссоциация комплексных соединений [Cu(NH3)4]SO4 ↔ [Cu(NH3)4]2+ + SO42- комплексный ион ион внешн. среды
- 18. Практическое применение комплексных соединений 1) в аналитической химии для определения многих ионов 2) для разделения некоторых
- 19. Закрепление Задание 2 Заполните пропуски в листе рассказа «Комплексные соединения». Строение комплексных соединений объясняется с позиций
- 20. Домашнее задание Напишите формулы следующих соединений: 1) сульфат гексаамминхрома (II); 2) нитрат гидроксодиамминакваплатины (II); 3) гексацианоферрат
- 22. Скачать презентацию





![[N-3H+14]Cl-1 КОМПЛЕКСНЫЙ ИОН [NH4]+ ВНУТРЕННЯЯ СФЕРА: КОМПЛЕКСООБРАЗОВАТЕЛЬ N-3 ЛИГАНДЫ H+ ВНЕШНЯЯ СФЕРА АНИОН Cl-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1213882/slide-6.jpg)

![(OH)- 4 [Zn+x Na+ (+1) + x + (-1) ] 2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1213882/slide-8.jpg)
![РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ: Na3[AlF6] Ответ: Na+3[Al+3F-6] K[MgCl3] Na[Al(OH)4] Na4[Fe(CN)6] Ответ: Na+[Al+3(OH)-4] Ответ: K+[Mg+2Cl-3] Ответ:Na+4[Fe+2(CN)-6]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1213882/slide-9.jpg)


![тетра гидроксо цинкат НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Na+2 4] (OH)- [Zn+2 натрия](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1213882/slide-12.jpg)
![НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Na3[AlF6] Na[Al(OH)4] K4[Fe(CN)6] Гексафтороалюминат натрия Тетрагидроксоалюминат натрия Гексационоферрат (II) калия](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1213882/slide-13.jpg)
![НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ [Cu(NH3)4]SO4 Сульфат тетраамминмеди (II) [Ag(NH3)2]Cl Хлорид диамминсеребра Хлорид гексааквахрома (III) [Cr(H2O)6]Cl3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1213882/slide-14.jpg)
![Ответ: K2[PtCl6] Гексахлороплатинат (IV) калия Гексагидроксохромат (III) натрия СОСТАВЬТЕ ФОРМУЛЫ ВЕЩЕСТВ Ответ: Na3[Cr(OH)6]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1213882/slide-15.jpg)
![ХИМИЧЕСКИЕ СВОЙСТВА 1. Диссоциация комплексных соединений [Cu(NH3)4]SO4 ↔ [Cu(NH3)4]2+ + SO42- комплексный ион ион внешн. среды](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1213882/slide-16.jpg)



 Витаминная страна
Витаминная страна Дифузія у побуті
Дифузія у побуті Приготовили Прожеева Н, Казаченко Л.
Приготовили Прожеева Н, Казаченко Л. Учитель химии МБОУ СОШ №79 г. о. Самара Язрикова Любовь Михайловна
Учитель химии МБОУ СОШ №79 г. о. Самара Язрикова Любовь Михайловна Физические свойства металлов. (9 класс)
Физические свойства металлов. (9 класс) Сплавы металлов
Сплавы металлов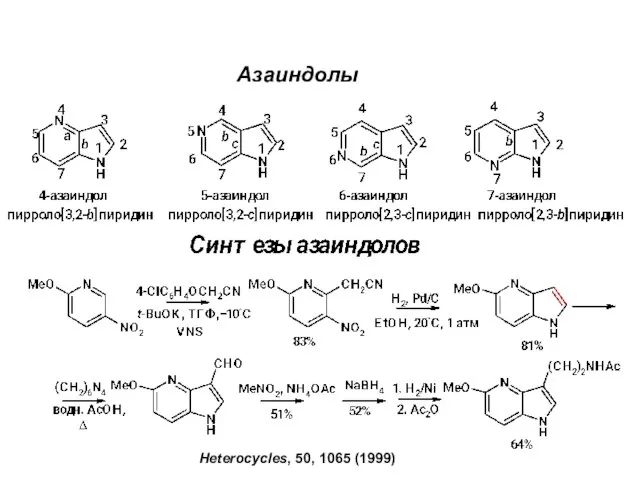 Азаиндолы. Синтeзы азаиндолов
Азаиндолы. Синтeзы азаиндолов Виды присадок к моторным топливам
Виды присадок к моторным топливам Органикалық қышқылдар
Органикалық қышқылдар Мило. Мийні засоби
Мило. Мийні засоби  Презентация по Химии "Атомы, молекулы, химические элементы. Формы существования элементов в природе" - скачать смотреть
Презентация по Химии "Атомы, молекулы, химические элементы. Формы существования элементов в природе" - скачать смотреть  Конформация биомакромолекул. Виды конформационных перестроек
Конформация биомакромолекул. Виды конформационных перестроек Презентация по Химии "алканы алкены алкины алкадиены циклоалканы арены СnH2n+ АЛКАНЫ АЛКЕНЫ АЛКИНЫ АЛКАДИЕНЫ" - скачать смотрет
Презентация по Химии "алканы алкены алкины алкадиены циклоалканы арены СnH2n+ АЛКАНЫ АЛКЕНЫ АЛКИНЫ АЛКАДИЕНЫ" - скачать смотрет Способы получения полимеров (Лекция 3)
Способы получения полимеров (Лекция 3) Алкадиены
Алкадиены Хімія в побуті
Хімія в побуті Каучук
Каучук Коррозионные повреждения
Коррозионные повреждения Повторение. Периодический закон и периодическая система Д.И. Менделеева в свете строения атома
Повторение. Периодический закон и периодическая система Д.И. Менделеева в свете строения атома Дгебуадзе Загра Омардибировна, учитель химии, МОУ «СОШ № 14 г.Зеленокумска» Ставропольский край
Дгебуадзе Загра Омардибировна, учитель химии, МОУ «СОШ № 14 г.Зеленокумска» Ставропольский край Биохимические механизмы нарушения обмена углеводов и липидов
Биохимические механизмы нарушения обмена углеводов и липидов Аттестационная работа. Разработка по выполнению исследовательской работы. Выращивание кристаллов в домашних условиях
Аттестационная работа. Разработка по выполнению исследовательской работы. Выращивание кристаллов в домашних условиях Диены (диолефины, алкадиены)
Диены (диолефины, алкадиены) Обережно РТУТЬ!
Обережно РТУТЬ!  Положение в ПСХЭ Д.И.Менделеева и строение атома
Положение в ПСХЭ Д.И.Менделеева и строение атома Тема: «Вода – основа жизни на Земле»
Тема: «Вода – основа жизни на Земле»  Сульфур Негативній вплив сульфуровмісних сполук
Сульфур Негативній вплив сульфуровмісних сполук  Обратимость химических реакций. Химическое равновесие
Обратимость химических реакций. Химическое равновесие