Содержание
- 2. Это растворы
- 3. «Растворы – это живая кровь, которая создаёт жизнь там, где её не было» Академик Карпинский А.П.
- 4. «В первичном океане ( во время появления жизни на Земле) массовая доля солей была низка около
- 5. Сложные физико-химические процессы, происходящие в организмах человека и животных, также протекают в растворах. Усвоение пищи связано
- 6. http://flavite.ru/Иммунитет и наше здоровье. Ольга Побудей
- 7. Раствором называют однородную (гомогенную) систему, состоящую из частиц растворенного вещества, растворителя и продуктов их взаимодействия. В
- 8. Растворитель-это вещество растворяющее другие вещества В воде хорошо растворяются многие газы, жидкие и твёрдые вещества Вода-
- 9. Раствор – однородная система, состоящая из частиц растворителя, растворённого вещества, продуктов их взаимодействия. Как происходит процесс
- 10. Лабораторный опыт №1 Приготовление растворов Смешаем вещества с водой: Бихромат калия K2CrO4 ( жёлтый) Мел CaCO3(белый)
- 11. Процесс растворения сочетает в себе: физический процесс(дробление до молекул) и химическое взаимодействие компонентов Сторонники физической теории
- 12. Молекулы сахара (белые кружочки), находящиеся на поверхности кристалла сахара, окружены молекулами воды (темные кружочки). Между молекулами
- 13. Диффузия происходит медленно, поэтому около поверхности кристаллов находится избыток уже оторванных от кристалла, но еще не
- 14. Физико-химическая теория растворов Ивана Алексеевич Каблуков – сторонник физико-химической теории растворов
- 15. Растворимость – способность веществ растворяться в каком-либо растворителе. Растворимость показывает сколько грамм вещества способно раствориться в
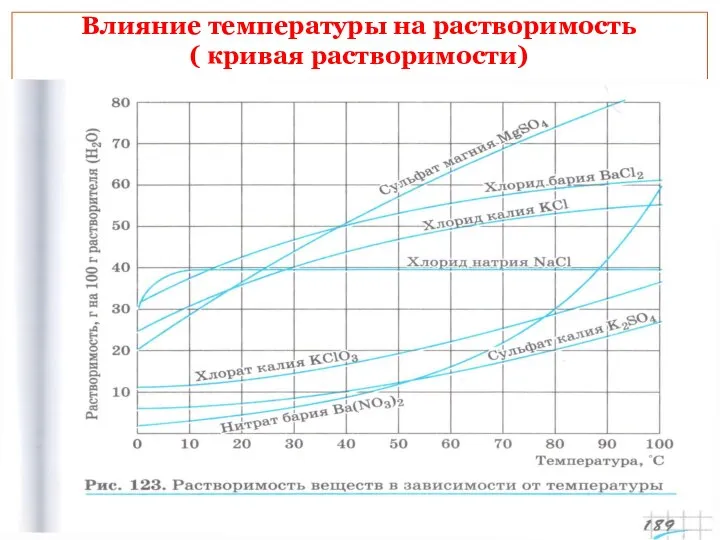
- 16. Влияние температуры на растворимость ( кривая растворимости)
- 17. Решение задач с применением понятия растворимость Пользуясь кривой растворимости определите массовую долю хлорида калия , содержащегося
- 18. Влияние давления на растворимость Давление не оказывает заметного влияния на растворимость твердых веществ, потому что при
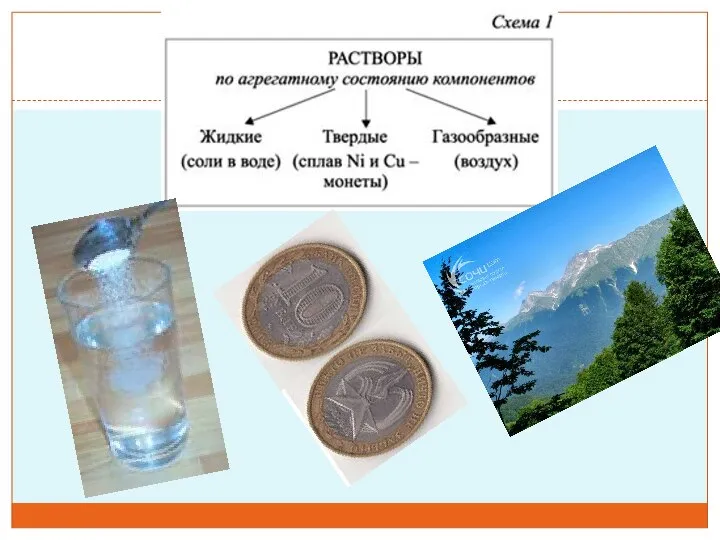
- 20. Классификация растворов
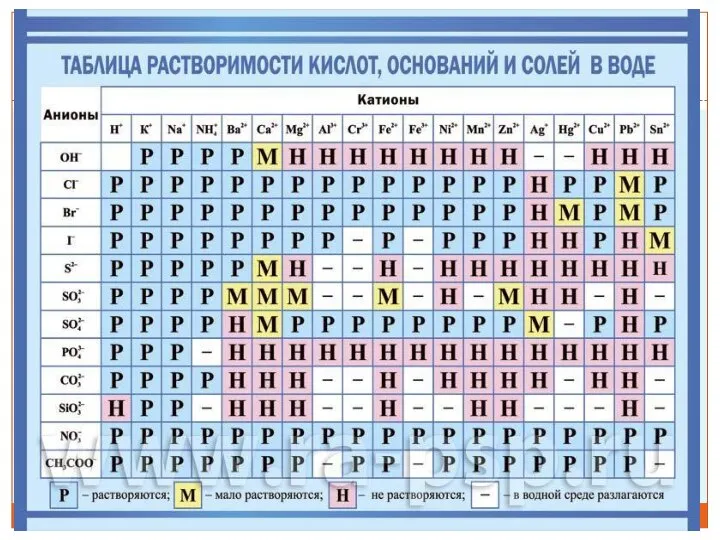
- 22. Для того чтобы определить растворимость веществ в воде, мы будем пользоваться таблицей растворимости солей, кислот и
- 23. Обозначения в таблице растворимости Н – нерастворимые вещества (меньше 0,01 г в 100 г воды), М
- 25. Задание Определить растворимость следующих веществ по таблице растворимости AgNO3 Fe(OH)2 MgCO3
- 26. Концентрация растворов. Массовая доля растворенного вещества.
- 27. Концентрация раствора Отношение количества растворенного вещества к количеству всего раствора
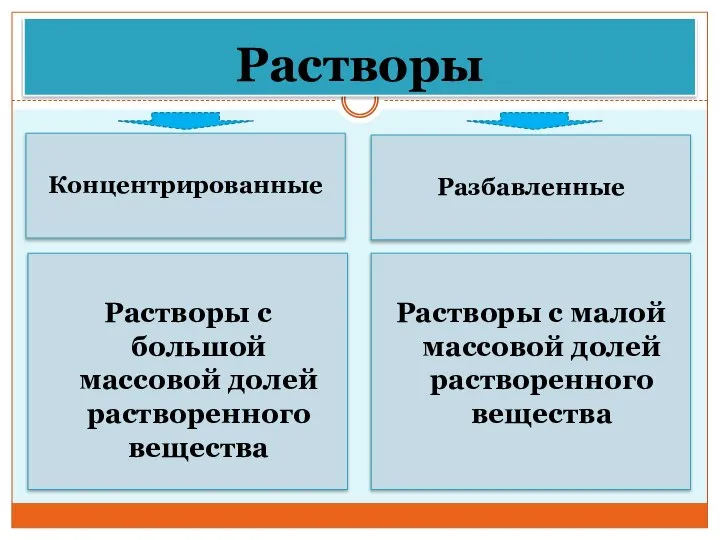
- 28. Растворы Концентрированные Разбавленные Растворы с большой массовой долей растворенного вещества Растворы с малой массовой долей растворенного
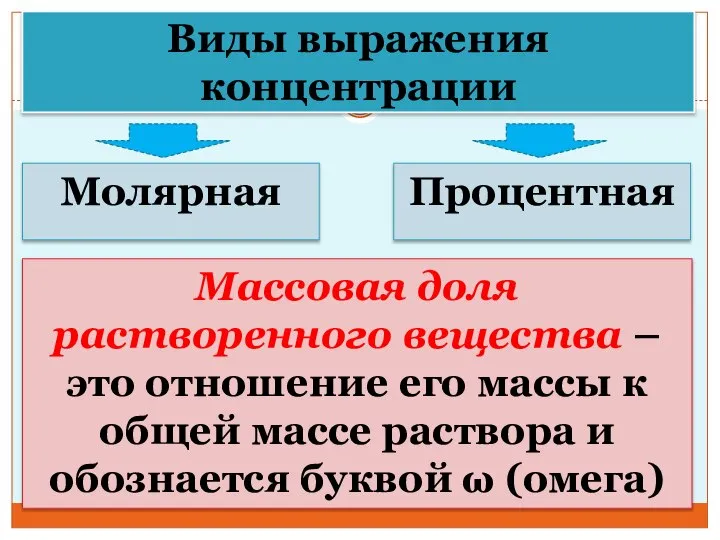
- 29. Виды выражения концентрации Молярная Процентная Массовая доля растворенного вещества – это отношение его массы к общей
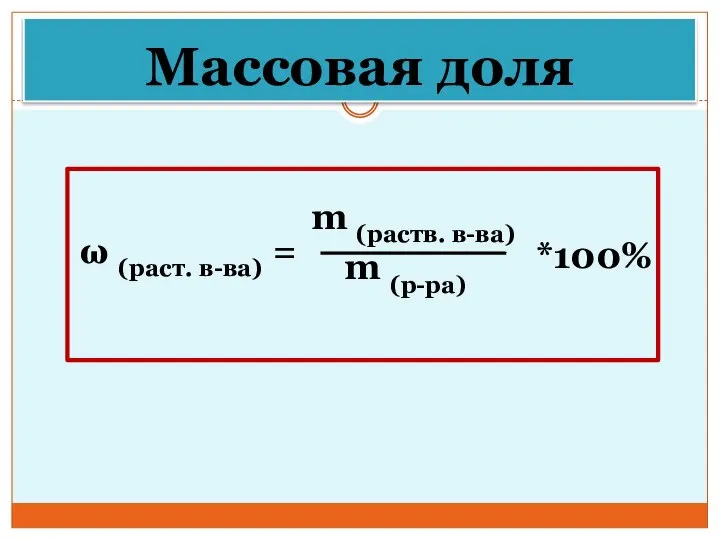
- 30. Массовая доля ω (раст. в-ва) = m (раств. в-ва) m (р-ра) *100%
- 31. Обычно массовую долю выражают в долях единицы ω = 0,05 m=100 г содержится 5,0 г растворенного
- 32. По отношению к растворам процент показывает, какая массовая доля растворенного вещества содержится в растворе массой 100
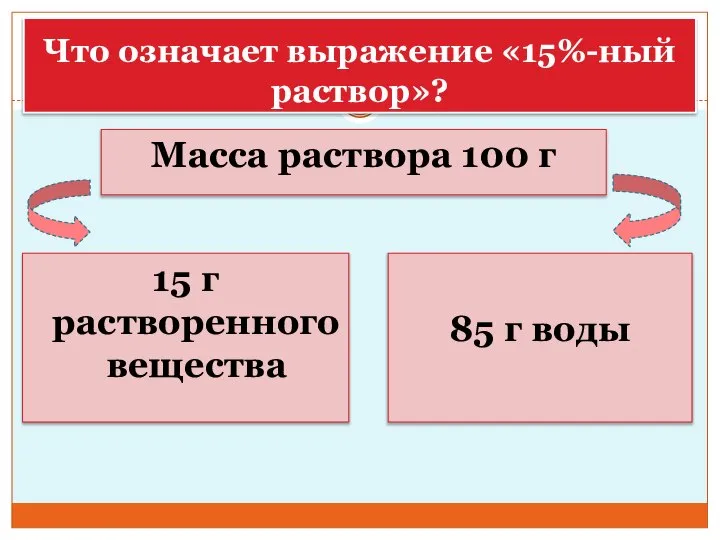
- 33. Что означает выражение «15%-ный раствор»? Масса раствора 100 г 15 г растворенного вещества 85 г воды
- 34. Задача № 1 Определите, сколько потребуется соли и воды, чтобы приготовить 200 г раствора, содержащего 15
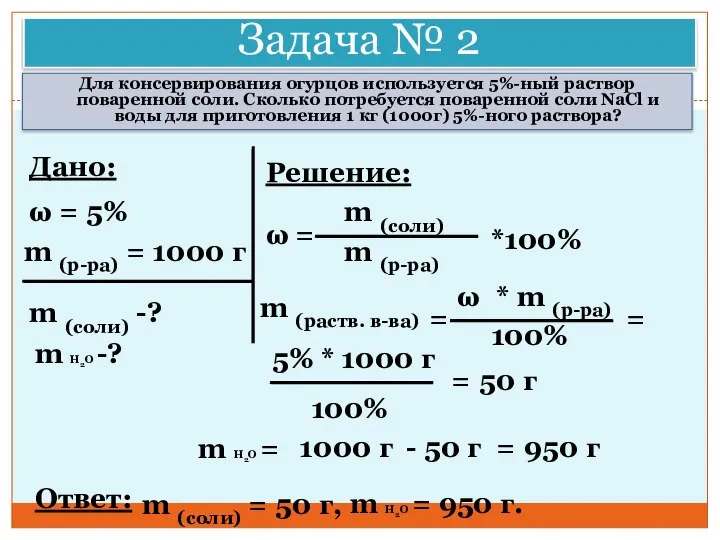
- 35. Задача № 2 Для консервирования огурцов используется 5%-ный раствор поваренной соли. Сколько потребуется поваренной соли NaCl
- 36. Задача № 3 В 60 г воды растворили 20 г сахара. Необходимо вычислить содержание растворенного вещества
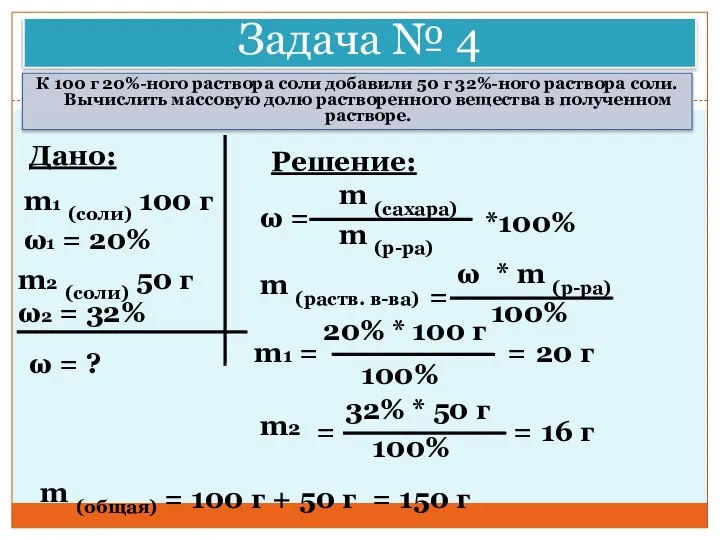
- 37. Задача № 4 К 100 г 20%-ного раствора соли добавили 50 г 32%-ного раствора соли. Вычислить
- 38. Задача № 4 К 100 г 20%-ного раствора соли добавили 50 г 32%-ного раствора соли. Вычислить
- 40. Скачать презентацию




























 Классификация высокомолекулярных соединений
Классификация высокомолекулярных соединений Картофельное пюре быстрого приготовления
Картофельное пюре быстрого приготовления Окисно-відновні реакції та їхнє значення
Окисно-відновні реакції та їхнє значення Основы химической кинетики
Основы химической кинетики Заттардың агрегаттық күйлері
Заттардың агрегаттық күйлері Синтез и свойства КФ - смол, модифицированных производными меламина
Синтез и свойства КФ - смол, модифицированных производными меламина Разработка препаративных методик получения фосфатсодержащих производных бетулина с улучшенной растворимостью в воде
Разработка препаративных методик получения фосфатсодержащих производных бетулина с улучшенной растворимостью в воде Основные классы неорганических веществ
Основные классы неорганических веществ Липиды. Классификация
Липиды. Классификация Физико-химия полимеров и их растворов
Физико-химия полимеров и их растворов Однолучевой спектрофотометр
Однолучевой спектрофотометр Электрондардың атомдарда орналасуы
Электрондардың атомдарда орналасуы Горно-химическое сырье
Горно-химическое сырье Структура електронної оболонки атома
Структура електронної оболонки атома Общая характеристика неметаллов
Общая характеристика неметаллов Фармакодинамика лекарственных средств
Фармакодинамика лекарственных средств Презентация по химии Кислоты 8 класс
Презентация по химии Кислоты 8 класс Поверхностные явления. Типы поверхностных явлений
Поверхностные явления. Типы поверхностных явлений Антигистаминные препараты
Антигистаминные препараты Физическая технология топлива. Требования, предъявляемые к дизельным топливам
Физическая технология топлива. Требования, предъявляемые к дизельным топливам Теория гибридизации. (Лекция 3)
Теория гибридизации. (Лекция 3) Почва. Интегрированный урок по химии и географии
Почва. Интегрированный урок по химии и географии Кислородные соединения азота
Кислородные соединения азота Оксид кремния
Оксид кремния Химия в повседневной жизни человека
Химия в повседневной жизни человека СПИРТЫ Урок химии в 9-10 классе
СПИРТЫ Урок химии в 9-10 классе Целлюлоза
Целлюлоза  Биохимические функции железа
Биохимические функции железа