Содержание
- 2. Слово коррозия происходит от латинского corrodere, что означает разъедать. Хотя коррозию чаще всего связывают с металлами,
- 3. коррозией называют самопроизвольный процесс разрушения материалов и изделий из них под химическим воздействием окружающей среды. Процессы
- 4. Ржавлением называют только коррозию железа и его сплавов. Другие металлы корродируют, но не ржавеют. Хотя корродируют
- 5. Различают несколько видов коррозии. А. По площади и характеру поражения: сплошная, точечная, язвенная, межкристаллическая. Б. По
- 6. Химическая коррозия
- 7. При химической коррозии идет окисление металла без возникновения цепи электрического тока: 3Fe + 2O2 = Fe3O4
- 8. Кислая среда растворяет оксидную пленку, и алюминий в виде солей поступает в организм человека.
- 9. Оксидная пленка железа очень рыхлая (вспомните какой-либо ржавый предмет – как только вы берете его в
- 10. Электрохимическая коррозия одного металла
- 11. При электрохимической коррозии возникает электрическая цепь. При этом могут быть случаи коррозии как одного металла, так
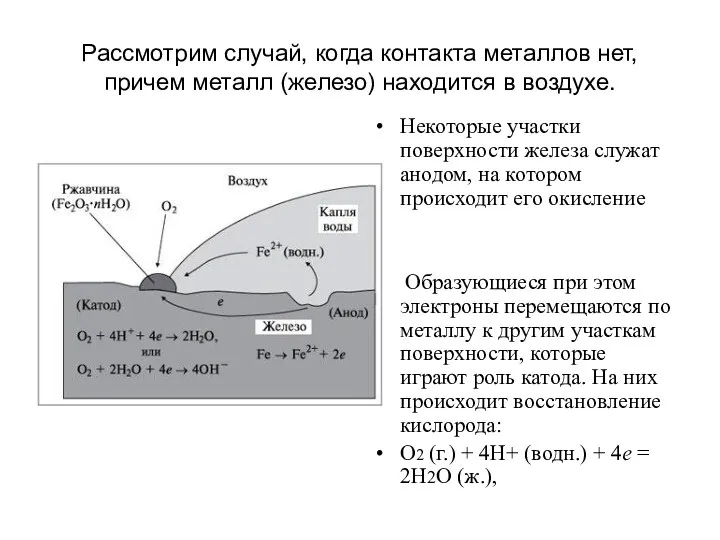
- 12. Рассмотрим случай, когда контакта металлов нет, причем металл (железо) находится в воздухе. Некоторые участки поверхности железа
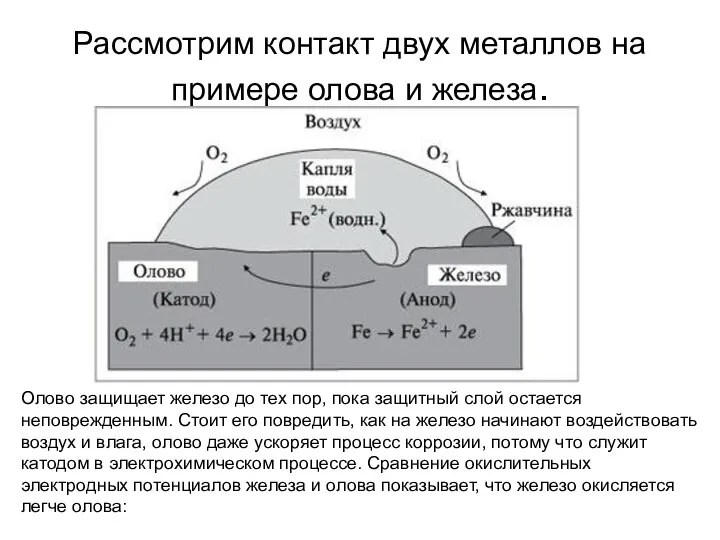
- 13. Рассмотрим контакт двух металлов на примере олова и железа. Олово защищает железо до тех пор, пока
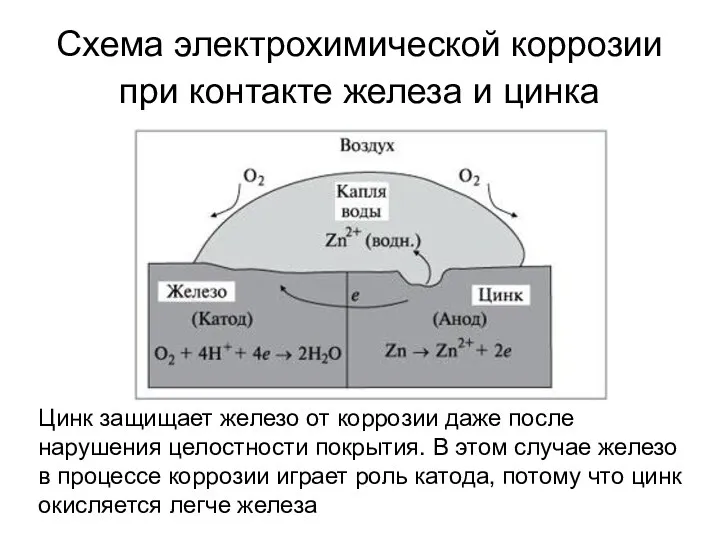
- 14. Схема электрохимической коррозии при контакте железа и цинка Цинк защищает железо от коррозии даже после нарушения
- 15. Основные способы защиты от коррозии
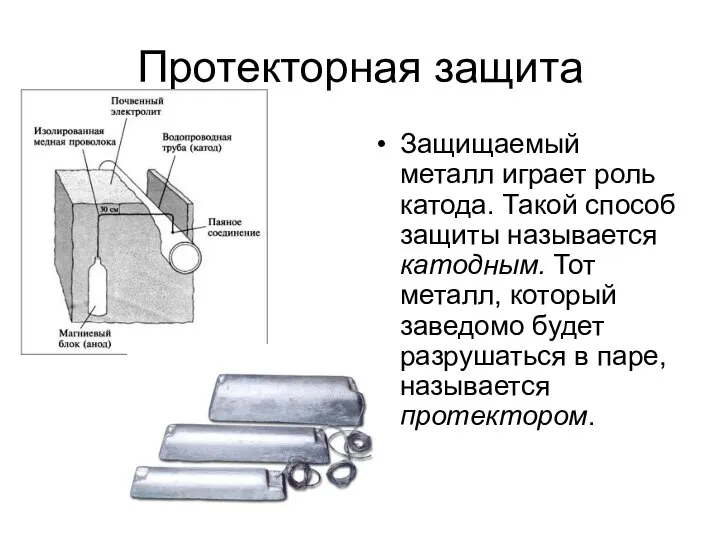
- 16. Протекторная защита Защищаемый металл играет роль катода. Такой способ защиты называется катодным. Тот металл, который заведомо
- 17. Электрозащита Конструкция, находящаяся в среде электролита, соединяется с другим металлом (обычно куском железа, рельсом и т.п.),
- 18. Легированные сплавы Если металл, например хром, создает плотную оксидную пленку, его добавляют в железо, и образуется
- 19. Пассивирование Металл можно пассивировать – обработать его поверхность так, чтобы образовалась тонкая и плотная пленка оксида,
- 20. Ингибиторы Ингибиторы (замедлители) коррозии тоже переводят металл в пассивное состояние, образуя на его поверхности тонкие защитные
- 21. Защитные покрытия
- 22. Защитные покрытия Защитить металл можно, препятствуя проникновению к нему влаги и кислорода, – например, нанося на
- 24. Скачать презентацию

















 Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Микроцентрифуги для выделения ДНК в ПЦР
Микроцентрифуги для выделения ДНК в ПЦР Начала органической химии
Начала органической химии Презентация по Химии "Карбоновые кислоты 9 класс" - скачать смотреть
Презентация по Химии "Карбоновые кислоты 9 класс" - скачать смотреть  Презентация по Химии "Железо" - скачать смотреть
Презентация по Химии "Железо" - скачать смотреть  Обобщение по типам химических реакций
Обобщение по типам химических реакций Разработка водно-парафиновых эмульсий для антикоррозийной обработки металлов
Разработка водно-парафиновых эмульсий для антикоррозийной обработки металлов Сера и ее важнейшие соединения 16S 1s22s22p63s23p4 (р- элемент) S8 – ромбическая сера (наиболее устойчивая аллотропная модификация серы;
Сера и ее важнейшие соединения 16S 1s22s22p63s23p4 (р- элемент) S8 – ромбическая сера (наиболее устойчивая аллотропная модификация серы; Классификация органических соединений
Классификация органических соединений Разработка технологии получения наноструктурированных катализаторов для гидрирования
Разработка технологии получения наноструктурированных катализаторов для гидрирования Получение искусственного малахита из яичной скорлупы и изучение влияния температуры на скорость химической реакции
Получение искусственного малахита из яичной скорлупы и изучение влияния температуры на скорость химической реакции Температура и тепловое равновесие
Температура и тепловое равновесие «Созвездие талантов». Игра-зачет по теме «Основные классы неорганической химии» 8 класс
«Созвездие талантов». Игра-зачет по теме «Основные классы неорганической химии» 8 класс Основы химической термодинамики. Термохимические расчеты
Основы химической термодинамики. Термохимические расчеты Вода - Н2О
Вода - Н2О Ионная связь. Взаимная поляризация ионов
Ионная связь. Взаимная поляризация ионов Полифункциональные органические соединения
Полифункциональные органические соединения Сероводородная кислота
Сероводородная кислота Фізичні та хімічні властивості кислот (урок хімії у 8 класі)
Фізичні та хімічні властивості кислот (урок хімії у 8 класі) Внеклассное мероприятие по химии. Своя игра
Внеклассное мероприятие по химии. Своя игра Классы неорганических веществ
Классы неорганических веществ Предмет и задачи биохимии. Белки. (Лекция 1)
Предмет и задачи биохимии. Белки. (Лекция 1) Аминокислоты. Белки
Аминокислоты. Белки Пластмаси, синтетичні каучуки Підготували учениці 11-б класу Оренбургська Марина та Козаренко Таїсія
Пластмаси, синтетичні каучуки Підготували учениці 11-б класу Оренбургська Марина та Козаренко Таїсія  Презентация по Химии "Презентація на тему: Природний газ" - скачать смотреть бесплатно
Презентация по Химии "Презентація на тему: Природний газ" - скачать смотреть бесплатно Предалхимический период
Предалхимический период Презентация по Химии "Вперед к вершине Химического Олимпа" - скачать смотреть
Презентация по Химии "Вперед к вершине Химического Олимпа" - скачать смотреть  Домашняя работа на каникулы
Домашняя работа на каникулы