Содержание
- 2. ПЛАН УРОКА Понятие коррозии Значение коррозии Виды коррозии Условия, способствующие коррозии Химизм процесса коррозии Способы защиты
- 3. ЭТАПЫ УРОКА
- 4. ИСТОРИЧЕСКИЙ ЭТАП
- 6. ЭТАПЫ УРОКА информационный исторический экспериментальный практический
- 7. ИНФОРМАЦИОННЫЙ ЭТАП КОРРОЗИЯ – самопроизвольное разрушение металлов и сплавов в результате химического или электрохимического взаимодействия их
- 8. ЗНАЧЕНИЕ КОРРОЗИИ Вызывает серьезные экологические последствия: утечка нефти, газа, других химических продуктов. Недопустима во многих отраслях
- 9. ФАКТОРЫ, ВЫЗЫВАЮЩИЕ КОРРОЗИЮ Кислород и влага атмосферы Углекислый и сернистый газы, содержащиеся в атмосфере Морская вода
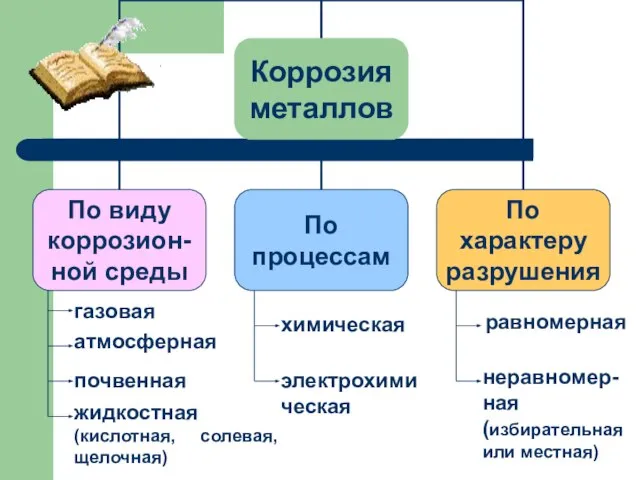
- 10. газовая атмосферная почвенная жидкостная (кислотная, солевая, щелочная) химическая электрохимическая равномерная неравномер- ная (избирательная или местная)
- 11. ВИДЫ КОРРОЗИИ ХИМИЧЕСКАЯ – это разрушение металлов и сплавов в результате их химического взаимодействия с веществами
- 12. ХИМИЧЕСКАЯ КОРРОЗИЯ
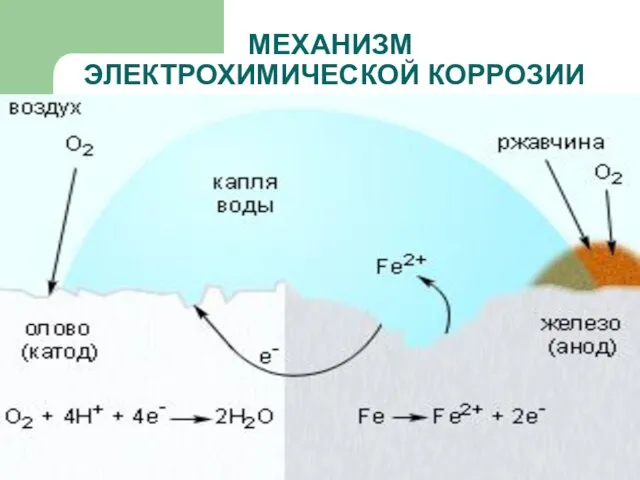
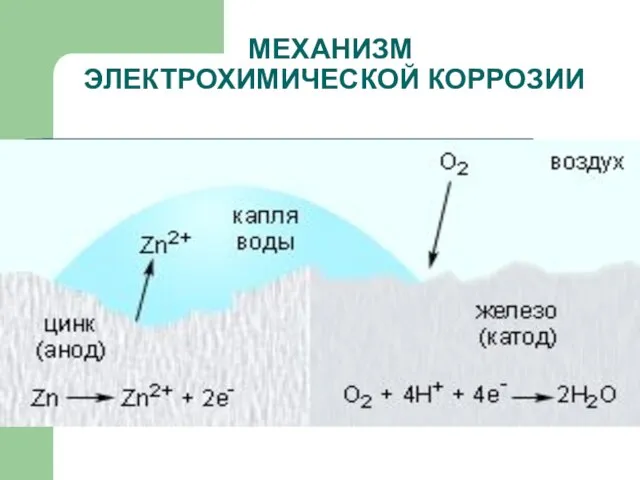
- 13. ВИДЫ КОРРОЗИИ ЭЛЕКТРОХИМИЧЕСКАЯ – это разрушение металлов, которое сопровождается возникновением электрического тока в воде или среде
- 14. УСЛОВИЯ, СПОСОБСТВУЮЩИЕ ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ Положение металла в ряду активности металлов: чем они дальше расположены друг от
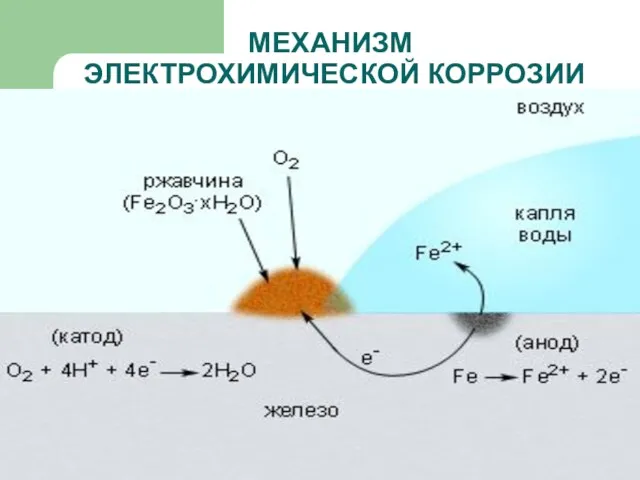
- 15. МЕХАНИЗМ ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ
- 16. МЕХАНИЗМ ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ
- 17. МЕХАНИЗМ ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ
- 18. 1 группа – щелочные металлы – наименьшая коррозийная стойкость.(побочная подгруппа – весьма стойкие металлы) 2 группа
- 19. 3 группа – Алюминий – образуется прочная оксидная пленка ( но она разрушается в растворах кислот
- 20. 5,6,7,8 группы – металлы побочных подгрупп обладают высокой способностью к пассивации, а следовательно, большой коррозионной стойкостью.
- 21. СПОСОБЫ ЗАЩИТЫ ОТ КОРРОЗИИ Нанесение защитных покрытий (лаки, краски, эмали); Покрытие другим металлом (позолота, серебрение, хромирование,
- 22. ЭТАПЫ УРОКА информационный исторический экспериментальный практический
- 23. ЭТАПЫ УРОКА информационный исторический экспериментальный практический
- 25. Скачать презентацию














 Сущность процесса электролиза
Сущность процесса электролиза Твердость минералов и их применение
Твердость минералов и их применение Высокоэффективная жидкостная хроматография в анализе готовых лекарственных форм и контроле технологии их производства
Высокоэффективная жидкостная хроматография в анализе готовых лекарственных форм и контроле технологии их производства Биодеградируемые полимеры – продукты биотехнологии
Биодеградируемые полимеры – продукты биотехнологии Получение и применение порфиринов и их аналогов
Получение и применение порфиринов и их аналогов Гетероциклические соединения
Гетероциклические соединения Минеральный состав пород
Минеральный состав пород Нарушение метаболизма
Нарушение метаболизма Миграция химических элементов
Миграция химических элементов Неметаллические материалы, используемые в машино- и приборостроении
Неметаллические материалы, используемые в машино- и приборостроении Алкадиены Непредельные углеводороды
Алкадиены Непредельные углеводороды Біохімія білків
Біохімія білків Жидкие кристаллы
Жидкие кристаллы Токсические химические элементы. Химизм действия
Токсические химические элементы. Химизм действия Введение. Классификации в аналитической химии. Типы реакций, применяемых в аналитической химии
Введение. Классификации в аналитической химии. Типы реакций, применяемых в аналитической химии Корунд. Разновидности корунда
Корунд. Разновидности корунда Презентация по Химии "Мыла и моющие средства" - скачать смотреть бесплатно
Презентация по Химии "Мыла и моющие средства" - скачать смотреть бесплатно Ароматические соединения. Галогенпроизводные
Ароматические соединения. Галогенпроизводные Брейн – ринг. Мини – ЕГЭ по химии
Брейн – ринг. Мини – ЕГЭ по химии Предмет химии. Основные задачи курса
Предмет химии. Основные задачи курса Презентация по теме: Химический состав клетки
Презентация по теме: Химический состав клетки Основы химической термодинамики
Основы химической термодинамики ОБЩАЯ ХИМИЯ 11 КЛАСС РАЗДЕЛ «ВЕЩЕСВА И ИХ СВОЙСТВА»
ОБЩАЯ ХИМИЯ 11 КЛАСС РАЗДЕЛ «ВЕЩЕСВА И ИХ СВОЙСТВА» Легированные конструкционные стали. Инструментальные легированные стали
Легированные конструкционные стали. Инструментальные легированные стали Природный и попутный нефтяной газ
Природный и попутный нефтяной газ Папайя-сarica papaya L. Сырьё - fructus caricae. Семейство кариковые caricaceae
Папайя-сarica papaya L. Сырьё - fructus caricae. Семейство кариковые caricaceae Чемпионат НХЛ (национальной химической лиги)
Чемпионат НХЛ (национальной химической лиги) Коррозия металлов и способы защиты от неё. (11 класс)
Коррозия металлов и способы защиты от неё. (11 класс)