Содержание
- 2. План 1) Определение коррозии металлов 2) Виды 3) Способы защиты от коррозии
- 3. Коррозия – самопроизвольное разрушение металлов под действием окружающей среды. Коррозия – окислительно-восстановительный процесс. Коррозия может происходить
- 4. Виды коррозии металлов Химическая – разрушение металла без появления электрического тока под действием окружающей среды. Электрохимическая
- 5. Химическая коррозия Металл разрушается, взаимодействуя с окружающей средой. Такой тип коррозии присущ средам, которые не способны
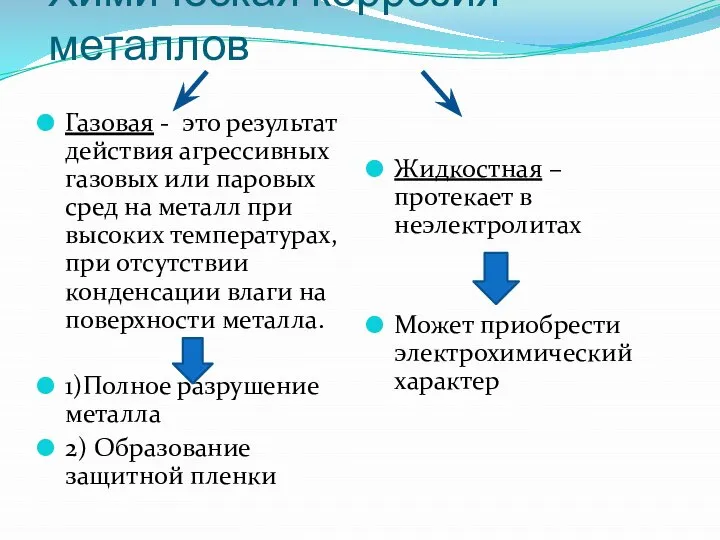
- 6. Химическая коррозия металлов Газовая - это результат действия агрессивных газовых или паровых сред на металл при
- 7. Электрохимическая коррозия Если металлическое изделие находится в среде электролита. Деполяризация – процесс отвода электронов с катодных
- 8. Электрохимическая коррозия металлов Коррозия в растворах электролитов — в растворах кислот, оснований, солей, в природной воде.
- 9. Способы защиты от коррозии Покрытие поверхности металлов. Для защиты металлических поверхностей от коррозии ее покрывают лаком,
- 11. Скачать презентацию







 Самородные элементы
Самородные элементы Кислородсодержащие. Углеводы. Подготовка к ЕГЭ
Кислородсодержащие. Углеводы. Подготовка к ЕГЭ Топливо и его характеристики
Топливо и его характеристики Презентация по Химии "Общая характеристика подгруппы углерода. Углерод" - скачать смотреть
Презентация по Химии "Общая характеристика подгруппы углерода. Углерод" - скачать смотреть  ЕГЭ Химия. Задание №5
ЕГЭ Химия. Задание №5 Allgemeine Chemie für PharmazeutInnen
Allgemeine Chemie für PharmazeutInnen Биохимия витаминов. Классификация витаминов. Жирорастворимые витамины. (Лекция 20)
Биохимия витаминов. Классификация витаминов. Жирорастворимые витамины. (Лекция 20) Некоторые структурные особенности макромолекул
Некоторые структурные особенности макромолекул Презентация по химии Изомерия
Презентация по химии Изомерия  Агрохимия растений
Агрохимия растений Гетероциклические соединения. Синтетические пиретроиды
Гетероциклические соединения. Синтетические пиретроиды Методические рекомендации по изучению курса «Коррозия и защита металлов»
Методические рекомендации по изучению курса «Коррозия и защита металлов» Нітрати – токсичні речовини
Нітрати – токсичні речовини  Строение и функции отдельных коферментов
Строение и функции отдельных коферментов Аналитическая химия. Качественный анализ
Аналитическая химия. Качественный анализ Основания
Основания Амінокислоти
Амінокислоти Природные биоактивные соединения (БИС)
Природные биоактивные соединения (БИС) Химия: классификация химических реакций
Химия: классификация химических реакций Жиры. Классификация
Жиры. Классификация Стиральные порошки и средства для стирки 2016
Стиральные порошки и средства для стирки 2016 Комплекс заходів з ліквідації наслідків радіаційне небезпечної надзвичайної ситуації
Комплекс заходів з ліквідації наслідків радіаційне небезпечної надзвичайної ситуації Эндогенная серия. Магматическая группа
Эндогенная серия. Магматическая группа Конкурс интерактивных презентаций «Интерактивная мозаика» автор: Кудрявцева Ирина Александровна МОУ «Средняя общеобразова
Конкурс интерактивных презентаций «Интерактивная мозаика» автор: Кудрявцева Ирина Александровна МОУ «Средняя общеобразова Твердофазное восстановление металлов и образование карбидов из хромовых концентратов Аганозерского месторождения
Твердофазное восстановление металлов и образование карбидов из хромовых концентратов Аганозерского месторождения Фосфор и его соединения
Фосфор и его соединения Типы ингибирования и их характерные черты
Типы ингибирования и их характерные черты Сполуки неметалічних елементів з гідрогеном. Амоніак та хлороводень
Сполуки неметалічних елементів з гідрогеном. Амоніак та хлороводень