Содержание
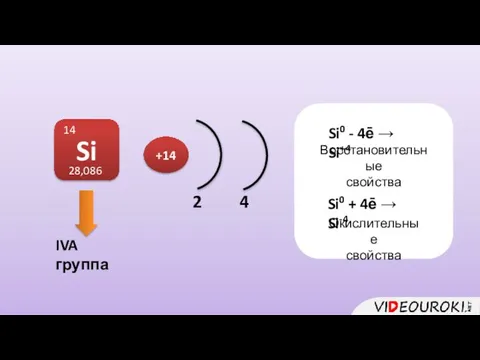
- 2. IVA группа Si 14 28,086 2 4 +14 Si0 - 4ē → Si+4 Восстановительные свойства Si0
- 3. SiO2 оксид кремния (IV) кремнезём горный хрусталь аметист агат топаз опал яшма халцедон сердолик
- 4. Природные силикаты – сложные вещества. Алюмосиликаты – силикаты, в состав которых входит алюминий. каолинит Al2O3 ·
- 5. Асбест используется для изготовления огнеупорных тканей.
- 6. Из разновидностей минералов на основе оксида кремния (IV) первобытные люди изготавливали орудия труда.
- 7. Оксид кремния (IV) у растений и животных
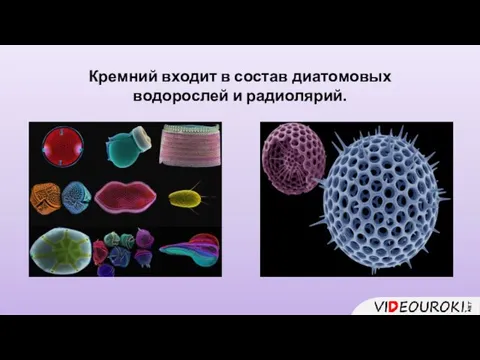
- 8. Кремний входит в состав диатомовых водорослей и радиолярий.
- 9. Получение SiO2 + 2C = Si + 2CO t 3SiO2 + 4Al = 3Si + 2Al2O3
- 10. Аллотропные модификации кремния Это бурый порошок. Аморфный кремний Твёрдое вещество тёмно-серого цвета с металлическим блеском. Он
- 11. Кремний является полупроводником. С повышением температуры его электропроводность увеличивается.
- 12. Реакция с кислородом Химические свойства кремния Si + O2 = SiO2 t оксид кремния (IV) 0
- 13. Реакции с металлами Химические свойства кремния t силицид магния 0 0 +2 -4 Реакция силицида с
- 14. Горение силана SiH4 + 2O2 = SiO2 + 2H2O t оксид кремния (IV) вода Реакция кремния
- 15. Получение кремния SiO2 + 2Mg = 2MgO + Si t SiO2 + 2С = Si +
- 16. Оксид кремния (IV), кремнезём SiO2 Это твёрдое, очень тугоплавкое вещество. Он нерастворим в воде. Имеет атомную
- 17. Химические свойства оксида кремния (IV) Реакции со щелочами Оксид кремния (IV) не растворяется в воде: SiO2
- 18. Химические свойства оксида кремния (IV) Реакции с карбонатами SiO2 + Na2CO3 = Na2SiO3 + CO2↑ t
- 19. Химические свойства кремниевой кислоты H2SiO3 Студенистое, нерастворимое в воде вещество. Она относится к очень слабым кислотам.
- 20. Качественная реакция на силикат-ион Na2SiO3 + 2HCl = 2NaCl + H2SiO3↓ SiO32- + 2H+ = H2SiO3↓
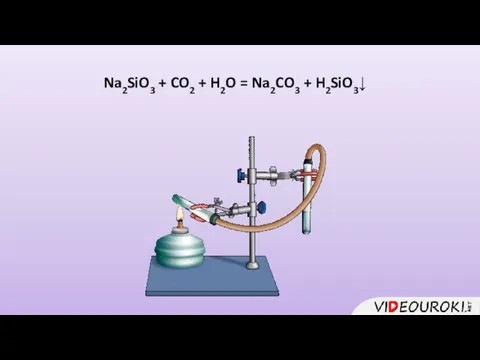
- 21. Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3↓
- 22. H2SiO3 + 2NaOH = Na2SiO3 + 2H2O t
- 23. Применение кремния и его соединений 1 1 - получения полупроводниковых материалов и кислотоупорных сплавов 2 2
- 25. Производство стекла Na2O · CaO · 6SiO2 Сода + известняк + песок = оконное стекло
- 26. Оксид калия Богемское стекло Оксид свинца (II) Хрустальное стекло Оксид хрома (III) Зелёное стекло Оксид кобальта
- 27. Закалка стекла Стекло особого состава нагревают до температуры около 600 0С, а затем резко охлаждают.
- 28. Стекло человеку известно давно, уже 3-4 тыс. лет назад производство стекла было в Египте, Сирии, Финикии,
- 29. Оконное стекло Бутылочное стекло Ламповое стекло Зеркальное стекло Оптическое стекло
- 30. Основным сырьём в производстве керамических изделий является глина. При смешивании глины с водой образуется тестообразная масса.
- 31. Цемент получают спеканием глины и известняка. Если смешать порошок цемента с водой, то образуется так называемый
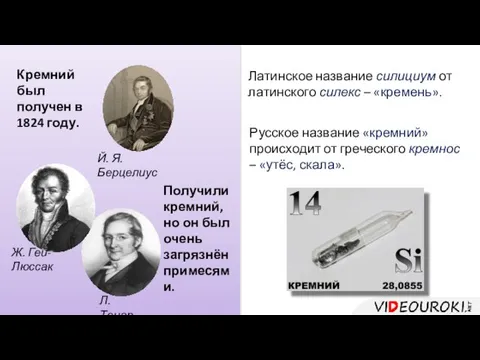
- 32. Кремний был получен в 1824 году. Й. Я. Берцелиус Получили кремний, но он был очень загрязнён
- 33. Кремний – элемент IVA группы. В соединениях для него характерны степени окисления +4 и -4. В
- 35. Скачать презентацию




























 СОЕДИНЕНИЯ ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ
СОЕДИНЕНИЯ ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ Аттестационная работа. Программа кружка по химии «Юный химик»
Аттестационная работа. Программа кружка по химии «Юный химик» Электронное строение атома. Периодический закон
Электронное строение атома. Периодический закон Кетоны
Кетоны Point defects and diffusion
Point defects and diffusion Презентация по Химии "Презентация Химический состав растений" - скачать смотреть
Презентация по Химии "Презентация Химический состав растений" - скачать смотреть  Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Продолжение лекции «Химическая связь»
Продолжение лекции «Химическая связь» Коллоидно-химические свойства и методы определения дисперсности НДС. Лекция 3
Коллоидно-химические свойства и методы определения дисперсности НДС. Лекция 3 Обмен липидов
Обмен липидов Неорганические вещества, входящие в состав клетки
Неорганические вещества, входящие в состав клетки Биогенные элементы периодической системы
Биогенные элементы периодической системы Опыты в домашних условиях
Опыты в домашних условиях Элементы подгруппы углерода
Элементы подгруппы углерода Химические реакции. Изменение степеней окисления
Химические реакции. Изменение степеней окисления Виды химической связи
Виды химической связи Характеристика азота и фосфора. Свойства азота
Характеристика азота и фосфора. Свойства азота Температурная зависимость скорости химической реакции
Температурная зависимость скорости химической реакции Решение задач на избыток и недостаток
Решение задач на избыток и недостаток Углерод. 9 класс
Углерод. 9 класс Применение газовых разрядов в быту Подготовила: ученица 9-А класса СООШ №18 Кальченко Елена
Применение газовых разрядов в быту Подготовила: ученица 9-А класса СООШ №18 Кальченко Елена  Одноатомные спирты
Одноатомные спирты Количество вещества
Количество вещества Классификация органических реакций в органической химии
Классификация органических реакций в органической химии Игра по химии Разработала учитель химии МОУ «Яльчикская СОШ» Левая В.Н.
Игра по химии Разработала учитель химии МОУ «Яльчикская СОШ» Левая В.Н. Пигменті в реставрации декоративно-прикладного искусства
Пигменті в реставрации декоративно-прикладного искусства БЫТОВАЯ ХИМИЯ. МОЮЩИЕ СРЕДСТВА МОУ СОШ № 95 Советского района городского округа г.Уфа
БЫТОВАЯ ХИМИЯ. МОЮЩИЕ СРЕДСТВА МОУ СОШ № 95 Советского района городского округа г.Уфа Сапропель және бактериалды тыңайтқыштар және қордалар
Сапропель және бактериалды тыңайтқыштар және қордалар