Содержание
- 2. Консультации Четверг 15-25-18-30 д/з №3635 Методичка к лабораторным работам
- 3. ЭлектронЭлектрон имеет двойственную природу (частица и волна). Движение электрона подчиняется законам квантовой механики. Связь между волновыми
- 4. Энергию и координаты электрона, невозможно одновременно измерить с одинаковой точностью (принцип неопределенности Гейзенберга) Часть пространства, в
- 5. Свойства электрона
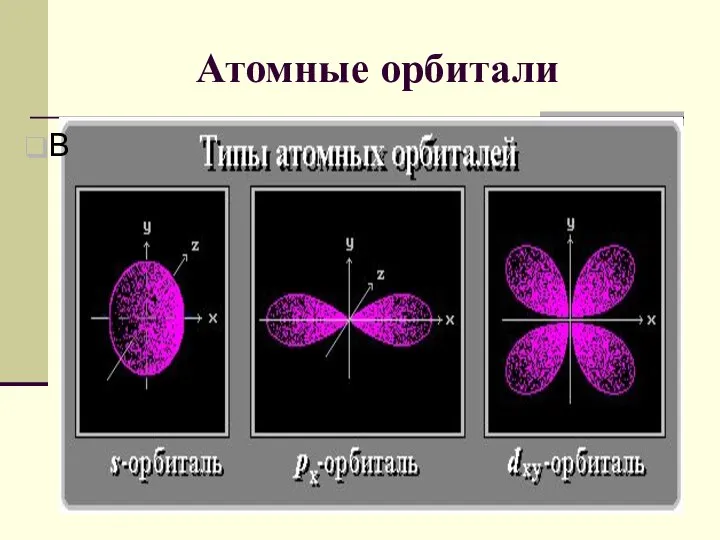
- 6. Атомные орбитали В
- 7. Квантовые числа Квантовые числа - энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой
- 8. Квантовые числа 2. Орбитальное (побочное) квантовое число l определяет форму атомной орбитали. Значения от 0 до
- 9. Квантовые числа 3. Магнитное квантовое число m определяет ориентацию орбитали в пространстве относительно внешнего магнитного или
- 10. Квантовые числа 4.Спиновое квантовое число s может принимать лишь два возможных значения +1/2 и -1/2. Они
- 11. Пример орбиталей
- 12. Пример орбиталей
- 13. Заполнение атомных орбиталей электронами При заполнении атомных орбиталей электронами соблюдаются три основные правила. Принцип Паули. Правило
- 14. Заполнение атомных орбиталей электронами Принцип Паули: В атоме не может быть двух электронов, у которых все
- 15. Заполнение атомных орбиталей электронами Принцип Хунда: Устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического
- 17. Скачать презентацию













 Производство серной кислоты
Производство серной кислоты Химия высокомолекулярных соединений (ВМС)
Химия высокомолекулярных соединений (ВМС) Особенности органических реакций
Особенности органических реакций Растительные жиры. Пальмовое масло
Растительные жиры. Пальмовое масло Химия: основные законы
Химия: основные законы Интерактивное пособие по химии
Интерактивное пособие по химии Химический состав клетки. Нуклеиновые кислоты. ДНК. РНК, АТФ
Химический состав клетки. Нуклеиновые кислоты. ДНК. РНК, АТФ Презентация по Химии "Теория тарелок. Хроматографические идентификация. Количественный анализ" - скачать смотреть
Презентация по Химии "Теория тарелок. Хроматографические идентификация. Количественный анализ" - скачать смотреть  Лекарственные растения и сырье, содержащие витамины. (Лекция 5)
Лекарственные растения и сырье, содержащие витамины. (Лекция 5) Выращивание кристаллов в домашних условиях
Выращивание кристаллов в домашних условиях Группа веществ, изолируемых из объектов путём минерализации биологического материала (Продолжение)
Группа веществ, изолируемых из объектов путём минерализации биологического материала (Продолжение) Экология микроорганизмов. (Лекция 8)
Экология микроорганизмов. (Лекция 8) Кетоны
Кетоны Определение качественного состава минеральных вод
Определение качественного состава минеральных вод Химия биогенных элементов. Лекция 14
Химия биогенных элементов. Лекция 14 Презентация на тему Экологические проблемы Казахстана
Презентация на тему Экологические проблемы Казахстана  Технология приготовления липосомальных форм лекарственных препаратов и их применение
Технология приготовления липосомальных форм лекарственных препаратов и их применение Компьютерные программы для оценки устойчивости, биоконцентрирования и токсичности химических веществ
Компьютерные программы для оценки устойчивости, биоконцентрирования и токсичности химических веществ Лекарственные средства, производные пиридина и пиперазина
Лекарственные средства, производные пиридина и пиперазина Цікаві факти про хімію
Цікаві факти про хімію Реакция Пфитцингера
Реакция Пфитцингера Алюминий. Сплавы алюминия
Алюминий. Сплавы алюминия Химическая промышленность Беларуси
Химическая промышленность Беларуси Нуклеиновые кислоты. Нуклеотиды
Нуклеиновые кислоты. Нуклеотиды Производные салициловой, пара-аминобензойной кислот, применяемые в медицине
Производные салициловой, пара-аминобензойной кислот, применяемые в медицине Хімічні властивості алканів
Хімічні властивості алканів Основания. Общая характеристика
Основания. Общая характеристика Растворы. Теория электролитической диссоциации (лекция 6)
Растворы. Теория электролитической диссоциации (лекция 6)