Содержание
- 2. Неметаллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы.
- 3. Нахождение в природе N o 2 2 s
- 4. Са5[PO4]3(F, Cl, ОН) АПАТИТ Аметист SiO 2
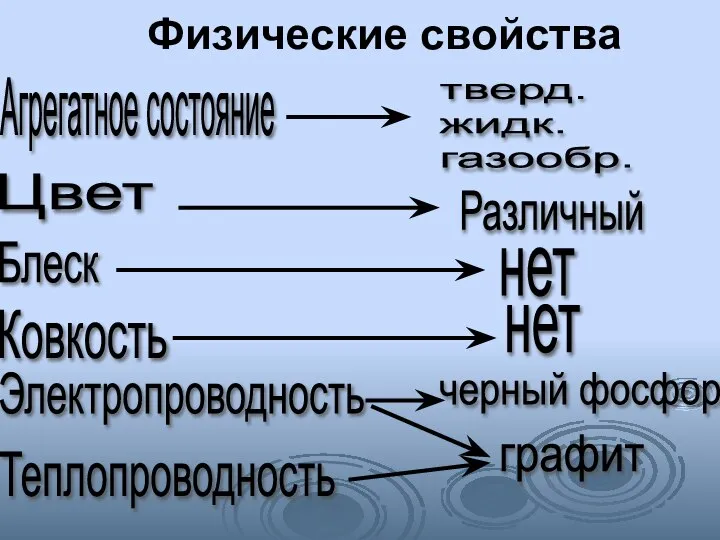
- 5. Физические свойства Агрегатное состояние тверд. жидк. газообр. Цвет Различный Блеск нет нет Ковкость Электропроводность черный фосфор
- 6. Взаимодействие с металлами: 2Na + Cl2 = 2NaCl, Fe + S = FeS, 6Li + N2
- 7. Взаимодействие с другими неметаллами: взаимодействуя с водородом, большинство неметаллов проявляет окислительные свойства, образуя летучие водородные соединения
- 8. при взаимодействии с фтором фтор является окислителем, а кислород – восстановителем: 2F2 + O2 = 2OF2;
- 9. Получение неметаллов Способы получения неметаллов отличаются многообразием и специфичностью, общих подходов не существует. Рассмотрим основные способы
- 10. Получение водорода. Основной промышленный способ получения водорода – конверсия метана (каталитический процесс): CH4 + H2O =
- 11. Кислород и азот получают фракционной перегонкой жидкого воздуха. Сера и углерод встречаются в природе в самородном
- 12. Применение неметаллов Водород используется в химической промышленности для синтеза аммиака, хлороводорода и метанола, применяется для гидрогенизации
- 14. Скачать презентацию


![Са5[PO4]3(F, Cl, ОН) АПАТИТ Аметист SiO 2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1254379/slide-3.jpg)







 Гиалурон қышқылы
Гиалурон қышқылы Растворы ВМС и их свойства
Растворы ВМС и их свойства Муниципальное общеобразовательное учреждение средняя общеобразовательная школа №1 с.Успенского Успенского района Краснодарско
Муниципальное общеобразовательное учреждение средняя общеобразовательная школа №1 с.Успенского Успенского района Краснодарско Растворы и их классификация
Растворы и их классификация Уксусная кислота
Уксусная кислота Функціональні похідні аліфатичних вуглеводнів галогенопохідні вуглеводнів
Функціональні похідні аліфатичних вуглеводнів галогенопохідні вуглеводнів Производные пурина
Производные пурина Роль химии в жизни человека
Роль химии в жизни человека Алкадиены Учитель химии высшей квалификационной категории Соловова Е.А. МОУ СОШ №15
Алкадиены Учитель химии высшей квалификационной категории Соловова Е.А. МОУ СОШ №15 Основные понятия и законы химии
Основные понятия и законы химии Валентность химических элементов (8 класс)
Валентность химических элементов (8 класс) Закон сохранения массы веществ
Закон сохранения массы веществ Производные ненасыщенных полиокси-γ-лактонов
Производные ненасыщенных полиокси-γ-лактонов Строение атома
Строение атома Классификация витаминов. Витаминоподобные соединения
Классификация витаминов. Витаминоподобные соединения Великие русские химики
Великие русские химики Нанотехнологии в моей будущей профессии Работу выполнил выпускник КГОУ НПО ПУ №26 2010г., ныне учащийся 2 курса КГОУ СПО Педагогиче
Нанотехнологии в моей будущей профессии Работу выполнил выпускник КГОУ НПО ПУ №26 2010г., ныне учащийся 2 курса КГОУ СПО Педагогиче Физические и химические явления
Физические и химические явления Альдегиды и кетоны. Карбоновые и дикарбоновые кислоты
Альдегиды и кетоны. Карбоновые и дикарбоновые кислоты Хлориди.
Хлориди. Хром. Использование хрома
Хром. Использование хрома Углеводы
Углеводы МЕТАЛЛЫ диктант 9 класс
МЕТАЛЛЫ диктант 9 класс 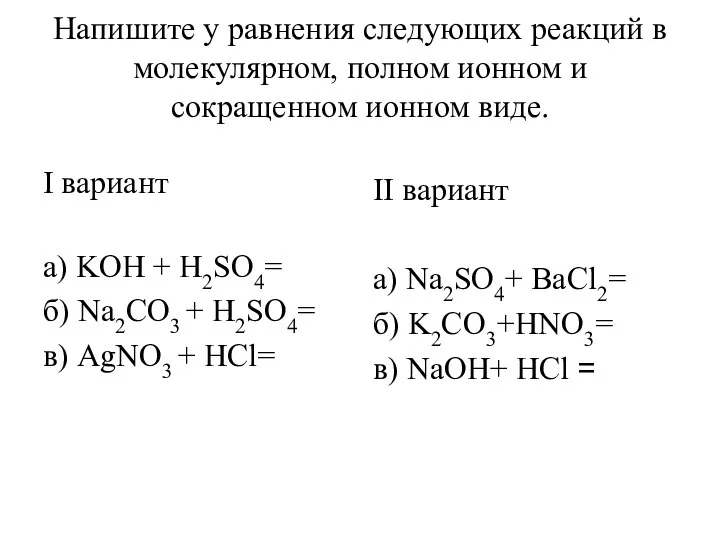 Уравнения реакций в молекулярном, полном ионном и сокращенном ионном виде
Уравнения реакций в молекулярном, полном ионном и сокращенном ионном виде Окислительновосстановительные реакции
Окислительновосстановительные реакции Вводные понятия к установке кристаллов
Вводные понятия к установке кристаллов Особенности переваривания и всасывания липидов. β – окисление жирных кислот в митохондриях
Особенности переваривания и всасывания липидов. β – окисление жирных кислот в митохондриях Алкены
Алкены