Содержание
- 2. Нитриды. Классификация солеобразные нитриды щелочных и щелочноземельных металлов легко гидролизуются водой ковалентные нитриды Si, C, P
- 3. Нитриды. Получение Нитриды металлов Прямая реакция металла с азотом Реакция металла с аммиаком Разложение амидов Взаимодействие
- 4. Нитриды AlN TiN BN I3N
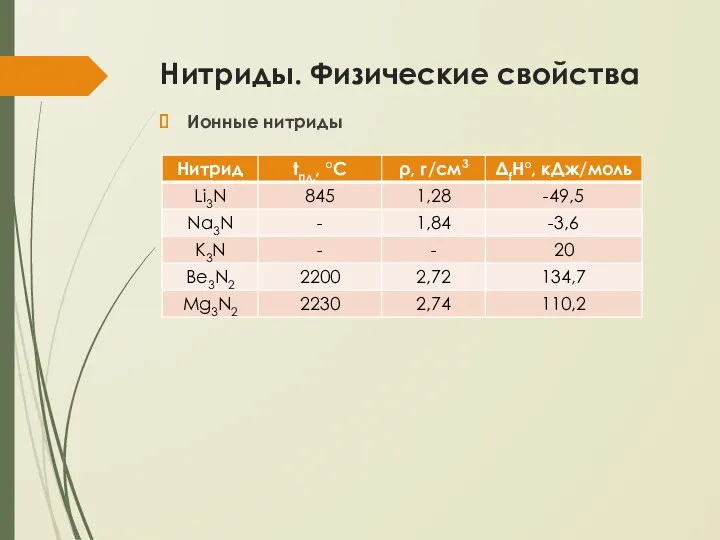
- 5. Нитриды. Физические свойства Ионные нитриды
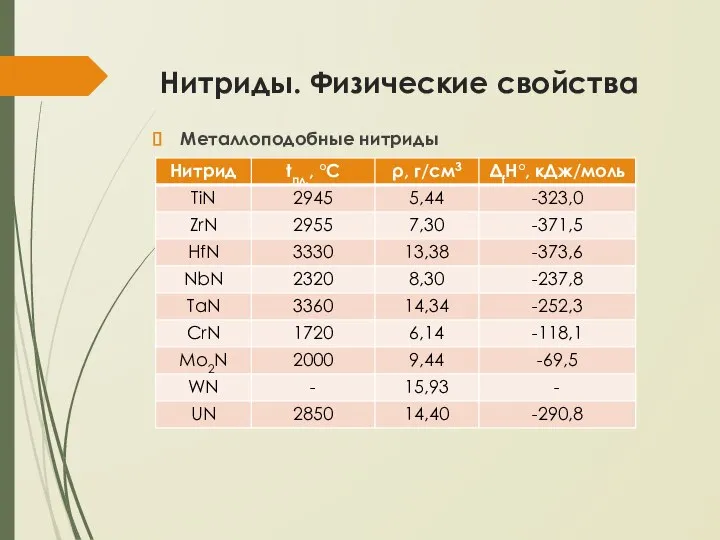
- 6. Нитриды. Физические свойства Металлоподобные нитриды
- 7. Нитриды. Химические свойства Гидролиз Взаимодействие с кислотами Окисление при нагревании на воздухе Металлоподобные нитриды разлагаются с
- 8. Нитриды. Применение
- 9. Литература Гринвуд Н., Эрншо А. Химия элементов. Том 1, М.: Бином, 2008 Самсонов Г. В. Нитриды,
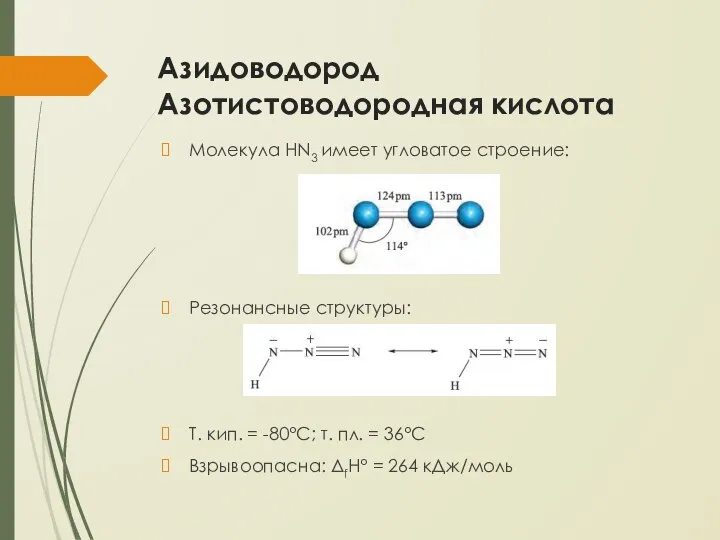
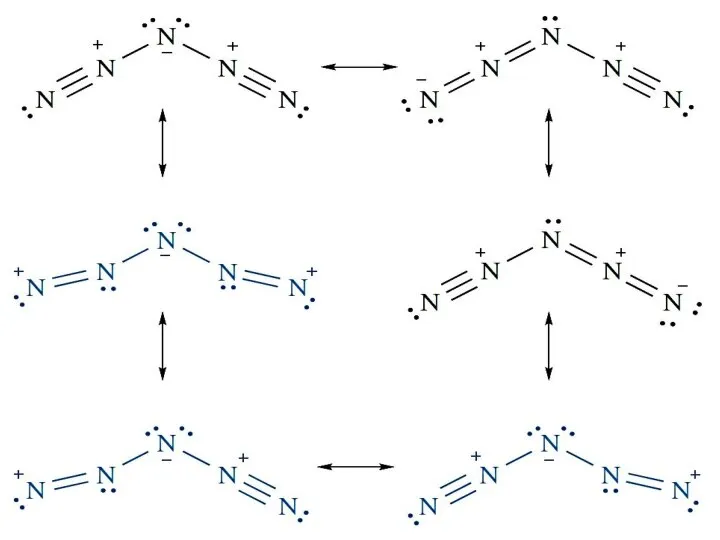
- 10. Азидоводород Азотистоводородная кислота Молекула HN3 имеет угловатое строение: Резонансные структуры: Т. кип. = -80°С; т. пл.
- 11. Азидоводород. Получение Из азидов щелочных металлов Взаимодействие гидразина с азотистой кислотой Нагревание амидов ЩМ в токе
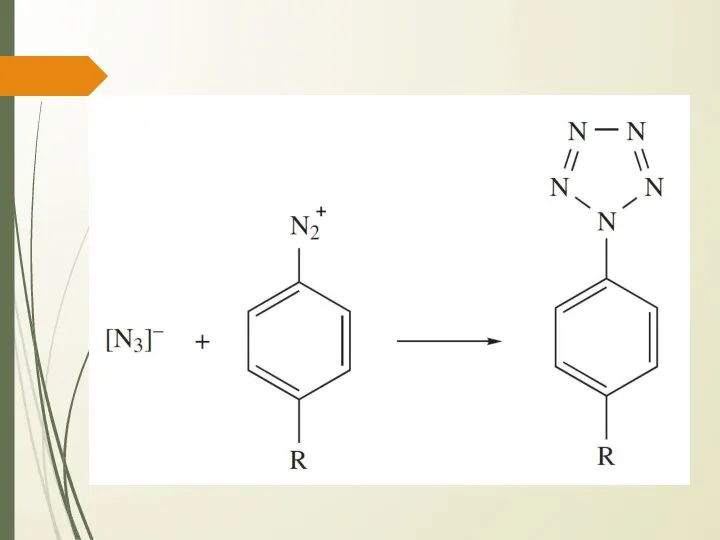
- 12. Азидоводород. Химические свойства В растворе медленно разлагается Взрывается при нагревании Окислительные свойства, связанные с ионом [N3]-
- 15. Азидоводород. Применение
- 16. Литература Гринвуд Н., Эрншо А. Химия элементов. Том 1, М.: Бином, 2008 Housecroft C. E., Sharpe
- 17. Гидразин и его гомологи Гидразин – N2H4 – дымящая бесцветная жидкость с резким запахом аммиака Триазан
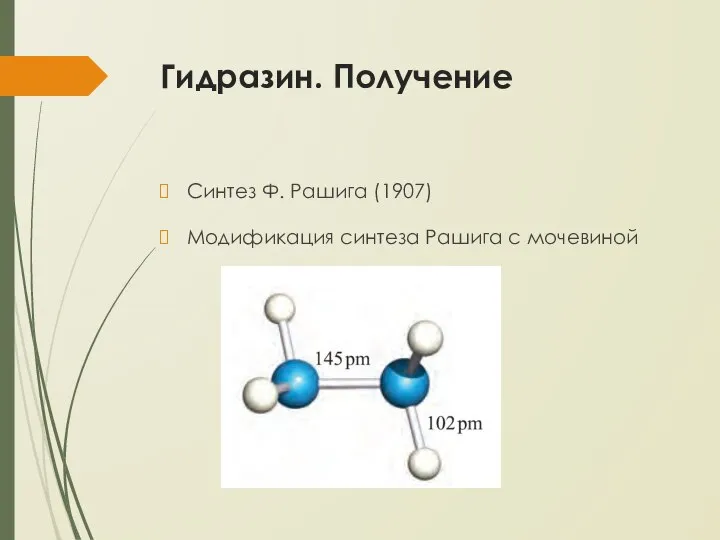
- 18. Гидразин. Получение Синтез Ф. Рашига (1907) Модификация синтеза Рашига с мочевиной
- 19. Гидразин. Физические свойства 0 100 0,99701 0,8903 1,3330 78,39 5,7·10-8 -285,85 -237,19 70,1
- 20. Гидразин. Химические свойства Горение на воздухе Окисление галогенами, кислородом и пероксидом водорода Окисление иодатами (количественное определение)
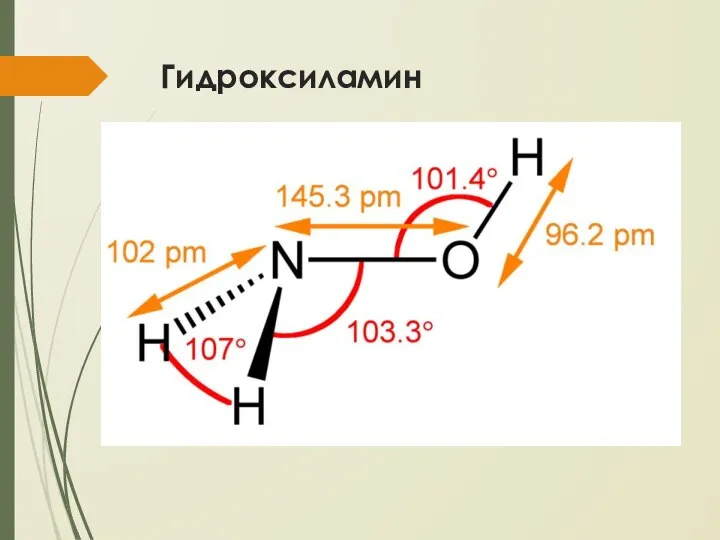
- 21. Гидроксиламин NH2OH – бесцветное термически неустойчивое гигроскопичное соединение с т. пл. 32,05°С Слабое основание К =
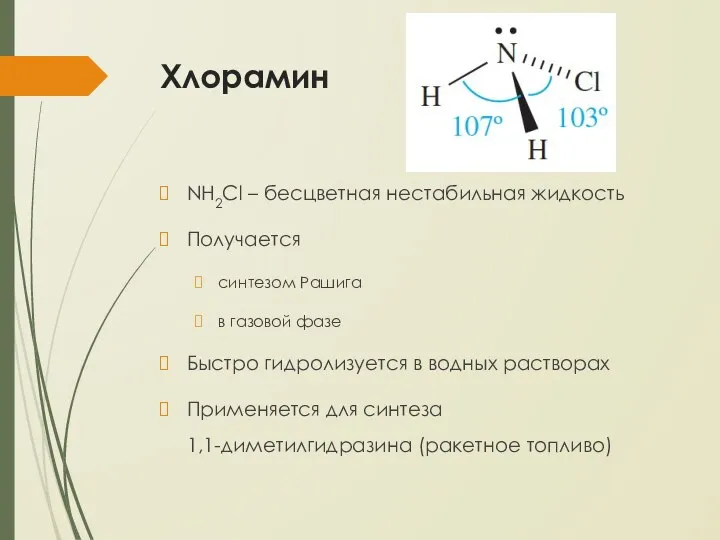
- 22. Хлорамин NH2Cl – бесцветная нестабильная жидкость Получается синтезом Рашига в газовой фазе Быстро гидролизуется в водных
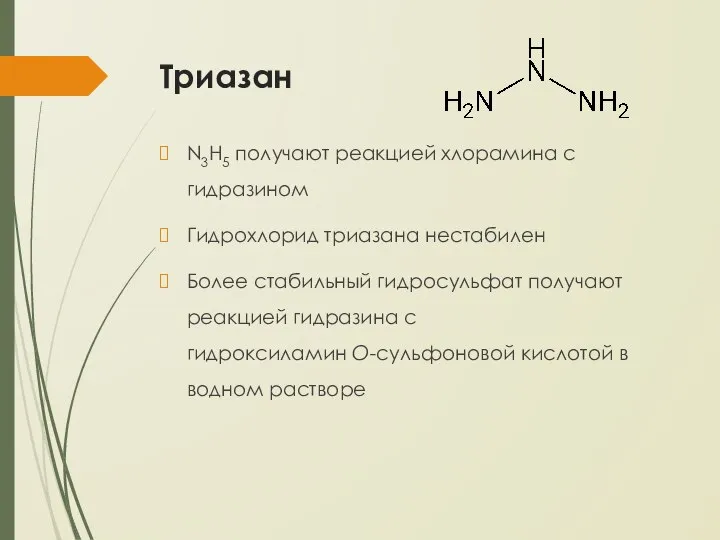
- 23. Триазан N3H5 получают реакцией хлорамина с гидразином Гидрохлорид триазана нестабилен Более стабильный гидросульфат получают реакцией гидразина
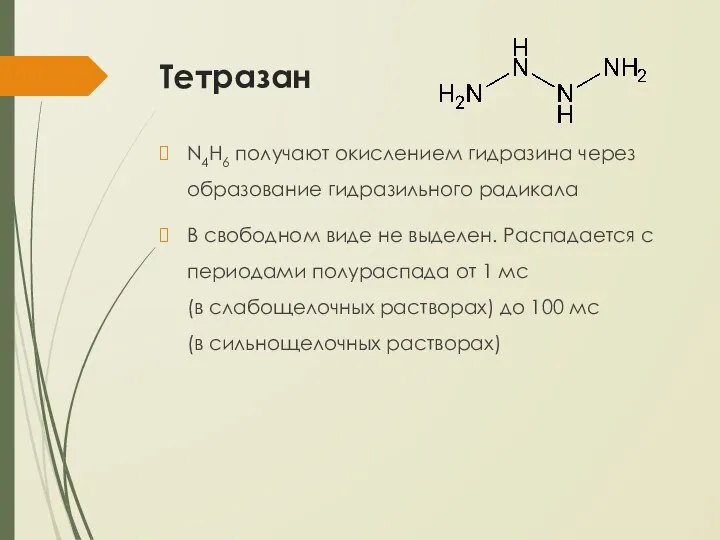
- 24. Тетразан N4H6 получают окислением гидразина через образование гидразильного радикала В свободном виде не выделен. Распадается с
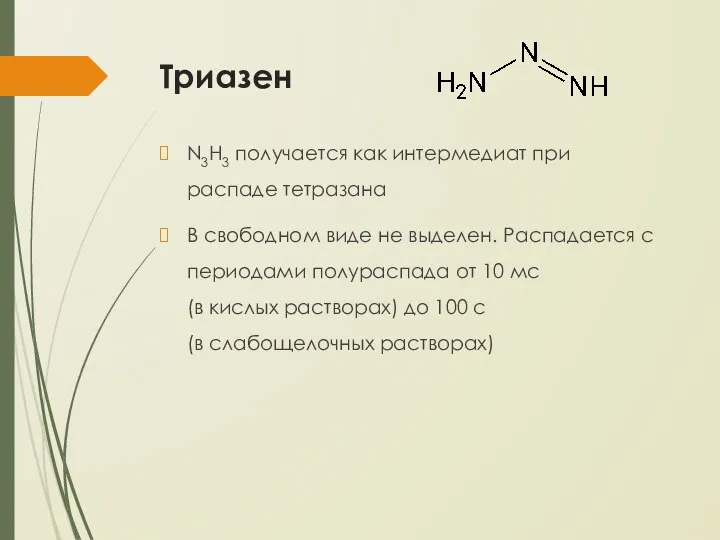
- 25. Триазен N3H3 получается как интермедиат при распаде тетразана В свободном виде не выделен. Распадается с периодами
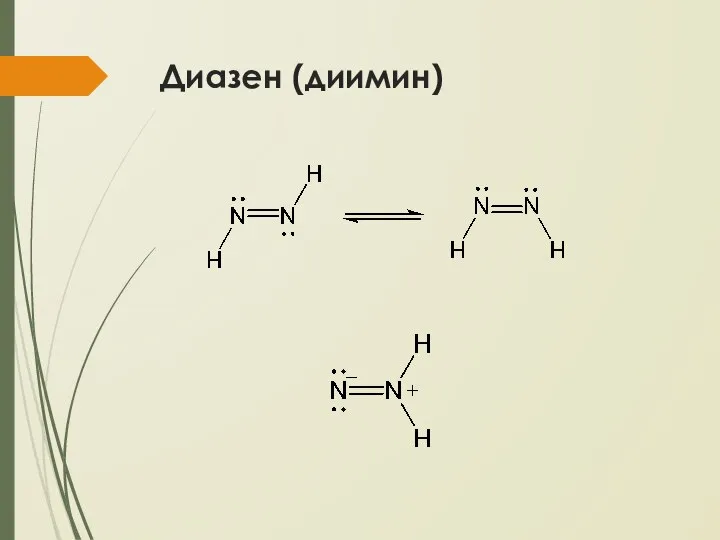
- 26. Диазен (диимин) N2H2 – нестабильное твердое вещество светло-желтого цвета Получают дегидрированием гидразина Лабораторный синтез - из
- 27. Диазен (диимин)
- 28. Литература Гринвуд Н., Эрншо А. Химия элементов. Том 1, М.: Бином, 2008 Housecroft C. E., Sharpe
- 29. Кислоты Азотистая Азотная Азотноватистая H2N2O2 Азотноватая H2N2O3 Пероксоазотная кислота HNO4 Ортоазотная кислота {H3NO4}
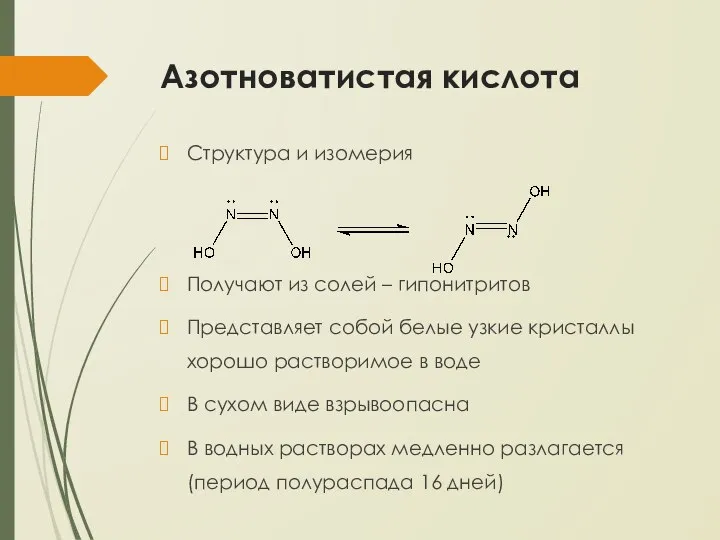
- 30. Азотноватистая кислота Структура и изомерия Получают из солей – гипонитритов Представляет собой белые узкие кристаллы хорошо
- 31. Азотноватая кислота Получают из соли Анджели Относится к кислотам средней силы Образует нерастворимые соли (оксогипонитриты) со
- 32. Ортоазотная кислота Не получена ни в каком виде Известны ее соли – ортонитраты Ортонитраты синтезируют из
- 33. Литература Гринвуд Н., Эрншо А. Химия элементов. Том 1, М.: Бином, 2008 Wiberg E., Wiberg N.
- 35. Скачать презентацию



















 Металлы. Электронная конфигурация, нахождение в природе, физические и химические свойства, применение металла
Металлы. Электронная конфигурация, нахождение в природе, физические и химические свойства, применение металла Роботу виконав: Желєзний Влад
Роботу виконав: Желєзний Влад  Презентация по химии Классы неорганических веществ
Презентация по химии Классы неорганических веществ Экологический проект Тема: Лабораторное исследование химического состава чипсов Работу выполнила Купавцева Татьяна
Экологический проект Тема: Лабораторное исследование химического состава чипсов Работу выполнила Купавцева Татьяна 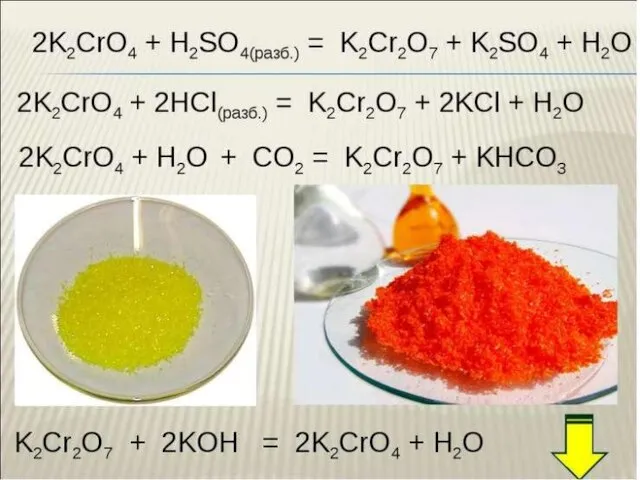 Хром. Соединения хрома
Хром. Соединения хрома Значение окислительно-восстановительных реакций в жизни человека
Значение окислительно-восстановительных реакций в жизни человека Радиогеохимия метаморфических процессов
Радиогеохимия метаморфических процессов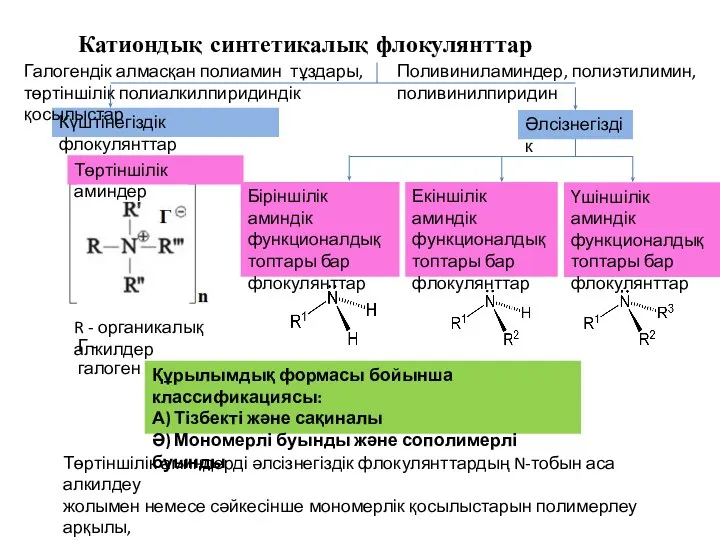 Катиондық синтетикалық флокулянттар
Катиондық синтетикалық флокулянттар Газовые законы
Газовые законы Нафта, вугілля, природний газ як вуглеводнева сировина. Основні види палива та їх значення в енергетиці країни.
Нафта, вугілля, природний газ як вуглеводнева сировина. Основні види палива та їх значення в енергетиці країни.  Структурная организация и функции клеточных мембран. (Лекция 2.1)
Структурная организация и функции клеточных мембран. (Лекция 2.1) Метод электронного баланса для уравнивания окислительно-восстановительных реакций
Метод электронного баланса для уравнивания окислительно-восстановительных реакций Классификация минералов по химическому принципу. Занятие 9
Классификация минералов по химическому принципу. Занятие 9 Презентация Галерея русских химиков
Презентация Галерея русских химиков  Презентация по Химии "Азотная кислота и ее соли" - скачать смотреть
Презентация по Химии "Азотная кислота и ее соли" - скачать смотреть  Неорганические и элементоорганические полимеры
Неорганические и элементоорганические полимеры  Химические свойства солей. Генетическая связь неорганических соединений
Химические свойства солей. Генетическая связь неорганических соединений Кислотность почвы
Кислотность почвы Полиазометины (полишиффовы основания)
Полиазометины (полишиффовы основания) Коллигативные свойства растворов
Коллигативные свойства растворов Иммунохимические методы. Иммуноферментный анализ (ИФА )
Иммунохимические методы. Иммуноферментный анализ (ИФА ) Волокна та їх властивості
Волокна та їх властивості Периодичность изменения свойств элементов и их соединений
Периодичность изменения свойств элементов и их соединений Фальсификация лакокрасочных материалов
Фальсификация лакокрасочных материалов Релаксационные свойства полимеров
Релаксационные свойства полимеров Сложные эфиры в жизни человека
Сложные эфиры в жизни человека Презентация к открытому уроку Учитель химии МОУ «Гимназия №1» г. Саратов Шишкина И.Ю.
Презентация к открытому уроку Учитель химии МОУ «Гимназия №1» г. Саратов Шишкина И.Ю.  Презентация по химии Дисахариды
Презентация по химии Дисахариды